Os receptores de transplante renal (RTR) utilizam medicamentos imunossupressores combinados: um corticosteroide, um inibidor de calcineurina (ciclosporina ou tacrolimo) e um antimetabólico (azatioprina [AZA] ou um precursor do ácido micofenólico [MPA] – micofenolato mofetil ou sódico) ou um inibidor de mTOR (imTOR) – sirolimo ou everolimo. Esses tratamentos aumentam a incidência de neoplasias, sobretudo dos cânceres de pele não melanoma (CPNM).
ObjetivosAvaliar as alterações histopatológicas na pele de RTR sob três diferentes regimes imunossupressores: um imTOR (sirolimo ou everolimo) ou um antimetabólico (AZA ou MPA), comparando‐os por grupos e com controles sadios.
Métodos: Estudo observacional, transversal e comparativo, em que 30 pacientes foram selecionados no Serviço de Transplante Renal e separados em três grupos: imTOR (n=10), MPA (n=10) e AZA (n=10). O grupo controle foi formado por 10 indivíduos, voluntários, imunocompetentes não transplantados. Todos os RTR estavam em uso de tacrolimo e prednisona. Foram realizadas duas biopsias de pele íntegra de cada participante, uma em área fotoprotegida e outra em área fotoexposta. As amostras foram avaliadas sem conhecimento prévio do grupo ao qual o indivíduo pertencia.
ResultadosA alteração histopatológica mais significante foi o adelgaçamento da epiderme no grupo imTOR, tanto na pele fotoexposta quanto na fotoprotegida.
Limitações do estudoO estudo foi realizado em número limitado de pacientes, o que pode influenciar na representatividade dos resultados.
ConclusõesApenas os RTR tratados com imTOR tiveram interrupção da proliferação epidérmica. Esses achados contribuem para a compreensão da influência dos três esquemas de imunossupressão e seus subsequentes efeitos potenciais no processo da carcinogênese.
A transplantação de órgãos, particularmente dos receptores de transplantes renais (RTR), teve avanço extraordinário, em grande parte pela otimização dos regimes imunossupressores, contribuindo significantemente para a redução das taxas de rejeição do enxerto e o aumento da sobrevida tanto do órgão quanto do paciente. As estratégias utilizadas para reduzir a imunogenicidade envolvem o uso de fármacos que bloqueiam a ação das células do sistema imune.1 Na fase de manutenção, emprega‐se uma combinação de três classes terapêuticas: um corticosteroide (prednisona) associado a um inibidor de calcineurina (CNI) (tacrolimo [TAC] ou ciclosporina [CsA]) e a um agente antiproliferativo: a azatioprina (AZA) ou um precursor do ácido micofenólico (MPA) (micofenolato de mofetila [MMF] ou micofenolato sódico [MPS]). Alternativamente, um desses agentes pode ser substituído por um inibidor da proteína alvo da rapamicina em mamíferos (imTOR, do inglês, mammalian target of rapamycin), como o everolimo (EVE) ou o sirolimo (SRL, também chamado de rapamicina). Mudanças posteriores, como minimizações e conversões, apenas são preconizadas quando motivadas por eventos adversos ou relacionados à falência de eficácia ou de segurança.2
O uso de medicação imunossupressora traz diversos efeitos secundários, entre eles os cutâneos, particularmente os cânceres de pele não melanoma (CPNM), responsáveis por cerca de 90% de todos os cânceres de pele em RTR, que apresentam epidemiologia e patogênese diferentes em comparação à população em geral.3–9 Com incidência muito maior em RTR, os CPNM geram morbidade e mortalidade substanciais em virtude de sua recorrência comum e maior potencial metastático. Dentre os CPNM, o carcinoma espinocelular (CEC) é o tipo mais comumente encontrado, sobrepujando o carcinoma basocelular (CBC).10 A proporção CEC/CBC é de 3–4:1, o inverso do observado na população em geral. As taxas de incidência de CPNM aumentam continuamente com o tempo após o transplante. Estima‐se em cerca de 2,25% em um ano para 4,95% em doi anos, 7,43% em três anos, e depois aumenta para 10% a 27% e 40% a 60% após 10 e 20 anos de imunossupressão, respectivamente.11 Em grandes séries, verifica‐se que os RTR apresentam aumento estimado de 65 a 250 vezes na incidência de CEC e aumento de 10 vezes na incidência de CBC ao se comparar com populações imunocompetentes.12–14 Essa reversão epidemiológica aumenta com a maior exposição solar e duração do pós‐transplante.15–19 Os RTR têm risco aumentado para desenvolver câncer de pele em áreas de pele fotoexpostas, como ocorre também com os indivíduos imunocompetentes.
Mecanismos diferentes pelos quais os medicamentos podem contribuir para o desenvolvimento do câncer de pele incluem o comprometimento da imunovigilância sistêmica e efeito oncogênico direto.14,16,20 Fator agravante é a exposição à radiação ultravioleta (RUV), pois além de interagir com certos fármacos, aumentando a fotossensibilidade da pele, causa mutações gênicas e exerce imunossupressão local ou sistêmica.21–23 A maioria dos tumores ocorre em locais de pele fotoexposta, em indivíduos de pele clara e naqueles com história de exposição crônica ao sol e/ou episódios de queimaduras solares na infância.24–26 A RUV causa mutações genéticas nos queratinócitos epidérmicos, que afetam a regulação do ciclo celular, suprime a resposta imune, inibe a expressão e a atividade das células apresentadoras de antígenos e compromete o reconhecimento de antígenos das células neoplásicas nos RTR. A localização geográfica onde os transplantados residem é fator agravante, em virtude do grau de exposição solar. Pacientes que vivem em países de alta exposição solar, como a Austrália, têm riscos de câncer de pele de 45% e 70%, após o transplante renal em 11 e 20 anos, respectivamente, e aqueles que vivem em países de exposição solar limitada, como a Holanda, têm riscos pós‐transplante em 10 e 20 anos de 10% e 40%, respectivamente.27–29 Outros fatores que colocam a população geral em risco para os CPNM também estão associados a maior risco nos RTR. Esses incluem idade avançada, principalmente em virtude da taxa cumulativa de exposição solar; pele clara (fototipos baixos, I–III de Fitzpatrick), história de câncer de pele prévio e ceratoses actínicas. Riscos adicionais incluem duração do tratamento imunossupressor, intensidade da imunossupressão, idade aumentada no momento do transplante, depleção de células CD4 no sangue e infecção pelo papilomavírus humano.5,14,30–33
Antes da descoberta das defesas imunológicas da pele, a interface cutânea era vista, apenas, como barreira passiva entre o indivíduo e o meio ambiente. Nas últimas décadas tornou‐se evidente que os aspectos mecânicos da defesa epidérmica são reforçados por um sistema versátil e robusto de vigilância imunológica.34 O papel específico dos fármacos imunossupressores no desenvolvimento de CEC tem sido objeto de muitos estudos nos últimos anos. Presume‐se que o comprometimento da imunovigilância contribua sobremaneira para a maior incidência dessas neoplasias. Os efeitos pró‐oncogênicos da AZA são conhecidos desde os primeiros anos da transplantação de órgãos. Os efeitos oncogênicos dos precursores do MPA não estão claramente definidos.35,36
A seguir, encontram‐se resumidos os mecanismos de ação dos três imunossupressores enfocados neste estudo.37
A AZA é um análogo de purina que é incorporado ao DNA celular, onde inibe a síntese de nucleotídeos de purina e interfere na síntese e no metabolismo de RNA. A AZA leva ao acúmulo do seu metabólito nucleotídeo 6‐tioguanina na cadeia de DNA, transformando‐a em um cromóforo que absorve luz no espectro da RUV‐A e, assim, é capaz de funcionar como fonte de fotoprodutos oxidativos. Pode ser identificado, também, um mecanismo de dano indireto por meio da inibição dos mecanismos de reparação nos queratinócitos da epiderme e consequente persistência dos fotoprodutos oriundos da RUV tipo B (RUV‐B).
O MPA é um inibidor reversível, seletivo e não competitivo da inosina monofosfato desidrogenase (IMPDH), uma enzima importante na síntese de novo de purina que atua como catalisadora na produção da guanosina trifosfato de novo necessária à proliferação de linfócitos. Bloquear a IMPDH inibe muitas funções dos linfócitos, sem afetar significantemente outras células. O MMF é o éster 2‐morfolinoetil semissintético do MPA que mostrou biodisponibilidade, tolerabilidade e eficácia. Efeitos adversos no trato gastrintestinal são frequentes, e para minimizá‐los foi desenvolvida a formulação MPS, que apresenta um revestimento gastrorresistente, dissociando‐se apenas no intestino. O uso desses fármacos está associado a risco significantemente menor de desenvolver malignidade em comparação com regimes de imunossupressão não baseados em MPA.
O mTOR é uma quinase chave no processo de divisão celular. O SRL e o EVE têm ação semelhante. Eles se ligam a uma imunofilina plasmática, o FKBP12 (FK Binding Protein), formando o complexo rapa/FKBP12 que inibe o mTOR (por isso são chamados inibidores do mTOR: imTOR). Isso reduz a transdução de sinais de ativação e proliferação de receptores da membrana dos linfócitos, principalmente aqueles associados ao receptor de interleucina 2 e do receptor de coestimulação linfocitária CD28.
O objetivo deste trabalho foi analisar comparativamente as alterações histopatológicas na pele fotoprotegida e na pele fotoexposta de transplantados renais em uso de três diferentes esquemas de imunossupressores (imTOR, MPA e AZA), comparando com indivíduos imunocompetentes não transplantados. Simultaneamente, foi feita análise no mesmo material sobre a expressão imuno‐histoquímica dos marcadores de linfócitos B, T totais, T auxiliares, T citotóxicos e células de Langerhans. Essa análise já foi publicada.38
Material e métodosEsta pesquisa foi aprovada pela Comissão de Ética para Análise de Projetos de Pesquisa da Instituição, sob número 1.685.977, estando em conformidade com os padrões éticos dos comitês nacionais e internacionais sobre experimentação em seres humanos (declaração de Helsinque). Os participantes foram selecionados a partir da população de transplantados renais que estavam em acompanhamento ambulatorial regular no Serviço de Transplante Renal (STR) da instituição. Consentimento informado por escrito foi obtido de todos os indivíduos que concordaram em participar deste estudo.
Critérios de inclusão e exclusãoPacientes transplantados renais, de ambos os sexos, com idade ≥ 18 anos, que estavam sob esquemas imunossupressores estáveis contendo imTOR ou MPA ou AZA, por período mínimo de 12 meses e máximo de 72 meses. Todos também estavam em uso de tacrolimo e prednisona. A terapia de indução foi realizada com timoglobulina (ATG) ou basiliximabe. A insuficiência renal influencia fatores imunológicos, podendo atuar como potencial viés sobre o desfecho estudado. Por isso, os pacientes foram selecionados com função renal estável, com taxa de filtração glomerular estimada (TFGe) ≥ 45mL/min/1,73 m2, correspondendo a estágio ≤ G3a da classificação do KDIGO (Kidney Disease: Improving Global Outcomes) e estimada pela fórmula de CKD‐EPI (Chronic Kidney Disease Epidemiology Collaboration). Os pacientes apresentavam fototipos II, III, IV ou V, segundo a classificação de Fitzpatrick (1988). Os pacientes foram divididos em três grupos: grupo 1 ou grupo imTOR: pacientes em uso de inibidores de mTOR (EVE ou SRL); grupo 2 ou grupo MPA: em uso de precursores do ácido micofenólico (MMF ou MPS); grupo 3 ou grupo AZA: em uso de azatioprina. Foram excluídos transplantados de qualquer órgão além do rim; fototipos de pele I e VI, segundo a classificação de Fitzpatrick (fototipos extremos poderiam atuar como viés); eventos neoplásicos prévios e/ou atuais; imunodeficiências não relacionadas ao transplante renal; em uso de outros imunossupressores além dos indicados neste estudo. Para comparação, foram incluídos indivíduos sadios não transplantados (grupo controle – GC) constituído por voluntários com idade ≥ 18 anos, de ambos os sexos e que não apresentavam história de doença de pele. Da mesma maneira, foram excluídos indivíduos com fototipos de pele I e VI segundo a classificação de Fitzpatrick, com histórico de eventos neoplásicos prévios e/ou atuais e de imunodeficiências primária ou secundária.
Para todos os indivíduos do estudo foram investigadas as variáveis relativas: ao sexo; à idade (anos completos); ao fototipo de pele; à dosagem de creatinina sérica (em mg/dL) nos últimos três meses e correspondente TFGe. Para os transplantados, foram avaliadas as variáveis clínicas relacionadas: ao tipo de terapia de indução (ATG ou basiliximabe); ao tipo de imunossupressor de manutenção (EVE, SRL, MPS, MMF ou AZA) e ao tempo de imunossupressão de manutenção (em meses completos).
Foram realizadas duas biopsias em pele íntegra, tanto nos pacientes quanto nos controles, uma na face interna do braço (área não exposta à radiação solar – fotoprotegida) e outra no dorso da mão ipsilateral (área exposta à luz solar – fotoexposta). Empregou‐se punch de 4mm de diâmetro utilizando‐se anestesia local infiltrativa com lidocaína a 2%, sem vasoconstritor. As amostras foram colocadas em solução fixadora de formol a 10%, tamponado com sais de fosfato Ph 7,4. Os espécimes foram processados por técnicas histológicas de rotina e incluídos em parafina. Foram feitos cortes histológicos sequenciais de 4μm de espessura, montados em lâminas de vidro e corados por Hematoxilina & eosina para estudo histopatológico.
A análise histopatológica foi feita sem conhecimento prévio do grupo ao qual o indivíduo pertencia. As variáveis avaliadas foram: a) estrato córneo da epiderme, classificando‐o quanto ao tipo morfológico em três categorias: em cesta, lamelar e compacto; b) estrato granuloso da epiderme, sendo definido pelo aspecto morfológico nos sítios cutâneos de pele não glabra segundo a espessura em três categorias: normal ou de espessura habitual (presença de uma a três camadas celulares), hipergranulose, quando havia espessamento desse estrato (número de camadas superior a três) e agranulose, quando da ausência dessa camada; c) número de camadas celulares do estrato espinhoso nos cones epiteliais (três cones/biopsia) e nos segmentos da epiderme entre cones epiteliais (três segmentos/biopsia), sendo anotadas as médias aritméticas/biópsia; d) grau de elastose solar, definido como a intensidade do material elastótico de coloração pálida ou basofílica presente na derme como: discreto (fibrilar); moderado (fibrilar e amorfa); intenso (amorfa); ausente (sem a presença desse material na derme); e) infiltrado inflamatório linfocitário, categorizado pela intensidade de células presentes em torno das estruturas vasculares superficiais e/ou profundas na derme em: discreto; moderado; intenso; ausente.
Cálculo do tamanho amostral e análise estatísticaPara determinação do número de indivíduos participantes (n) foi realizado o cálculo amostral, utilizando nível de significância de 5% e poder de 80%. A amostra calculada foi de 10 indivíduos em cada grupo.38 Assim, foram incluídos 30 pacientes transplantados renais e 10 voluntários saudáveis. Para as variáveis categóricas, utilizou‐se, respectivamente, por frequências absolutas (n) e relativas (%). Foram utilizados nessas análises os testes exato de Fisher para comparação das variáveis qualitativas entre os grupos; teste de Dunn com pós‐estimação de Bonferroni para variáveis quantitativas sem distribuição normal e ANOVA com correção de Bonferroni para as que apresentaram distribuição normal. Para as variáveis quantitativas, foram utilizadas médias e desvios padrão (DP) e medianas e intervalos interquartis (IIQ). O programa utilizado foi o Stata® (StataCorp, LC) versão 11.0.
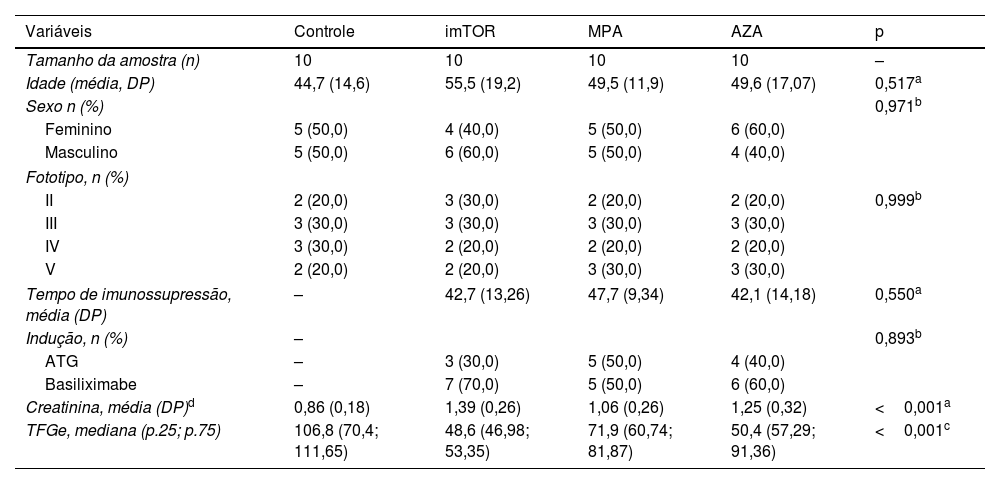
ResultadosDados demográficos, clínicos e laboratoriaisEsses dados encontram‐se resumidos na tabela 1.
Dados demográficos, clínicos e laboratoriais
| Variáveis | Controle | imTOR | MPA | AZA | p |
|---|---|---|---|---|---|
| Tamanho da amostra (n) | 10 | 10 | 10 | 10 | – |
| Idade (média, DP) | 44,7 (14,6) | 55,5 (19,2) | 49,5 (11,9) | 49,6 (17,07) | 0,517a |
| Sexo n (%) | 0,971b | ||||
| Feminino | 5 (50,0) | 4 (40,0) | 5 (50,0) | 6 (60,0) | |
| Masculino | 5 (50,0) | 6 (60,0) | 5 (50,0) | 4 (40,0) | |
| Fototipo, n (%) | |||||
| II | 2 (20,0) | 3 (30,0) | 2 (20,0) | 2 (20,0) | 0,999b |
| III | 3 (30,0) | 3 (30,0) | 3 (30,0) | 3 (30,0) | |
| IV | 3 (30,0) | 2 (20,0) | 2 (20,0) | 2 (20,0) | |
| V | 2 (20,0) | 2 (20,0) | 3 (30,0) | 3 (30,0) | |
| Tempo de imunossupressão, média (DP) | – | 42,7 (13,26) | 47,7 (9,34) | 42,1 (14,18) | 0,550a |
| Indução, n (%) | – | 0,893b | |||
| ATG | – | 3 (30,0) | 5 (50,0) | 4 (40,0) | |
| Basiliximabe | – | 7 (70,0) | 5 (50,0) | 6 (60,0) | |
| Creatinina, média (DP)d | 0,86 (0,18) | 1,39 (0,26) | 1,06 (0,26) | 1,25 (0,32) | <0,001a |
| TFGe, mediana (p.25; p.75) | 106,8 (70,4; 111,65) | 48,6 (46,98; 53,35) | 71,9 (60,74; 81,87) | 50,4 (57,29; 91,36) | <0,001c |
Os dados são apresentados como n, número absoluto com porcentagens (%), média (desvio padrão) e mediana (p.25; p.75: percentis 25 e 75, respectivamente). ATG, antimoglobulina; AZA, grupo azatioprina; DP, desvio padrão; imTOR, grupo inibidores de mTOR; MPA, grupo ácido micofenólico; n, frequência absoluta observada; p, nível de significância estatística; –, não se aplica dado numérico; TFGe, taxa de filtração glomerular estimada.
Os resultados da avaliação histopatológica dos cortes de pele fotoprotegida e de pele fotoexposta estão apresentados nas tabelas 2 e 3.
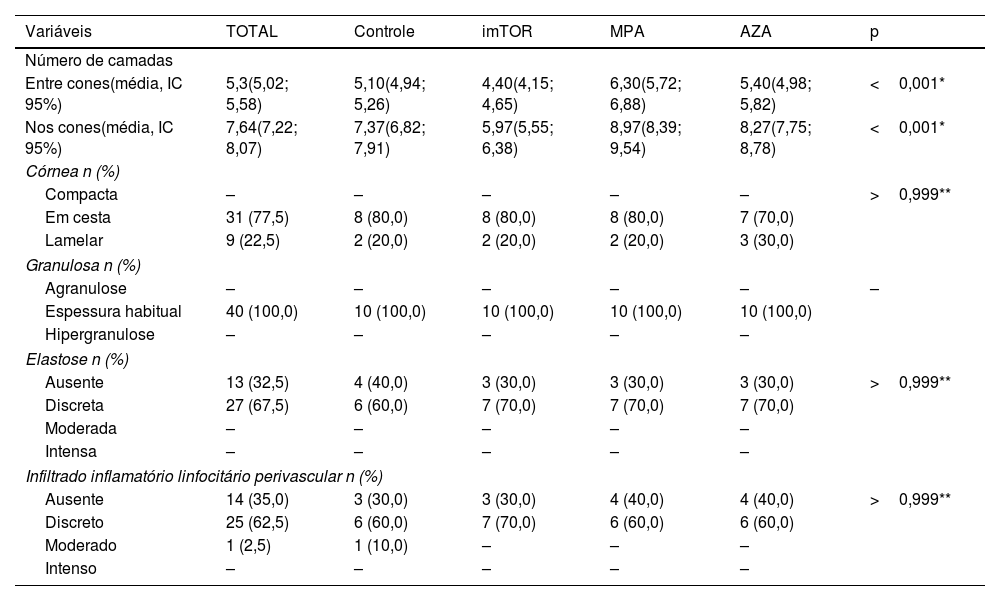
Distribuição dos dados histopatológicos em pele fotoprotegida, segundo os grupos
| Variáveis | TOTAL | Controle | imTOR | MPA | AZA | p |
|---|---|---|---|---|---|---|
| Número de camadas | ||||||
| Entre cones(média, IC 95%) | 5,3(5,02; 5,58) | 5,10(4,94; 5,26) | 4,40(4,15; 4,65) | 6,30(5,72; 6,88) | 5,40(4,98; 5,82) | <0,001* |
| Nos cones(média, IC 95%) | 7,64(7,22; 8,07) | 7,37(6,82; 7,91) | 5,97(5,55; 6,38) | 8,97(8,39; 9,54) | 8,27(7,75; 8,78) | <0,001* |
| Córnea n (%) | ||||||
| Compacta | – | – | – | – | – | >0,999** |
| Em cesta | 31 (77,5) | 8 (80,0) | 8 (80,0) | 8 (80,0) | 7 (70,0) | |
| Lamelar | 9 (22,5) | 2 (20,0) | 2 (20,0) | 2 (20,0) | 3 (30,0) | |
| Granulosa n (%) | ||||||
| Agranulose | – | – | – | – | – | – |
| Espessura habitual | 40 (100,0) | 10 (100,0) | 10 (100,0) | 10 (100,0) | 10 (100,0) | |
| Hipergranulose | – | – | – | – | – | |
| Elastose n (%) | ||||||
| Ausente | 13 (32,5) | 4 (40,0) | 3 (30,0) | 3 (30,0) | 3 (30,0) | >0,999** |
| Discreta | 27 (67,5) | 6 (60,0) | 7 (70,0) | 7 (70,0) | 7 (70,0) | |
| Moderada | – | – | – | – | – | |
| Intensa | – | – | – | – | – | |
| Infiltrado inflamatório linfocitário perivascular n (%) | ||||||
| Ausente | 14 (35,0) | 3 (30,0) | 3 (30,0) | 4 (40,0) | 4 (40,0) | >0,999** |
| Discreto | 25 (62,5) | 6 (60,0) | 7 (70,0) | 6 (60,0) | 6 (60,0) | |
| Moderado | 1 (2,5) | 1 (10,0) | – | – | – | |
| Intenso | – | – | – | – | – | |
Os dados são apresentados como n, número absoluto com porcentagens (%) e médias. AZA, grupo azatioprina; DP, desvio padrão; 95% IC, intervalo de confiança de 95%; imTOR, grupo inibidores de mTOR; MPA, grupo ácido micofenólico; n, frequência absoluta observada; p, nível de significância estatística; –, não se aplica dado numérico.
a ANOVA.
b Teste de Fisher.
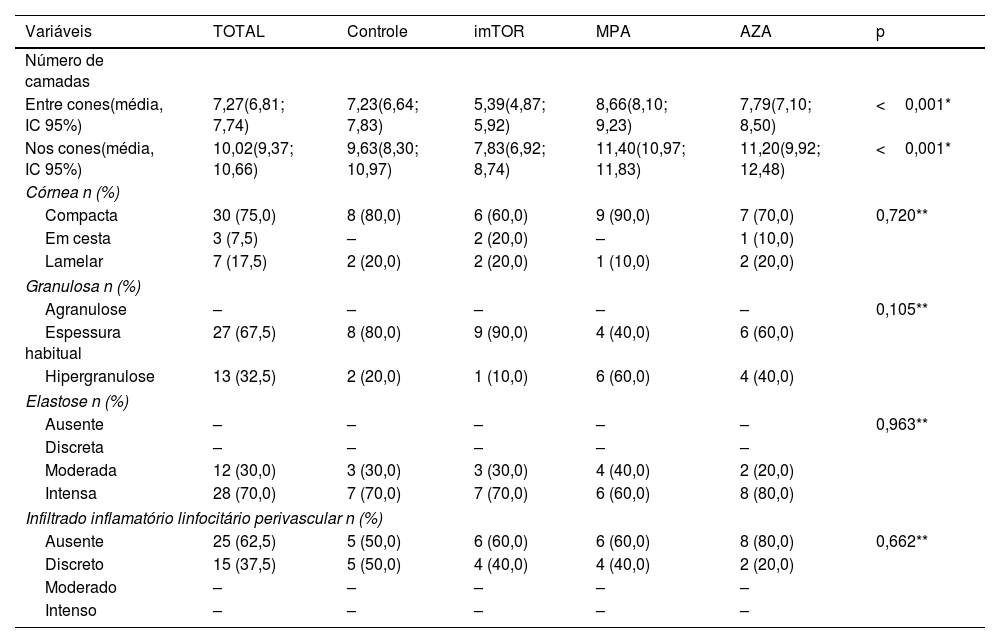
Distribuição dos dados histopatológicos em pele fotoexposta, segundo os grupos
| Variáveis | TOTAL | Controle | imTOR | MPA | AZA | p |
|---|---|---|---|---|---|---|
| Número de camadas | ||||||
| Entre cones(média, IC 95%) | 7,27(6,81; 7,74) | 7,23(6,64; 7,83) | 5,39(4,87; 5,92) | 8,66(8,10; 9,23) | 7,79(7,10; 8,50) | <0,001* |
| Nos cones(média, IC 95%) | 10,02(9,37; 10,66) | 9,63(8,30; 10,97) | 7,83(6,92; 8,74) | 11,40(10,97; 11,83) | 11,20(9,92; 12,48) | <0,001* |
| Córnea n (%) | ||||||
| Compacta | 30 (75,0) | 8 (80,0) | 6 (60,0) | 9 (90,0) | 7 (70,0) | 0,720** |
| Em cesta | 3 (7,5) | – | 2 (20,0) | – | 1 (10,0) | |
| Lamelar | 7 (17,5) | 2 (20,0) | 2 (20,0) | 1 (10,0) | 2 (20,0) | |
| Granulosa n (%) | ||||||
| Agranulose | – | – | – | – | – | 0,105** |
| Espessura habitual | 27 (67,5) | 8 (80,0) | 9 (90,0) | 4 (40,0) | 6 (60,0) | |
| Hipergranulose | 13 (32,5) | 2 (20,0) | 1 (10,0) | 6 (60,0) | 4 (40,0) | |
| Elastose n (%) | ||||||
| Ausente | – | – | – | – | – | 0,963** |
| Discreta | – | – | – | – | – | |
| Moderada | 12 (30,0) | 3 (30,0) | 3 (30,0) | 4 (40,0) | 2 (20,0) | |
| Intensa | 28 (70,0) | 7 (70,0) | 7 (70,0) | 6 (60,0) | 8 (80,0) | |
| Infiltrado inflamatório linfocitário perivascular n (%) | ||||||
| Ausente | 25 (62,5) | 5 (50,0) | 6 (60,0) | 6 (60,0) | 8 (80,0) | 0,662** |
| Discreto | 15 (37,5) | 5 (50,0) | 4 (40,0) | 4 (40,0) | 2 (20,0) | |
| Moderado | – | – | – | – | – | |
| Intenso | – | – | – | – | – | |
Os dados são apresentados como média e respectivos intervalos de confiança de 95%. AZA, grupo azatioprina; DP, desvio padrão; 95% IC, intervalo de confiança de 95%; imTOR, grupo inibidores de mTOR; MPA, grupo ácido micofenólico; n, frequência absoluta observada; p, nível de significância estatística; –, não se aplica dado numérico.
a ANOVA.
b Teste de Fisher.
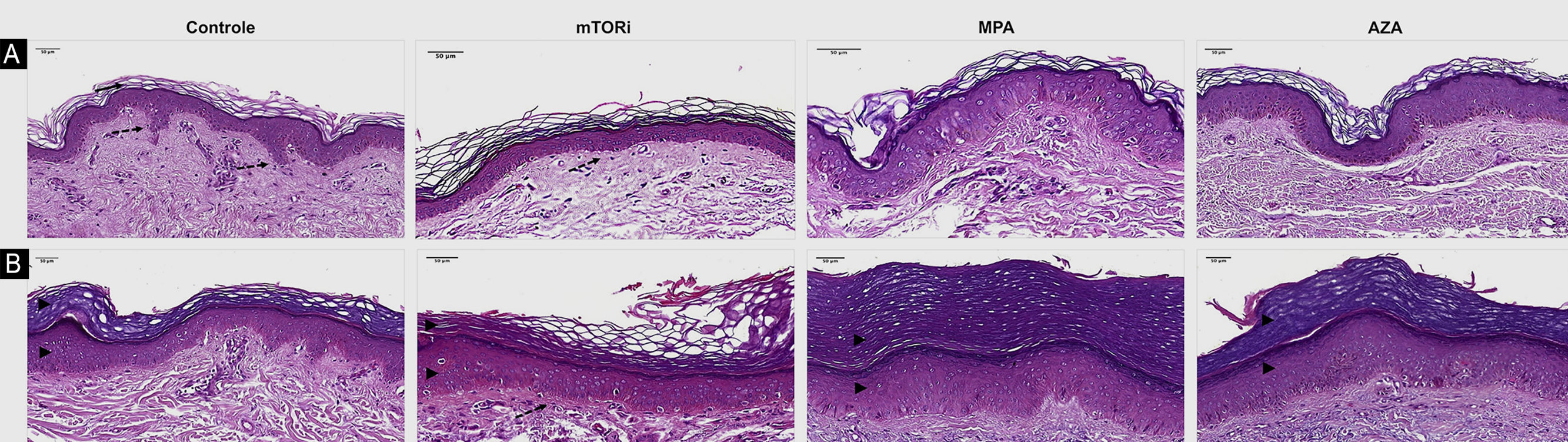
A pele fotoprotegida revelou estrato córneo com aspectos morfológicos “em cesta” (31/40; 77,5%) e lamelar (9/40; 22,5%). Esses achados foram vistos com igualdade na pele fotoprotegida dos quatro grupos. Em contrapartida, a análise dos fragmentos de pele fotoexposta demonstrou estrato córneo espesso e compacto em 30 casos (30/40, 75%) (fig. 1).
Diferenças histopatológicas relativas à análise epidérmica das peles fotoprotegida (A) e fotoexposta (B) dos grupos controle e de receptores de transplante renal submetidos aos esquemas de imunossupressão com inibidores de mTOR (imTOR), ácido micofenólico (MPA) e azatioprina (AZA). O grupo controle exibe epiderme com estrato córneo em “trama de cesto”, típica de locais de pele sã não acral fotoprotegida (seta) e cones epiteliais bem demarcados (seta descontínua). O grupo imTOR revela estrato córneo lamelar, número reduzido de camadas celulares epidérmicas e retificação dos cones epiteliais, tanto na pele fotoprotegida (seta descontínua – A) quanto na fotoexposta (B). Em regra, as amostras de pele fotoexposta (B) exibem epiderme mais espessa com hiperceratose e aumento do número de camadas celulares nos cones epiteliais e nos segmentos epidérmicos entre os cones, sendo esses aspectos mais acentuados nos grupos MPA (cabeças de seta) e AZA (Hematoxilina & eosina, 40×; barra de escala 50μm).
O estrato granuloso da epiderme se apresentou com sua espessura habitual na pele protegida dos indivíduos de todos os grupos (40/40; 100% – tabela 2). Por outro lado, a pele da região exposta à luz solar demonstrou hiperplasia do estrato granuloso da epiderme (hipergranulose) em 13 indivíduos, o que corresponde a 32,5% dos indivíduos dessa amostra (13/40), dos quais seis deles eram do grupo MPA (6/10; 60%), quatro do grupo AZA (4/10; 40%), dois do grupo controle (2/10; 20%) e um do grupo imTOR (1/10; 10% – tabela 3).
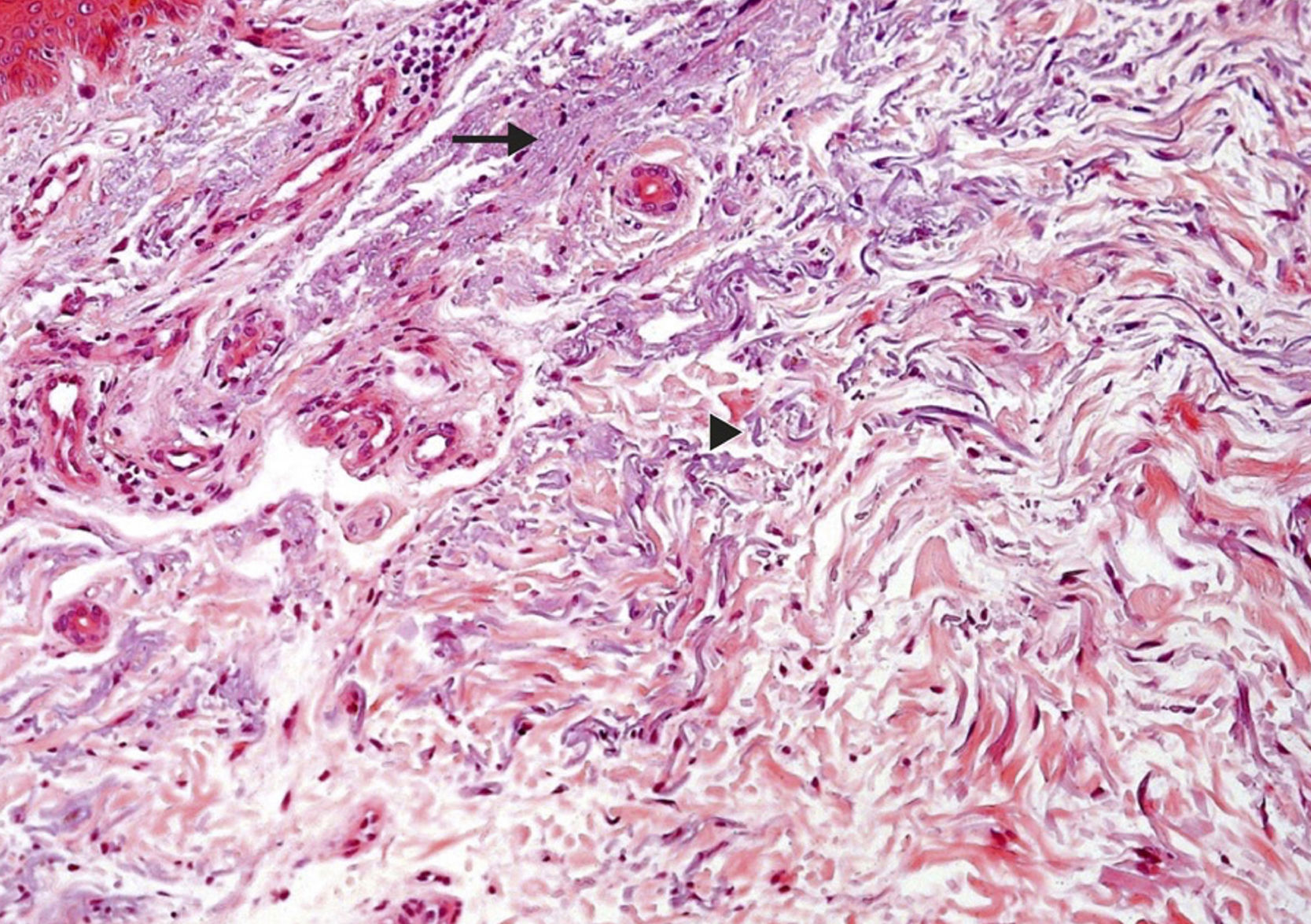
Em relação às alterações dérmicas, o achado mais expressivo foi a elastose solar da pele fotoexposta (fig. 2). Todos os espécimes de pele de área fotoexposta se mostraram com elastose solar mais pronunciada na derme superficial. Verificou‐se na pele fotoexposta intensa alteração elastótica, com presença de material basofílico amorfo profuso na derme superficial de 28 indivíduos (28/40; 70%) e em 12 observou‐se alteração elastótica moderada caracterizada pela presença de material basofílico fibrilar e algumas áreas amorfas na derme superficial (12/40; 30% – tabela 3). Por outro lado, na pele fotoprotegida, observou‐se discreta alteração elastótica com ínfima basofilia fibrilar na derme papilar em 27 indivíduos (27/40; 67,5%) e ausência de elastose dérmica em 13 (13/40; 32,5 – tabela 2).
Caracterização histopatológica dos aspectos dérmicos encontrados na pele fotoexposta de transplantado renal do grupo imTOR. A elastose solar é caracterizada por áreas basofílicas amorfas (seta) e fibrilares (cabeça da seta) do tecido conjuntivo dérmico, onde as fibras elásticas perdem suas características usuais (Hematoxilina & eosina, 200×). imTOR, grupo inibidores de mTOR.
Quanto ao infiltrado inflamatório, na derme os linfócitos perivasculares se mostraram discretos ou mesmo ausentes, tanto na pele fotoexposta quanto na pele fotoprotegida dos transplantados e controles. A pele protegida revelou infiltrado linfocitário em torno dos vasos dérmicos superficiais de intensidade moderada em um indivíduo (1/40; 2,5%) do grupo controle e discreta em 25 indivíduos (25/40; 62,5%). Desses últimos, sete eram do grupo imTOR (7/10; 70%), seis do grupo MPA (6/10; 60%), seis do grupo AZA (6/10; 60%) e seis do GC (6/10; 60% – tabela 2). Já na pele exposta à luz solar, observou‐se discreto infiltrado linfocitário perivascular superficial dérmico em 15 indivíduos (15/40; 37,5%). Desses, cinco eram do GC (5/10; 50%), quatro do grupo imTOR (4/10; 40%), quatro do grupo MPA (4/10; 40%) e dois do grupo AZA (2/10; 20% – tabela 3).
Foram verificadas diferenças de médias do número de camadas celulares nos cones (p <0,001) e nos segmentos da epiderme entre os cones (p <0,001) de pele protegida e exposta à luz solar entre os quatro grupos. Observa‐se que nos pacientes dos grupos MPA e AZA figuram os maiores valores médios do número de camadas celulares nos cones e nos segmentos epidérmicos entre os cones. Esses achados foram observados tanto na pele fotoexposta quanto na pele fotoprotegida dos indivíduos do grupo MPA.
DiscussãoEm relação aos dados demográficos, os grupos de estudo foram homogêneos, sem diferenças significantes de sexo, idade ou fototipo de pele. Do ponto de vista dos dados clínicos, as características relacionadas ao tipo de indução e duração do esquema imunossupressor foram semelhantes nos pacientes dos três grupos. Não foram encontradas diferenças no tempo de exposição aos três medicamentos. Esses dados permitiram, assim, uma comparação justa entre os grupos. A análise comparativa da função renal dos grupos (realizada apenas entre os RTR, já que não cabe comparação com os controles sadios que apresentam os dois rins nativos) apontou que o valor médio da creatinina sérica foi maior no grupo imTOR que nos grupos AZA e MPA, enquanto a TFGe foi maior no grupo MPA que nos grupos imTOR e AZA, porém não foi possível fornecer explicação confiável para esses achados.
Alguns achados morfológicos foram vistos com igualdade na pele fotoprotegida dos quatro grupos, revelando alterações cutâneas leves que parecem não estar atreladas à fotoexposição nem à terapia imunossupressora. Por outro lado, a atrofia epidérmica associada à terapia com imTOR foi a alteração histopatológica mais insigne deste estudo, caracterizada pela diminuição da espessura da epiderme decorrente da redução do número de camadas do estrato espinhoso. Isso foi visto tanto na pele fotoprotegida quanto na pele fotoexposta desse grupo quando comparada com a espessura epidérmica dos demais grupos. Essa redução da proliferação epidérmica pode representar menor risco de ocorrência de mutações carcinogênicas, configurando a atrofia epidérmica no grupo imTOR como potencial efeito para prevenção da carcinogênese em RTR. Esse achado de atrofia epidérmica da pele do grupo imTOR foi corroborado por um estudo que mostrou redução na proliferação de células progenitoras da camada basal, levando a uma epiderme atrófica durante o desenvolvimento embrionário. Além disso, deve‐se considerar que a via mTOR também está envolvida na ação do receptor do fator de crescimento epidérmico, que é um ativador potente de muitas quinases, incluindo a serina/treonina quinase mTOR.39 Nos espécimes de pele fotoexposta de todos os grupos do estudo, quando comparados com os de pele fotoprotegida, observou‐se hiperplasia epidérmica resultante da maior proliferação dos queratinócitos, o que ratifica ser esse tipo de alteração patológica na pele mediada pela RUV‐B. Tal alteração foi mais preeminente na pele fotoexposta dos grupos MPA e AZA. Esses dados relacionados à maior espessura do estrato espinhoso da epiderme em área de pele fotoexposta não é um achado inusitado, estando esse efeito reacional à exposição solar já bem descrito. Um estudo mostrou que a estimulação da epiderme pela RUV‐B promove a hiperproliferação das células da camada basal nos cones e nos segmentos da epiderme entre os cones, com aumento do número de camadas celulares.40 A maior proliferação epidérmica vista na pele fotoexposta dos grupos MPA, AZA e controle, quando comparados ao grupo imTOR, não exclui o papel da sinalização da via mTOR ativada pela RUV na proliferação celular e das cascatas de sinalização pró‐sobrevivência dos queratinócitos epidérmicos da pele desses pacientes.
ConclusõesAs análises histológicas realizadas comparativamente na pele de RTR em uso dos esquemas de imunossupressão imTOR, MPA e AZA, em relação ao GC, demonstraram que o imTOR foi superior em relação aos demais no que concerne à manutenção de alguns mecanismos de controle que podem estar atrelados à carcinogênese cutânea, já que apenas o imTOR conteve a proliferação da epiderme. A alteração morfológica mais singular deste estudo foi a atrofia epidérmica da pele dos RTR tratados com imTOR tanto na pele fotoexposta quanto na pele fotoprotegida desses pacientes.
A partir de dados obtidos neste estudo, pode‐se sugerir que a utilização da terapia com imTOR, comparada ao uso de MPA e AZA, pode ser recomendada como esquema imunossupressor nos pacientes que já apresentem neoplasia ou que tenham risco aumentado para desenvolver cânceres de pele relacionados à fotoexposição, como os CPNM. Entretanto, não há dados suficientes para definir se o melhor seria substituir MPA ou AZA por imTOR em pacientes com câncer de pele estabelecido ou se seria mais vantajoso acrescentar a medicação ao esquema em uso. No caso da AZA, especificamente, por ela ser reconhecida como carcinogênica, é possível que seja melhor sua suspensão e substituição por imTOR.
Suporte financeiroEsta pesquisa recebeu apoio financeiro do Fundo de Apoio à Dermatologia do Estado de São Paulo – Sebastião Sampaio (FUNADERSP).
Contribuição dos autoresMaria Victória Quaresma: Pesquisadora principal.
Luiz Sergio Azevedo: Idealizador da pesquisa; Orientador da parte nefrológica e Revisor do trabalho.
Elias David‐Neto: Coordenador do serviço e Revisor do trabalho.
Mírian Nacagami Sotto: Idealizadora do trabalho; Orientadora da parte histológica e Revisora do trabalho.
Conflito de interessesNenhum.
A Francisco Winter dos Santos, pela análise estatística.
Como citar este artigo: Quaresma MV, Azevedo LS, David‐Neto E, Sotto MN. Histopathological analysis of the skin of renal transplant recipients submitted to three different immunosuppression regimens. An Bras Dermatol. 2025;100:447–55.
Trabalho realizado no Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.