Onicomicose causada por fungos não dermatófitos, como Fusarium spp., é mais prevalente do que se pensava anteriormente, especialmente em climas mais quentes.1 Além disso, a onicomicose tem sido atualmente atribuída a fungos que se organizam em forma de biofilme.2 O biofilme é uma comunidade microbiana complexa, altamente aderida à unha e cercada por matriz que fornece proteção e resistência antifúngica.2,3
O grupo de pesquisa dos autores tem estudado o gênero Fusarium spp. como agente de onicomicose em hospedeiros imunocompetentes. Foi relatada sua alta prevalência na região estudada, e foram estabelecidos critérios clínicos e laboratoriais para esse gênero como agente causal de onicomicose, determinando o perfil de suscetibilidade aos antifúngicos sistêmicos mais comumente usados no Brasil.4 Posteriormente, os autores provaram que Fusarium spp. usa a queratina ungueal como fonte única de nutrientes,5 e foram iniciados estudos sobre a etiopatogenia da onicomicose causada por Fusarium com base em modelo ex vivo usando fragmentos de unha humana estéril.3
Mais recentemente, foi relatado pelos autores, pela primeira vez, que Fusarium oxysporum é capaz de formar biofilme na unha humana como única fonte nutricional.6,7 Também foi descrita molécula orgânica volátil 2‐etil‐1‐hexanol (2EH) como componente de quorum sensing capaz de modular tal biofilme.8 Essas descobertas foram relevantes para confirmar a etiopatogenia da onicomicose por Fusarium. Entretanto, não revelaram as características próprias do biofilme formado sob suporte nutricional. Assim, o presente estudo teve como objetivo caracterizar a formação de biofilme in vitro de F. oxysporum, avaliando sua capacidade natural, durante sete dias, com disponibilidade controlada de nutrientes.
Este estudo foi conduzido com F. oxysporum CMRP2925 isolado de um caso de onicomicose descrito anteriormente.4 O isolado foi reativado para confirmar sua pureza e identificação, antes dos ensaios, e foi cultivado em meio Sabouraud Dextrose Agar (SDA; DifcoTM, MI, EUA) por sete dias a 25°C. Os biofilmes foram preparados de acordo com Galletti et al.,9 com algumas modificações. Suspensão contendo 1 × 107 conídios mL−1 foi preparada em meio RPMI 1640 (Gibco, NY, EUA), com L‐glutamina, bicarbonato de sódio, ácido 3‐(N‐morfolino)propanossulfônico 0,165M (pH 7,2) e glicose a 2%. Essa suspensão foi colocada em placas de microtitulação de fundo plano de 96 poços e incubada a 35°C em agitador a 110 rev min−1, por sete dias. A cada 24 horas, o meio de cultura era renovado removendo 100μL do líquido antigo e adicionando o mesmo volume de RPMI fresco. Durante os sete dias, os biofilmes foram avaliados sob diferentes aspectos, como descrito anteriormente.6,9 Resumidamente, a viabilidade celular foi avaliada pela contagem de unidades formadoras de colônias (UFC), quantificação da biomassa total por violeta cristal, atividade metabólica pelo ensaio de redução do sal de tetrazólio, 2,3‐(2‐metoxi‐4‐nitro‐5‐sulfofenil)‐5‐([fenilamino]carbonil)‐2H hidróxido de tetrazólio (XTT), caracterização da matriz extracelular (MEC) e observação da estrutura do biofilme por microscopia eletrônica de varredura (MEV).
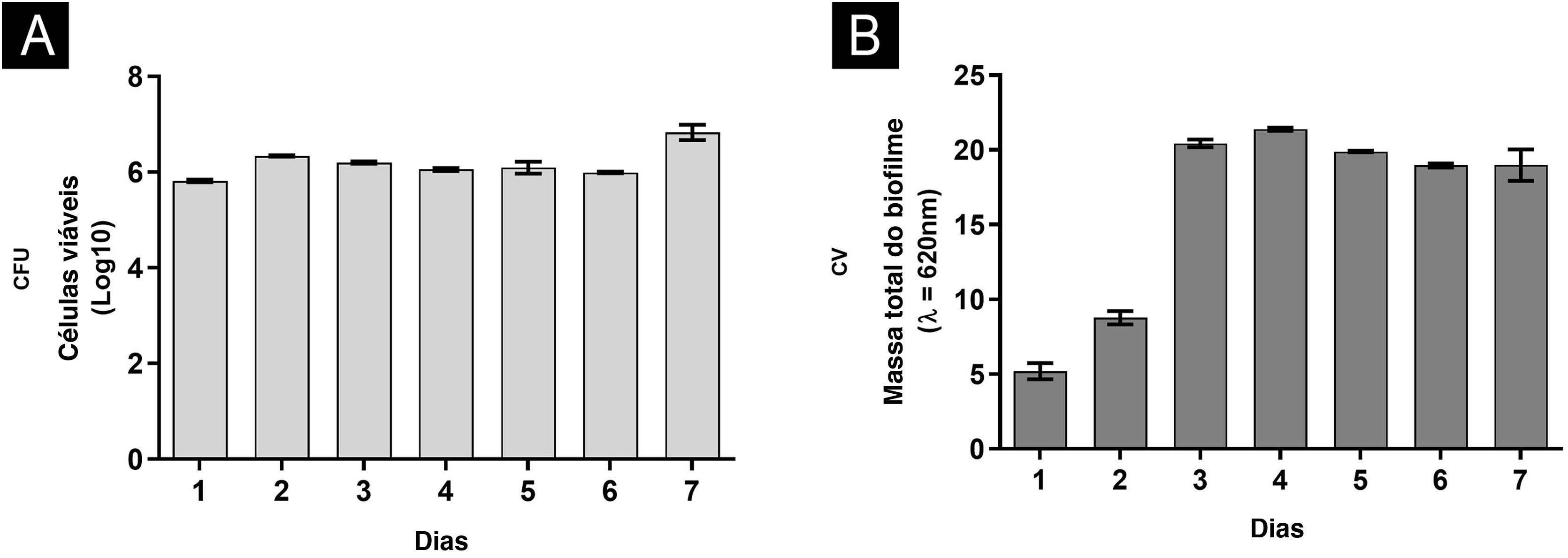
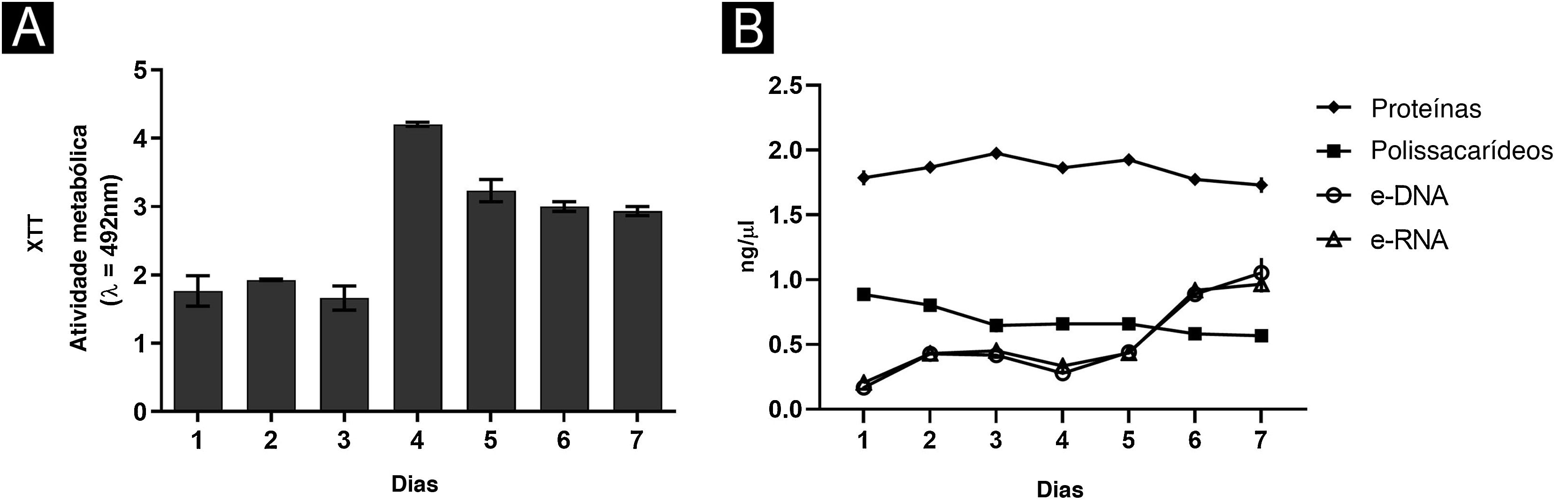
No geral, as características do biofilme foram semelhantes, traçando paralelo entre maior suporte nutricional com RPMI e apenas tecido ungueal.6 Em ambas as situações, foi possível mostrar que o terceiro e quarto dias foram críticos. Em meio rico e pH neutro, o número de UFC permaneceu constante em todos os momentos (fig. 1A), desde o primeiro dia, com aumento da atividade metabólica no terceiro dia, estabilizando‐se a partir desse momento. Perfil semelhante foi encontrado para proteínas e ácidos nucleicos. Curiosamente, os polissacarídeos foram significantemente consumidos até o terceiro dia, continuando a declinar gradualmente até o sétimo dia. Por outro lado, utilizando tecido ungueal como fonte nutricional, observou‐se aumento de UFC até o terceiro dia, alta atividade metabólica apenas no quarto dia, enquanto o aumento de proteínas e carboidratos ocorreu tardiamente, corroborando os resultados dos ácidos nucleicos.6 Essas diferenças podem ser atribuídas à disponibilidade de nutrientes, com renovação diária do meio RPMI (alimento à vontade), e ao fato de que no tecido ungueal (alimento restrito), o próprio fungo necessitou de período de adaptação.
Caracterização do biofilme produzido por Fusarium oxysporum em placas de poliestireno de fundo plano de um a sete dias, em meio RPMI. (A) Número de células viáveis pela contagem de unidades formadoras de colônias (UFC). (B) Massa total do biofilme pela coloração cristal violeta (CV).
Além disso, foi observado aumento progressivo na quantidade de biomassa (fig. 1B) entre o primeiro e o terceiro dias, seguido de estabilidade, o que parece estar associado ao consumo de polissacarídeos (fig. 2), componente fundamental durante o desenvolvimento e manutenção do biofilme. Levando‐se em consideração que as UFC permaneceram estáveis, esse aumento foi atribuído à grande produção de MEC, em ambiente rico. O aumento da atividade metabólica (fig. 2) reflete‐se na síntese de proteínas e ácidos nucleicos, principalmente eRNA. A produção de proteínas parece ser crucial no processo de formação do biofilme e suporte de todo o sistema.6,10 Essa ideia é reforçada pelos altos níveis de XTT e eDNA, a partir do quarto dia, uma vez que esse ácido nucleico é necessário em atividades que demandam energia celular, como a construção de um biofilme maduro.10 A estrutura do biofilme começou pela formação de monocamada celular e, em sete dias, foi observada estrutura tridimensional altamente complexa (figs. 3A e B).
Ilustração de microscopia eletrônica de varredura (MEV) da estrutura do biofilme de Fusarium oxysporum de quatro dias. (A) Destalhe da organização estrutural do biofilme, o entrelaçamento e a compactação das hifas (500×). (B) Maior aumento, mostrando a matriz extracelular produzida (2.000×).
Assim, é lógico supor que a capacidade do F. oxysporum de produzir biofilme seja intrínseca. O suporte nutricional parece apenas facilitar as primeiras horas de sua formação, além de favorecer a produção de maior quantidade de componentes bioquímicos associados à maturação e estabilidade do biofilme. Portanto, a presente experiência chama a atenção para as habilidades naturais desse fungo, antes restritas ao interesse ambiental, agrícola e animal. Provavelmente, a seleção natural induzida por pesticidas facilitou sua adaptação aos tecidos humanos. Os autores conseguiram mostrar que seu potencial de virulência (aqui a eficiência na produção de biofilme) é mantido independentemente da adição de suporte nutricional. Esse comportamento, portanto, permite considerar o gênero Fusarium spp. patógeno primário de interesse em Dermatologia.
Suporte financeiroEste trabalho recebeu suporte financeiro parcial da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior ‐ Brasil (CAPES) (Código Financeiro 001, por meio de bolsa concedida a ILEB); Conselho Nacional de Desenvolvimento Científico e Tecnológico ‐ Brasil (Processo número 3128262023‐0 concedido a TIES) e INCT‐CERBC, 2022, Processo número 406645/2022‐1.
Contribuição dos autoresTerezinha Inez Estivalet Svidzinski: Concepção e planejamento do estudo; planejamento e revisão dos experimentos.
Isabella Letícia Esteves Barros: Concepção e planejamento do estudo e planejamento dos experimentos; realização dos experimentos e análise dos dados; elaboração e redação do manuscrito.
Flávia Franco Veiga: Realização dos experimentos e análise dos dados.
Conflito de interessesNenhum.
Como citar este artigo: Barros ILE, Veiga FF, Estivalet Svidzinski TI. In vitro characterization of biofilm produced by Fusarium oxysporum, an onychomycosis agent. An Bras Dermatol. 2025;100:560–3.
Trabalho realizado na Universidade Estadual de Maringá, Maringá, PR, Brasil.