Os inibidores do fator de necrose tumoral alfa (TNF‐α) têm eficácia comprovada no tratamento de várias condições inflamatórias imunomediadas. Cinco inibidores do TNF‐α estão disponíveis atualmente: infliximabe, adalimumabe, etanercepte, certolizumabe pegol e golimumabe. Em geral, os inibidores do TNF‐α demonstram perfis de tolerabilidade favoráveis, mas estão associados a reações adversas específicas, principalmente manifestações cutâneas,1,2 que incluem respostas relacionadas à injeção/infusão, infecções de pele, neoplasias e manifestações imunomediadas.2 Este relato descreve um caso raro de líquen plano pigmentoso possivelmente desencadeado pela administração de golimumabe.
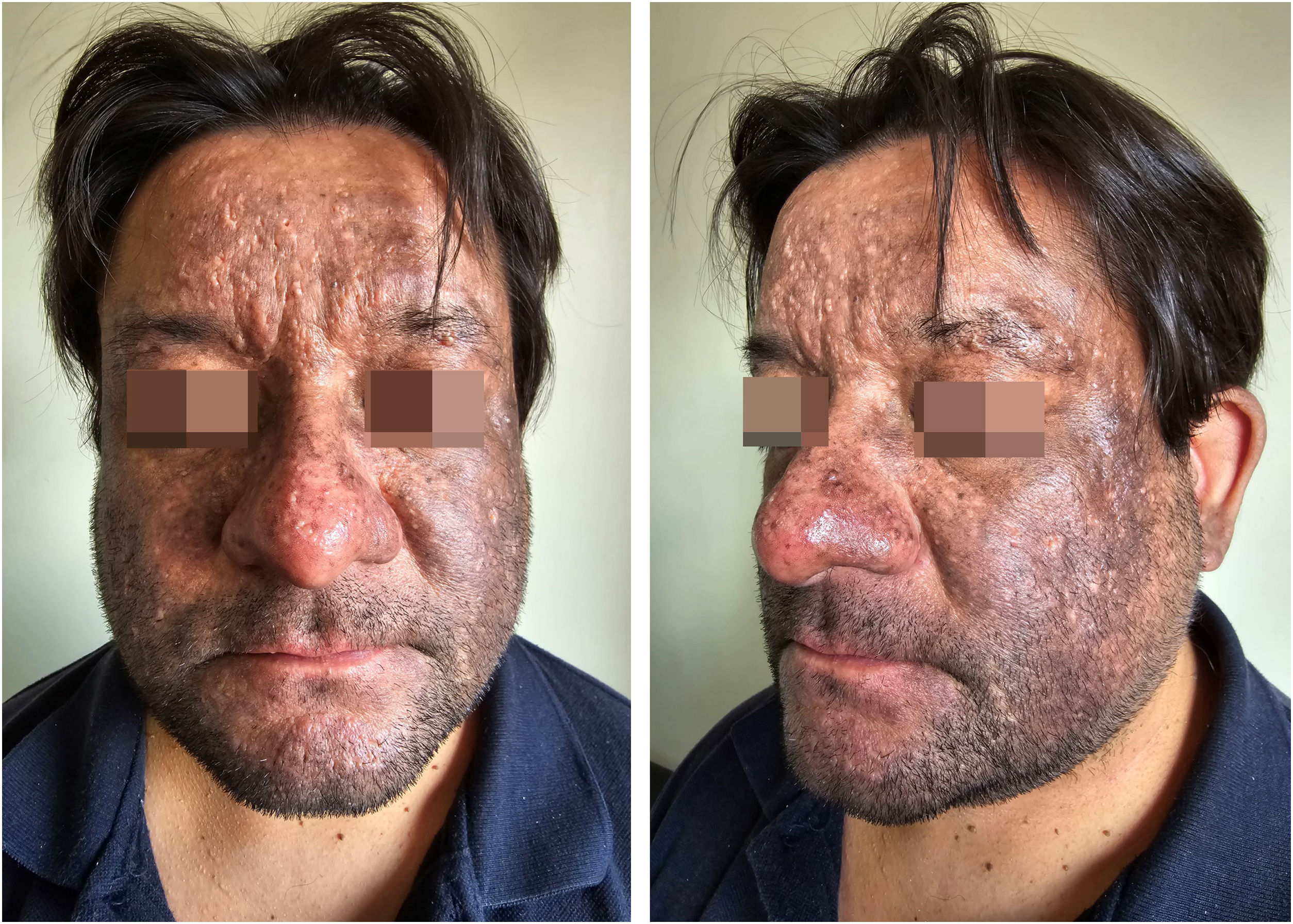
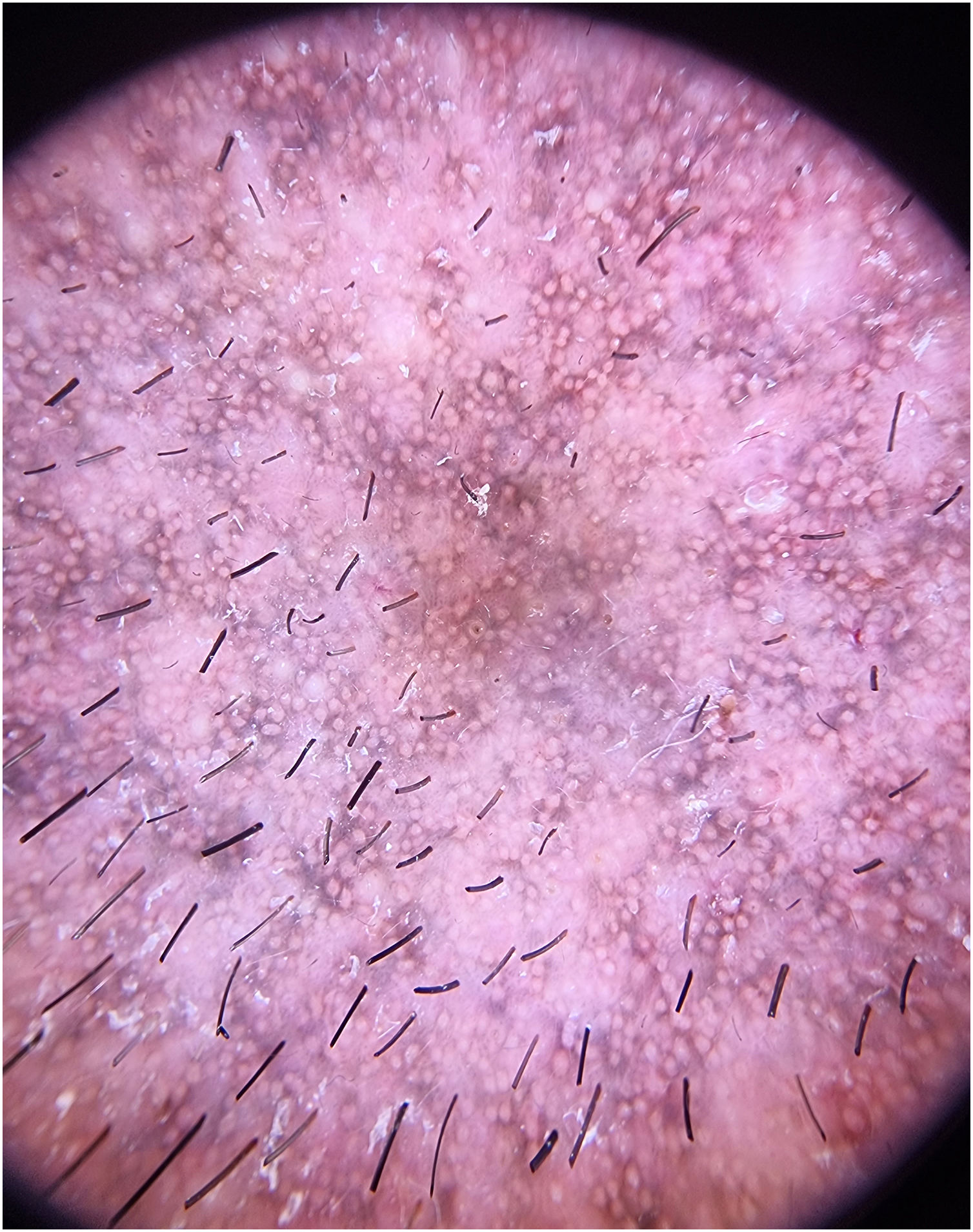
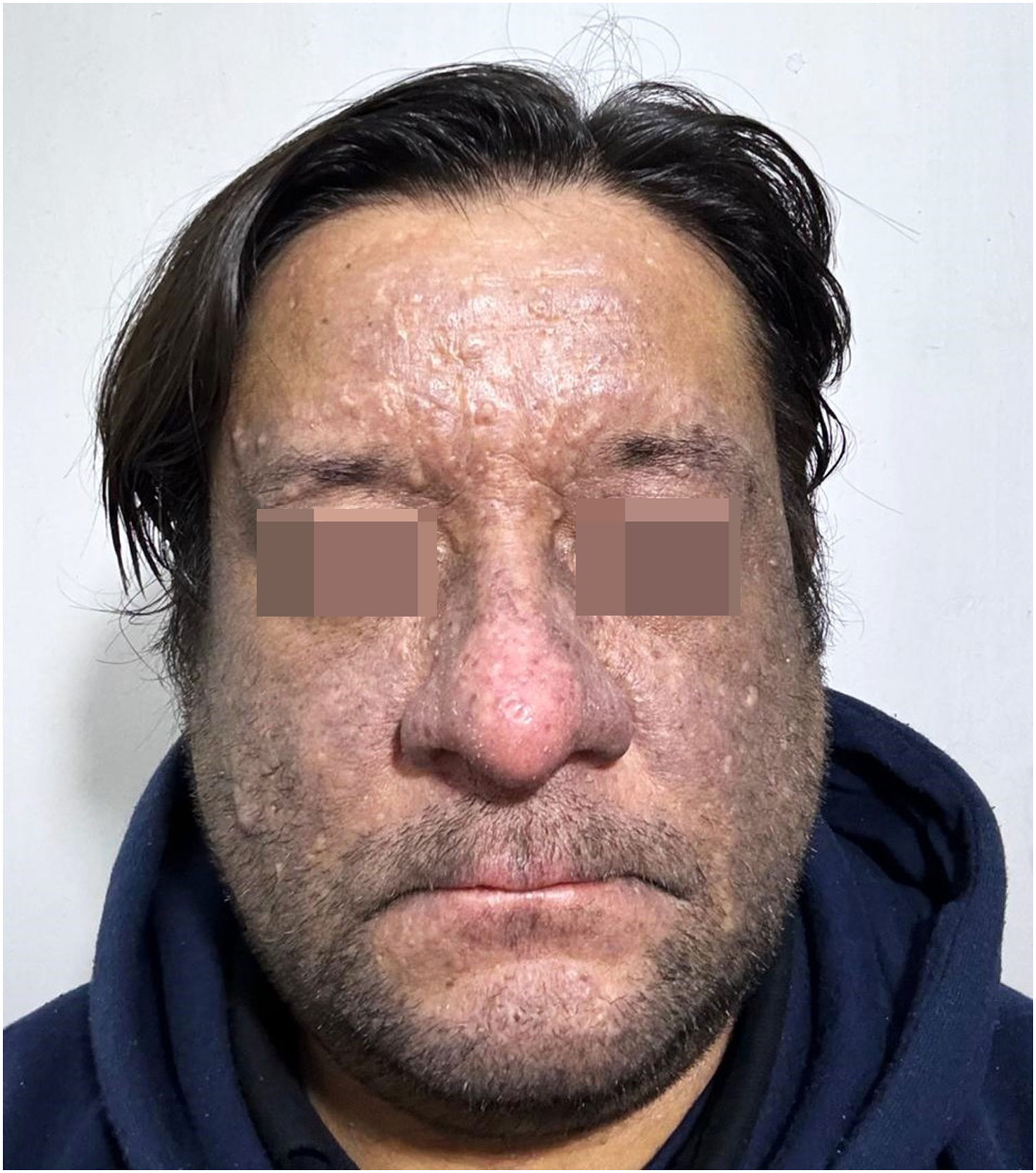
Paciente masculino, de 43 anos, em tratamento com golimumabe (100mg mensais) por um ano em decorrência de histórico de colite ulcerativa; apresentou hiperpigmentação facial progressiva evoluindo ao longo de seis meses. O paciente, com fototipo Fitzpatrick IV, trabalhava em escritório e tinha exposição mínima ao sol. Ele negou qualquer história prévia de hiperpigmentação facial ou mucosa e confirmou não ter utilizado tratamentos tópicos ou produtos cosméticos diários. No exame físico, foi observada hiperpigmentação difusa na face, de coloração marrom, afetando as pálpebras, mas poupando a ponta nasal, pruriginosa, sem descamação ou erosões (fig. 1). O paciente exibia membranas mucosas e anexos intactos. A avaliação dermatoscópica revelou hiperpigmentação marrom‐acinzentada difusa com padrão liquenoide circundando as aberturas foliculares e estruturas isoladas brancas brilhantes em forma de rosetas (fig. 2).
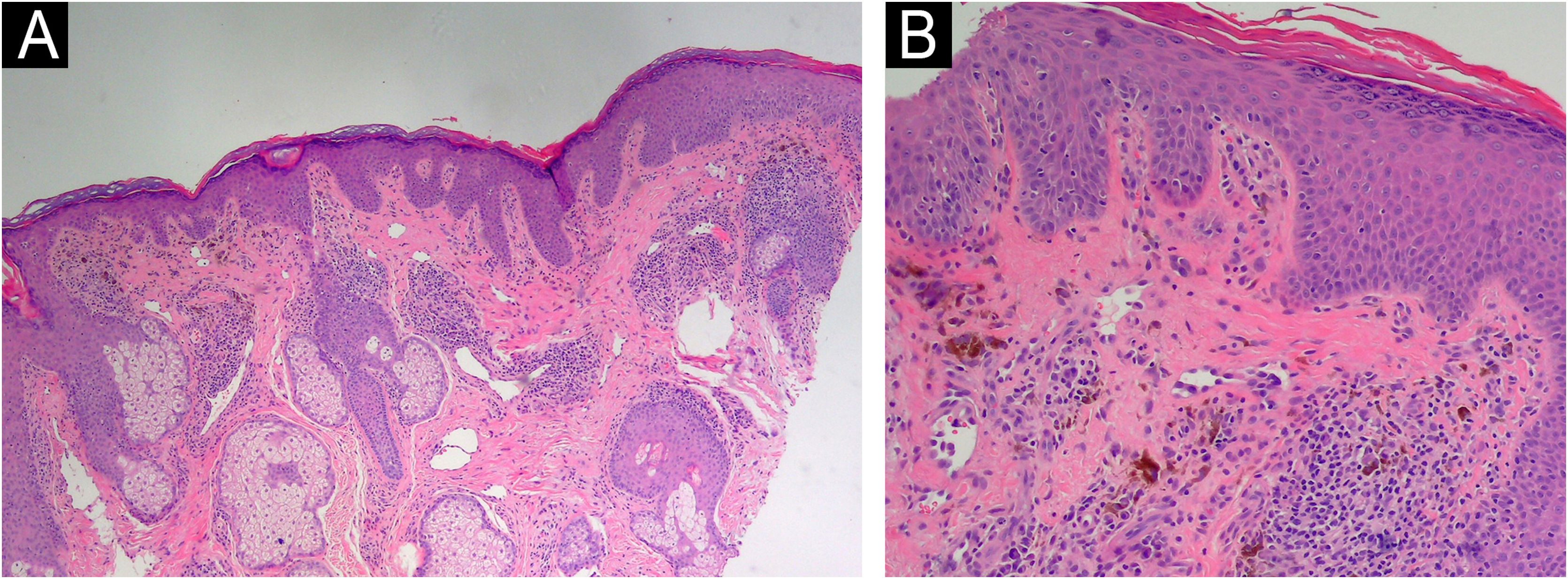
Considerando o contexto clínico e a extensão progressiva das lesões, foi realizado estudo histopatológico que revelou dermatite linfoplasmocitária superficial e perianexial, com padrão liquenoide focal na interface epiderme‐derme e melanose dérmica, consistente com dermatite liquenoide pigmentada (fig. 3).
Histopatologia da pele exibindo características consistentes com dermatite liquenoide pigmentada. (A) Epiderme hiperceratótica com acantose irregular, e com infiltrado linfoplasmocitário perivascular e perifolicular na derme, acompanhado de numerosos melanófagos (Hematoxilina & eosina, 100×). (B) Corpúsculos de Civatte também estão presentes (Hematoxilina & eosina, 200×).
Investigações posteriores não revelaram outros fatores desencadeantes conhecidos para líquen plano pigmentoso, como infecção pelo vírus da hepatite B ou C, utilização de óleo de mostarda, hena, níquel ou tintura de cabelo. Um teste de contato padrão europeu foi realizado, e demonstrou resultados negativos. Foi iniciada terapia imunomoduladora tópica e, suspeitando‐se de reação adversa cutânea secundária ao uso de golimumabe, foi solicitada reavaliação pela Gastroenterologia. O golimumabe foi suspenso e substituído por adalimumabe; essa decisão foi influenciada pelo fato de que, no sistema de saúde pública ao qual o paciente pertence, apenas os inibidores de TNF‐α (golimumabe, adalimumabe, infliximabe) são autorizados para o tratamento de colite ulcerativa refratária ou grave. Atualmente, o paciente está recebendo adalimumabe há quatro meses. As lesões mostraram ligeira redução (fig. 4); entretanto, o prurido diminuiu significantemente, apesar de o paciente ter descontinuado a terapia imunomoduladora tópica sem orientação médica.
A maioria dos casos documentados envolvendo erupções cutâneas imunomediadas associadas a inibidores de TNF‐α comumente representa o início de psoríase ou reações medicamentosas psoriasiformes.1 Entretanto, embora raros, há um número crescente de relatos associando inibidores de TNF‐α e erupções liquenoides.3 Entre esses casos relatados, as ocorrências foram mais frequentes com infliximabe, seguidas por etanercepte, adalimumabe e certolizumabe, em ordem decrescente.4,5 Nenhum caso relatado anteriormente de erupção liquenoide atribuída ao uso de golimumabe foi encontrado após investigação na literatura em inglês ou espanhol.
A fisiopatologia da erupção liquenoide induzida por anti‐TNF‐α permanece obscura. Entretanto, alguns autores propõem que a inibição do TNF‐α em genótipos específicos pode levar à regulação positiva de citocinas oponentes, como o interferon‐α. Essa regulação positiva pode ativar células T e células dendríticas, desencadeando resposta inflamatória que pode induzir o líquen plano.6
Relatar efeitos adversos raros desses medicamentos, cada vez mais utilizados na prática clínica, é crucial para estabelecer registros de farmacovigilância. Esses registros ajudam a entender as implicações de longo prazo do tratamento com inibidores do TNF‐α, que são cada vez mais usados atualmente além do prazo de ensaios clínicos randomizados.
Suporte financeiroNenhum.
Contribuição dos autoresDaniela Alfaro‐Sepúlveda: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Claudio Escanilla: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Fernando Valenzuela: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Dominga Peirano: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; elaboração e redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura e aprovação da versão final do manuscrito.
Conflito de interessesNenhum.