O pênfigo é doença bolhosa autoimune em que os autoanticorpos têm como alvo os antígenos desmogleína (Dsg) nos queratinócitos, desencadeando a via p38 MAPK, internalização de Dsg, dissolução desmossômica e apoptose dos queratinócitos, essencial para a formação de bolhas. Pesquisas recentes indicam que a piroptose dos queratinócitos pode exacerbar a acantólise e retardar a cicatrização de feridas. Os tratamentos atuais, incluindo corticosteroides e imunossupressores, são eficazes, mas têm efeitos colaterais significantes, como demora na cicatrização das feridas e aumento do risco de infecção. Entender esses processos inflamatórios é crucial para o desenvolvimento de tratamentos eficazes para o pênfigo.
MétodosRealizou‐se revisão abrangente da literatura, analisando achados recentes sobre a regulação positiva de proteínas relacionadas à piroptose no pênfigo.
ResultadosOs achados do presente estudo destacam regulação positiva significante de proteínas relacionadas à piroptose, que desempenham papel crucial na resposta inflamatória e na formação das bolhas características do pênfigo. Proteínas‐chave como as citocinas IL‐1β, IL‐18, High Mobility Group Box‐1 (HMGB1) e Parkin, juntamente com receptores semelhantes a NOD e receptores P2X7, foram identificadas como essenciais para facilitar a piroptose. O estudo também discute potenciais abordagens terapêuticas visando essas proteínas para modular o desenvolvimento da doença de forma eficaz.
Limitações do estudoEste estudo teve como objetivo investigar o papel da piroptose na patogênese do pênfigo, concentrando‐se em seu potencial como novo alvo terapêutico.
ConclusõesA piroptose contribui significantemente para a patogênese do pênfigo e representa alvo promissor para terapia. Visar moléculas específicas envolvidas na via da piroptose oferece potencial para desenvolver tratamentos mais precisos e menos tóxicos, possibilitando a mudança das terapias tradicionais para estratégias terapêuticas direcionadas.
A piroptose é um tipo de morte celular programada que ocorre em ambiente altamente inflamatório, caracterizada por lise celular, edema, criação de poros na membrana celular e liberação de conteúdo celular e mediadores pró‐inflamatórios, todos os quais levam à morte celular. A piroptose difere fundamentalmente da apoptose e necrose na forma e no mecanismo celular, e está envolvida em uma variedade de processos biológicos, incluindo defesa imunológica, resposta inflamatória e progressão da doença. O papel da acantólise no pênfigo atraiu recentemente muito interesse de pesquisa.
Pênfigo é doença bolhosa autoimune da pele caracterizada pela falta de fixação entre os queratinócitos (QCs) da epiderme ou da mucosa, resultando na formação de bolhas. Autoanticorpos patogênicos contra o antígeno desmogleína (Dsg) ativam diversas vias de sinalização, que contribuem para o desenvolvimento da doença. A patogênese do pênfigo é atualmente baseada em quatro teorias: a hipótese de compensação da Dsg,1 a hipótese de impedimento estérico,2 a teoria multipatogênica/teoria de múltiplos hits; e a teoria da lise apoptótica.3 Os autoanticorpos têm como alvo específico moléculas de adesão entre QCs epidérmicos e mucosos, como Dsg1 e Dsg3, causando disjunção celular e formação de bolhas. Além dos efeitos mediados por anticorpos, o pênfigo causa alterações na transdução de sinal intracelular, como resposta ao estresse do retículo endoplasmático,4 recombinação citoesquelética,5 liberação de mediadores inflamatórios,6 e apoptose,7 e piroptose.8
É essencial entender as implicações clínicas da piroptose no pênfigo. Clinicamente, os pacientes com pênfigo apresentam lesões erosivas com maior dificuldade de cicatrização em comparação à pele normal, e essas erosões são propensas a infecções bacterianas ou virais. Investigar se a piroptose desempenha papel significante nessas manifestações clínicas é crucial. A piroptose, por meio da liberação de mediadores pró‐inflamatórios, pode exacerbar o ambiente inflamatório, levando ao retardo na cicatrização e ao aumento da suscetibilidade a infecções em pacientes com pênfigo. Entender a contribuição da piroptose para esses aspectos clínicos pode ajudar no desenvolvimento de terapias direcionadas que facilitem a cicatrização de feridas e reduzam as taxas de infecção, melhorando assim o tratamento geral do pênfigo. Este estudo resume os desenvolvimentos científicos sobre a piroptose no pênfigo.
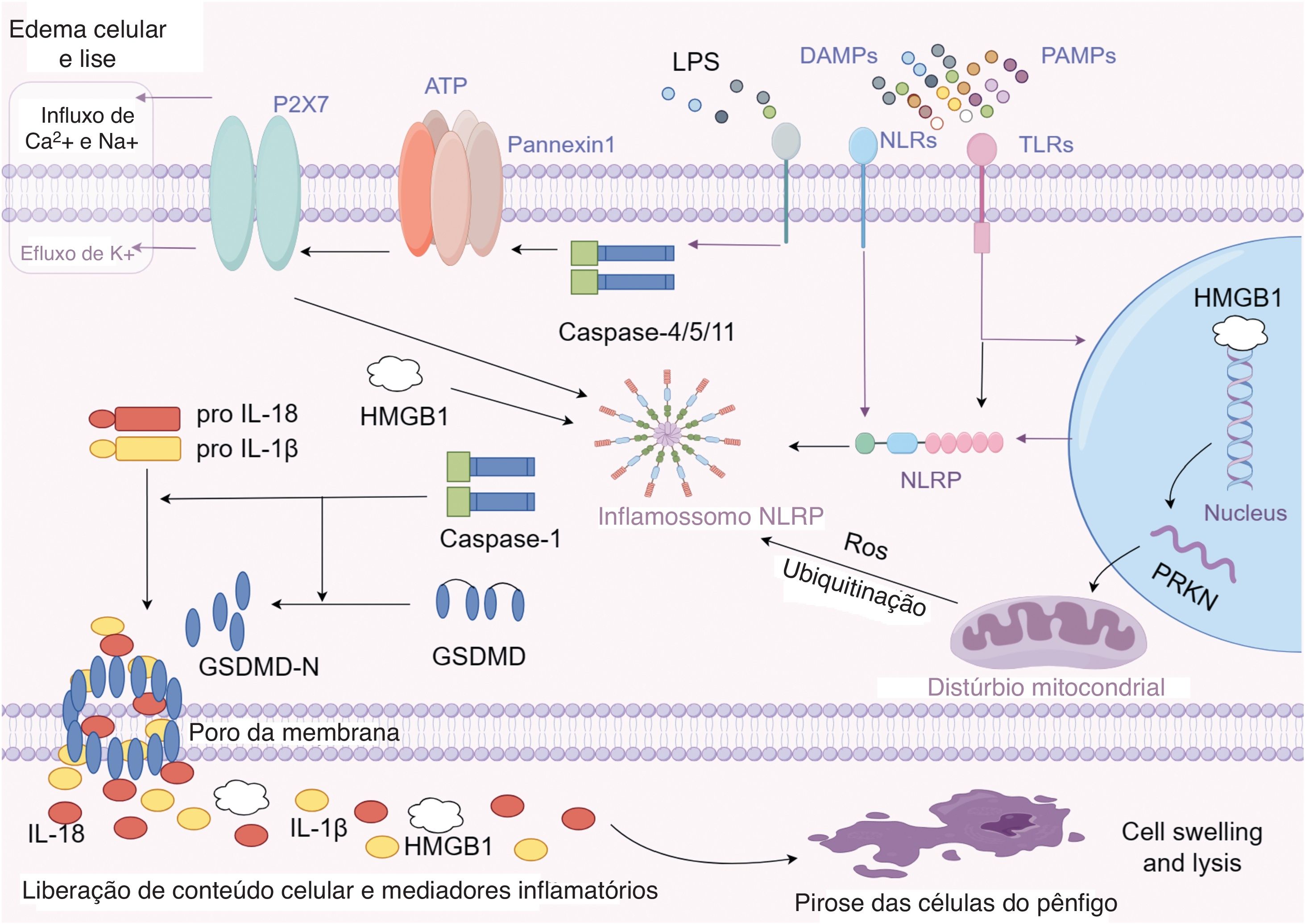
Modo de ativação da piroptoseA piroptose é causada pela ativação de inflamossomos por meio de duas vias principais: clássica e não clássica.9,10 Os receptores Toll‐Like (TLR) ou Nod‐Like (NLR) na superfície celular reconhecem padrões moleculares patogênicos ou relacionados a lesões, o que ativa a cascata piroptótica na via clássica. Como resultado, é gerado o inflamossomo que é um complexo proteico que ativa o precursor pró‐Caspase‐1 quando reconhece a presença de um patógeno ou dano celular. A ativação da Caspase‐1 causa a clivagem da proteína Gasdermin‐D (GSDMD), resultando na formação de GSDMD‐N. GSDMD‐N então causa poros na membrana celular, resultando em alterações na pressão osmótica, edema celular e, por fim, ruptura da membrana.11 A Caspase‐1 promove a produção e liberação de citocinas inflamatórias IL‐1β e IL‐18, desencadeando a resposta inflamatória.
Componentes bacterianos, como lipopolissacarídeos (LPS), podem ativar Caspase‐4/5/11 por meio de um método não tradicional.12 Caspases 4, 5 e 11 ativam o canal Pannexin‐1, que propicia que a célula libere ATP no espaço extracelular. Isso ativa o canal P2X7 na membrana celular, fazendo com que se desenvolvam poros na membrana e o processo de piroptose comece. A Pannexin‐1 ativada estimula o inflamossomo NLRP3 ao liberar íons de potássio, resultando na criação e liberação de IL‐1β e IL‐18. Esse processo completa a liberação de fatores inflamatórios, acelerando o avanço da inflamação.13
Expressão de proteína relacionada à piroptose no pênfigoProteína secretora: citocinaAs moléculas pró‐inflamatórias da família IL‐1, IL‐1β e IL‐18 desempenham papel crucial na piroptose (mostrado na parte esquerda da fig. 1). Pesquisas indicam que pacientes com pênfigo ativo não tratado têm altos níveis de IL‐1β no soro e tecidos,14–16 mas pacientes em remissão têm níveis baixos. A expressão aumentada de IL‐1β pode contribuir diretamente para o processo de inflamação e lesões no pênfigo. Os níveis de IL‐1β lacrimal em pacientes com pênfigo estavam substancialmente elevados em comparação com aqueles de controles saudáveis, como determinado por Feng J et al. em lágrimas de pacientes com pênfigo.17 Huang et al. utilizaram tecnologia de microarray, enriquecimento GO e análise da via KEGG para mostrar que genes relacionados à infiltração de monócitos eram altamente expressos em lesões de pele de pacientes com pênfigo, com densa infiltração de neutrófilos, alta expressão da via de sinalização IL‐17 em lesões de pele e monócitos de sangue periférico, e os monócitos de sangue periférico responderam acentuadamente à IL‐1.18 A IL‐1 é indutor potente de IL‐17, que por sua vez recruta células da medula óssea que secretam IL‐1,19 o que implica que pode haver um ciclo de retroalimentação positivo no pênfigo, com a IL‐1 amplificando a inflamação do pênfigo por meio de vias de sinalização relacionadas à IL‐17. Hebert et al. descobriram expressão significantemente elevada de genes codificadores de citocinas pró‐inflamatórias IL‐1β, IL‐23p19 e IL‐12p35 em células B autorreativas de pacientes com pênfigo usando reação em cadeia de polimerase quantitativa.20 Em um estudo de Narbutt et al., foi observado que citocinas pró‐inflamatórias (IL‐1β, TNF‐α e IL‐6) eram mais expressas em células incubadas com anticorpos de pênfigo de pacientes em atividade, em remissão e saudáveis.21 Feliciani et al. criaram um modelo de knockout do gene IL‐1 em camundongo e injetaram anticorpos de pênfigo. Eles descobriram que animais com produção reduzida de IL‐1β tiveram menor incidência de pênfigo do que o grupo controle. Isso sugere que a IL‐1β promove a ocorrência ou o desenvolvimento de pênfigo. Animais knockout para IL‐1 exibiram acantólise, indicando que a IL‐1 pode não estar envolvida na fase inicial do pênfigo, mas sim na expansão da inflamação e produção de lesão.22 Em um estudo de Kailash C et al.,23 os níveis séricos do antagonista do receptor de IL‐1 (Ra) aumentaram em pacientes com pênfigo em remissão. Isso sugere que IL‐1 Ra pode inibir o efeito inflamatório de IL‐1β e aliviar a doença. Os inibidores de IL‐1 também podem ser eficazes no tratamento do pênfigo.
DAMPs e PAMPs são “padrões moleculares associados a lesões” e “padrões moleculares associados a patógenos”, respectivamente, que são identificados por receptores de reconhecimento de padrões em células, como TLRs (Toll‐Like Receptors) e NLRs (NOD‐Like Receptors), para desencadear e disseminar uma resposta imune. Inflamossomos são complexos multiproteicos que incluem proteínas NLRP e são essenciais para a imunidade inata e a ativação de respostas inflamatórias. Enzimas conhecidas como caspases são proteases que são cruciais em respostas inflamatórias e morte celular programada. Caspase‐1 e caspase‐4/5/11 são mostradas na imagem; elas ativam inflamossomos e clivam citocinas pró‐inflamatórias. GSDMD (gasdermina‐D): Após a clivagem pela caspase‐1, GSDMD‐N forma poros na membrana celular, levando à liberação do conteúdo celular, incluindo IL‐1β, IL‐18 e HMGB1. Após estimulação por ATP extracelular, o receptor P2X7 abre e permite o fluxo dos íons, alterando as concentrações intracelulares. Essa mudança iônica estimula a abertura dos canais Pannexin1, facilitando a liberação de ATP e outros mediadores inflamatórios. Essa liberação de ATP e fluxo de íons através dos canais P2X7 e Pannexin1 é etapa fundamental na ativação do inflamossomo, levando à piroptose.
High Mobility Group Box‐1 (HMGB1) é proteína de ligação à cromatina não histona encontrada nos núcleos de todas as células de mamíferos e desempenha múltiplas funções biológicas, incluindo regular a estrutura e a função do DNA dentro da célula e atuar como molécula de sinalização pró‐inflamatória fora da célula. Na célula, a HMGB1 participa da replicação, reparo, transcrição e remodelação da cromatina do DNA. Quando as células são danificadas ou estão inflamadas, a HMGB1 pode ser liberada fora da célula, atuando como molécula de sinalização extracelular envolvida na inflamação, reparo de tecidos e regulação imunológica. A liberação de HMGB1 é considerada marcador importante de dano e morte celular, e tem a capacidade de ativar o sistema imunológico, induzir e aumentar a resposta inflamatória. A piroptose causa a liberação de conteúdo celular, incluindo HMGB1, que ativa o inflamossomo, levando à produção e liberação de fatores inflamatórios como IL‐1β e IL‐18. Por outro lado, a HMGB1 pode ativar células imunes e direcionar o desenvolvimento de resposta imune ligando‐se a uma variedade de receptores, incluindo o receptor RAGE (receptor para produtos finais de glicação avançada) e TLRs (mostrado na parte direita da fig. 1). Esse efeito promove a formação e progressão da inflamação durante a piroptose.24,25 Li et al. investigaram os níveis séricos de HMGB1, bem como a expressão tecidual de HMGB1 e seu receptor RAGE em pacientes com pênfigo. Eles descobriram que os níveis séricos de HMGB1 eram significantemente maiores em pacientes com pênfigo do que em pacientes com penfigoide bolhoso e populações controle saudáveis, e os níveis séricos de HMGB1 eram significantemente maiores em pacientes com pênfigo antes do tratamento do que após o tratamento. HMGB1 é abundante no citoplasma de células epidérmicas de pacientes com pênfigo, enquanto a expressão de HMGB1 na pele saudável e no penfigoide bolhoso é quase inteiramente confinada ao núcleo.26 A alteração no nível de HMGB1 está intimamente relacionada à atividade da doença e à resposta ao tratamento, o que implica que HMGB1 pode ser parte importante do mecanismo patológico do pênfigo, e pode ser tanto biomarcador de atividade da doença quanto indicador do resultado do tratamento.
Proteínas funcionais relacionadas à mitocôndria: ParkinParkin, codificada pelo gene PRKN, é expressa tanto no citoplasma quanto no núcleo e desempenha papel na degradação de proteínas e na manutenção da função mitocondrial. Parkin regula a autofagia, o que ajuda a manter a homeostase mitocondrial. Mitocôndrias disfuncionais podem produzir padrões moleculares associados a danos (DAMPs, do inglês damage‐associated molecular patterns) e espécies reativas de oxigênio (EROs), que são conhecidas por ativar o inflamossomo e causar piroptose. Mutações ou disfunções do PRKN predispõem à inflamação e criam ambientes pirogênicos. As proteínas parkin, por outro lado, estão envolvidas na regulação da degradação de proteínas em células através do sistema ubiquitina‐proteassoma (UPS, do inglês ubiquitin‐proteasome system) e da via da autofagia (mostrado na parte direita da fig. 1). A proteína parkin pode ubiquitinar uma variedade de substratos, reconhecendo e promovendo a degradação de proteínas acentuadamente danificadas ou sobreacumuladas, influenciando assim as vias de sinalização inflamatória.27,28 Bumiller‐Bini et al. usaram hibridização de microarray e regressão logística multivariada para estudar sistematicamente as frequências de alelos e genótipos que codificam todas as 12 cascatas de morte de células maduras em 227 pacientes com pênfigo foliáceo e 194 controles. Foi descoberto que o gene da morte celular pirogênica PRKN é fator de proteção para o pênfigo foliáceo.29 Isso sugere que o gene PRKN pode desempenhar papel protetor em pacientes com pênfigo, pois sua função normal promove a saúde mitocondrial, reduz a resposta inflamatória e inibe o processo de morte por combustão. Essa descoberta lança nova luz sobre a patogênese do pênfigo.
Proteínas com funções na resposta e modulação da inflamação: NLROs receptores do tipo domínio de oligomerização de ligação de nucleotídeos (receptores NOD‐like, também conhecidos como NLR) são um grupo de proteínas com mais de 20 subtipos, incluindo NOD1, NOD2, NLRP1, NLRP3 e NLRC4 (também conhecidos como IPAF), que são receptores de reconhecimento de padrões intracelulares (PRRs, do inglês pattern recognition receptors). Esses receptores ativam respostas inflamatórias e vias de morte celular em mecanismos de defesa do hospedeiro, reconhecendo moléculas endógenas, bactérias, vírus e corpos estranhos tóxicos no citoplasma.30,31 Além disso, o NLR pode interagir com outras proteínas de sinalização para formar um inflamossomo, que ativa vias de sinalização inflamatórias a jusante. Os corpos inflamatórios da família de proteínas NLR ativam a caspase, resultando na maturação de substratos da caspase‐1, como IL‐1β e IL‐18, que iniciam respostas imunes e inflamatórias. Shamsabadi et al. usaram a reação em cadeia de polimerase em tempo real para descobrir que os níveis de mRNA de NLRP1 e IPAF em pacientes com pênfigo ativo eram significantemente maiores do que em controles saudáveis.15 A regulação positiva de NLRP1 e IPAF em pacientes com pênfigo pode indicar a ativação excessiva desses agentes inflamatórios (mostrado na parte central da fig. 1). Mediadores inflamatórios como IL‐1β e IL‐18 também podem contribuir para a inflamação e lesões da pele. Esses achados indicam que a família de proteínas NLR, que está relacionada à piroptose, pode desempenhar papel importante na patogênese do pênfigo.
Proteína de canal de membrana: P2XRO receptor de proteína P2X do canal de membrana (P2XR) é uma classe de receptores de canal iônico composta por sete subtipos, P2X1–P2X7, que pertencem ao canal iônico dependente de ATP na superfície celular. O ATP extracelular ativa esses receptores, fazendo com que íons de cálcio (Ca2+) e de sódio (Na+) entrem na célula e íons de potássio (K+) saiam. Os receptores P2X estão mais intimamente relacionados à piroptose. A ativação sustentada do P2X7 causa liberação de ATP extracelular, efluxo de íons K+, ativação do inflamossomo e ativação da caspase‐1, que promove a secreção de IL‐1β e IL‐18. Além disso, a ativação do receptor P2X7 aumenta a permeabilidade da membrana e promove a liberação de conteúdo celular, como fatores pró‐inflamatórios32,33 (mostrado na parte superior da fig. 1). Esses fatores podem causar ou exacerbar a piroptose. Malheiros et al. compararam os perfis de expressão gênica de todo o genoma de células T CD4+ periféricas entre diferentes subgrupos de pacientes com pênfigo foliáceo e indivíduos saudáveis, descobrindo que o gene P2XR era altamente expresso em pacientes com pênfigo não tratado.34 Também é proposto que os receptores ATP e P2X desempenham papéis importantes na inflamação tecidual e na piroptose celular no pênfigo.
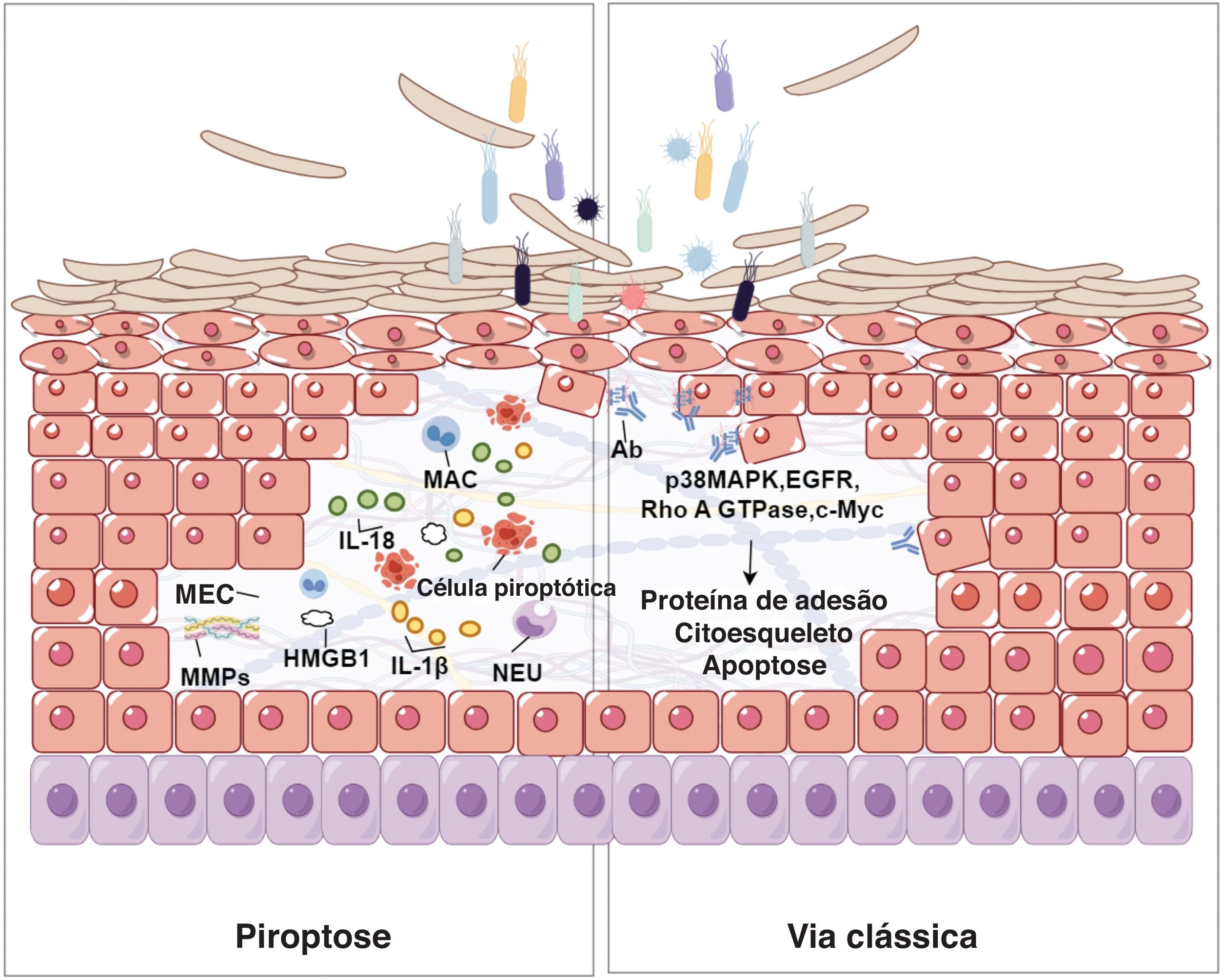
Relação entre piroptose e acantóliseA relação entre piroptose e acantólise pode girar principalmente em torno da resposta inflamatória desencadeada pela piroptose e seu impacto prejudicial na integridade do tecido cutâneo. Piroptose é forma de morte celular programada que envolve ativação do inflamossomo, formação de poros e subsequente lise celular. Está associada a várias condições inflamatórias e autoimunes. Acantólise significa perda de adesão entre os queratinócitos na epiderme, produzindo lesões bolhosas. Durante a piroptose, as proteínas gasdermin formam poros na membrana celular, causando edema e ruptura celular. Esse processo desencadeia a liberação de quantidades substanciais de citocinas pró‐inflamatórias, como IL‐1β e IL‐18, promovendo ambiente inflamatório que pode agravar as lesões da pele. Essas citocinas promovem várias respostas imunológicas, incluindo a migração de leucócitos e a produção de outros mediadores inflamatórios, que podem agravar ainda mais a acantólise35 (fig. 2). A piroptose é comumente ativada em resposta a patógenos intracelulares, resultando em inflamação da pele. Nesse processo, o estresse oxidativo induz disfunção mitocondrial e a geração de EROs, que exacerbam o dano celular e a inflamação. Além disso, o óxido nítrico (ON) liberado durante a piroptose aumenta a produção de metaloproteinases da matriz (MMPs, do inglês matrix metalloproteinases) e citocinas inflamatórias, interrompendo a integridade da matriz extracelular (MEC) e levando a lesões cutâneas.36–38 Em doenças inflamatórias crônicas da pele, como eczema, dermatite seborreica ou psoríase, a exacerbação dos sintomas pode ser atribuída às citocinas pró‐inflamatórias liberadas durante a piroptose.35,39,40 A inflamação persistente compromete a integridade estrutural da pele, tornando‐a mais suscetível a alterações acantolíticas. Níveis elevados de citocinas inflamatórias, incluindo IL‐18 e IL‐1β, foram documentados em várias doenças da pele, sugerindo seu papel potencial na relação da piroptose com a acantólise. Essas fontes fornecem uma compreensão abrangente de como a piroptose contribui para a patogênese da acantólise ao liberar mediadores inflamatórios, causando estresse oxidativo e resultando em lesão tecidual. Essas informações oferecem conhecimentos valiosos sobre potenciais alvos terapêuticos para tratar doenças de pele relacionadas a esses processos.
Relação entre piroptose e acantólise na epiderme. Células piroptóticas, caracterizadas pela formação de poros mediados por gasdermina, liberam citocinas pró‐inflamatórias, como IL‐1β e IL‐18. Essas citocinas atraem neutrófilos (NEU) e macrófagos (MAC), acentuando o ambiente inflamatório. O estresse oxidativo resultante e a produção de metaloproteinases da matriz (MMPs) podem degradar a matriz extracelular (MEC), enfraquecendo a integridade estrutural da epiderme e levando ao destacamento de queratinócitos, um processo conhecido como acantólise. Essa figura ilustra a interação complexa entre morte celular, inflamação e ruptura do tecido na patogênese de lesões bolhosas na pele. A parte direita da figura mostra a via clássica da acantólise no pênfigo. A interação bacteriana desencadeia a produção de anticorpos, ativando moléculas de sinalização (p38 MAPK, EGFR, Rho A GTPase, c‐Myc), que afetam o citoesqueleto e as proteínas de adesão, levando ao destacamento celular e à apoptose.
Explorar o papel da piroptose na patogênese do pênfigo e suas implicações terapêuticas requer análise mais aprofundada da ativação da caspase e como os inibidores da caspase, particularmente aqueles que têm como alvo a caspase‐1, podem ajudar a tratar a doença. Classicamente, os autoanticorpos que interrompem a adesão dos queratinócitos causam acantólise e bolhas no pênfigo. Um estudo recente revela que os processos de morte celular, notavelmente a piroptose, contribuem para sua patogênese. A piroptose é desencadeada por membros da família caspase, como caspase‐1, caspase‐4, caspase‐5 e caspase‐11, que reconhecem patógenos intracelulares ou padrões moleculares relacionados a lesões. Vários estudos em animais, em humanos e em células demonstraram que a ativação da caspase é prejudicial no pênfigo experimental, e os inibidores da pancaspase podem bloquear ou diminuir a acantólise e a formação de bolhas no pênfigo in vitro e in vivo, respectivamente.41–45 Wang et al. usaram a coloração com azul de tripano in vivo para avaliar a mortalidade celular e descobriram que YVAD‐CHO, um inibidor da caspase‐1, poderia diminuir a morte de queratinócitos induzida por PV‐IG e a acantólise.46 O efeito dos inibidores da caspase‐1 específicos para piroptose apoia a importância da piroptose na patogênese do pênfigo e destaca o potencial de usar caspases específicas como alvos no tratamento do pênfigo.
Conclusão e perspectivasPênfigo refere‐se a uma classe de doenças cutâneas bolhosas autoimunes nas quais a adesão intercelular é perdida em virtude da geração de anticorpos autoimunes. Pesquisas recentes revelaram que a imunidade inata, incluindo o recrutamento de células imunes inatas, a liberação de mediadores inflamatórios e a ativação do sistema de complemento, também desempenham papel significante no processo patológico do pênfigo. O pênfigo está principalmente ligado à imunidade adaptativa anormal, particularmente autoanticorpos produzidos por células B. Um tipo de morte celular planejada, chamada piroptose, está intimamente ligada à inflamação, resultante do sistema imunológico inato e da ativação do processo inflamatório. No desenvolvimento e progressão do pênfigo, os agentes inflamatórios NLRP, caspase, IL‐1 e IL‐18, PRKN e P2X são considerados implicados. Ainda são necessárias pesquisas aprofundadas para determinar se a piroptose está ligada à infecção da pele no pênfigo e à erosão refratária. Isso inclui a importância da gasdermina D, a principal proteína da piroptose, sendo expressa no pênfigo e o mecanismo pelo qual moléculas relacionadas à piroptose ativam a piroptose por uma via de sinalização específica. Também não está claro se a piroptose amplia a gama inflamatória do pênfigo. In vitro e in vivo, inibidores da pancaspase, molécula relacionada à piroptose, previnem ou diminuem a acantólise e o desenvolvimento de bolhas no pênfigo. Também foi demonstrado que os inibidores da caspase‐1, uma importante enzima da piroptose, são úteis na prevenção do aparecimento de vesículas; no entanto, mais confirmações experimentais são necessárias. Mais pesquisas são necessárias para determinar o potencial dos antagonistas do receptor de IL‐1 no tratamento do pênfigo.
Suporte financeiroNenhum.
Contribuição dos autoresJiazhen Chen: conduziu uma revisão abrangente da literatura, escreveu o rascunho inicial do manuscrito e criou as figuras.
Zezhi He: criou as figuras e forneceu os recursos necessários.
Xiangnong Dai: contribuiu para a revisão crítica e edição do manuscrito.
Sifan Lin: contribuiu para a revisão crítica e edição do manuscrito.
Jiahui Liu: supervisionou a pesquisa e forneceu os recursos necessários.
Xingdong Ye: concebeu a ideia original e projetou a estrutura do estudo.
Conflito de interessesNenhum.
Todas as figuras no manuscrito foram desenhadas com Figdraw. Os autores agradecem a todos que ajudaram a tornar esta iniciativa uma realidade, especialmente ao Guangzhou Science and Technology Bureau (n° 2023A03J0946). Os autores gostariam de agradecer aos editores por seu monitoramento cuidadoso e aos revisores anônimos por suas avaliações completas e críticas úteis ao presente trabalho. Seu conhecimento e ideias atenciosas melhoraram substancialmente a qualidade e a clareza do presente trabalho, pelo que os autores são gratos.
Como citar este artigo: Chen J, He Z, Dai X, Lin S, Liu J, Ye X. New insights into pyroptosis in pemphigus: from cellular structure to therapeutic targeting. An Bras Dermatol. 2025;100:520–6.
Trabalho realizado no Guangzhou Dermatology Hospital, Guangzhou, Guangdong, China.