Psoríase é doença inflamatória da pele associada à síndrome metabólica (SM), doença hepática esteatótica (DHE) e risco cardiovascular. Entretanto, o efeito da terapia anti‐inflamatória no risco cardiovascular é incerto.
ObjetivosDeterminar a relação entre terapia anti‐inflamatória e aterosclerose subclínica em indivíduos com psoríase, usando a medida padrão‐ouro da velocidade de onda de pulso carotídeo‐femoral (VOP‐cf). Além disso, avaliar a associação entre VOP‐cf, esteatose e fibrose avançada (FA) usando elastografia transitória (ET) por FibroScan®.
MétodosEstudo transversal incluindo pacientes com psoríase submetidos à VOP‐cf e ET. Esteatose foi definida como parâmetro de atenuação controlada ≥ 275dB/m, FA como medida de rigidez hepática ≥ 10kPa, aumento da rigidez aórtica (RA) como VOP‐cf ≥ 10 m/s. A dose cumulativa significante de metotrexato foi ≥ 1.500mg (MTX1500). A análise de regressão logística avaliou as variáveis independentes associadas ao aumento da RA.
ResultadosOitenta pacientes foram incluídos (média de idade 56,2±11,5 anos, 57,5% mulheres, IMC 28,6±5,3kg/m2). As prevalências de SM, diabetes mellitus, dislipidemia, hipertensão arterial sistêmica, esteatose e FA foram 57,5%, 40,0%, 67,5%, 70,0%, 50,0% e 16,3%, respectivamente. MTX1500 estava presente em 45%, tratamento imunobiológico em 33,8% e VOP‐cf ≥ 10 m/s em 21,2%. Na análise de regressão logística, a idade foi independentemente relacionada à VOP‐cf ≥ 10 m/s (OR=1,21; IC95% 1,06–1,38; p=0,003) e o MTX1500 foi fator cardiovascular protetor (OR=0,18; IC95% 0,038–0,87; p=0,033). Nenhuma associação foi observada entre esteatose, FA ou terapia imunobiológica e VOP‐cf ≥ 10 m/s.
Limitações do estudoTamanho amostral.
ConclusãoEm pacientes com psoríase, o aumento da RA foi associado à idade, mas não à esteatose ou FA. Efeito protetor cardiovascular do MTX foi observado na população com psoríase com alta prevalência de SM e seus componentes.
A psoríase é doença inflamatória crônica imunomediada da pele, cuja prevalência em países ocidentais é de cerca de 2%–4%,1 e pode estar associada à síndrome metabólica (SM).2 Pacientes com psoríase têm risco duas vezes maior de doença hepática esteatótica (DHE) em comparação com controles não psoriásicos,3 e aumento do risco de fibrose avançada (FA), cirrose e doença cardiovascular.4 A terapia com metotrexato (MTX) e imunobiológicos (IB) é estratégia anti‐inflamatória eficaz na psoríase. Nas últimas décadas, a fibrose hepática na psoríase tem sido associada mais frequentemente à SM e à DHE do que à dose cumulativa de MTX.5–7
Estado inflamatório de longo prazo está associado à SM e à aterosclerose.8 A rigidez aórtica (RA), avaliada principalmente pela velocidade de onda de pulso carotídeo‐femoral (VOP‐cf), é marcador preciso para aterosclerose subclínica.9 Curiosamente, também foi descrita associação entre aumento da rigidez arterial e fibrose hepática avançada, independente de outros fatores de risco cardiometabólicos tradicionais.10 Em pacientes com diabetes mellitus tipo 2 (DM2) com DHE, RA alta ou crescente previu o desenvolvimento de fibrose hepática avançada na elastografia transitória (ET).11
Assim, considerando a associação potencial entre psoríase, risco cardiovascular e DHE, o objetivo deste estudo foi avaliar a prevalência de aterosclerose subclínica detectada pela RA e as relações com a terapia com MTX e IB. Fibrose hepática avançada e esteatose, avaliadas respectivamente por elastografia transitória (FibroScan®) e parâmetro de atenuação controlada (PAC), foram adicionalmente avaliadas quanto à possível associação independente com risco cardiovascular na psoríase.
MétodosDesenho do estudo e pacientesEste foi um estudo transversal realizado de 2020 a 2022 em pacientes ambulatoriais com diagnóstico estabelecido de psoríase (clínica e/ou histopatologicamente), monitorados pela Divisão de Dermatologia em dois centros terciários, Hospital Federal de Bonsucesso e Hospital Universitário Clementino Fraga Filho, com pelo menos 18 anos de idade, independentemente do tipo de tratamento específico para psoríase.
Os critérios de exclusão foram: pacientes infectados por HIV, hepatite B e hepatite C, bem como aqueles com doenças hepáticas crônicas de outras etiologias, exceto doença hepática esteatótica associada ao metabolismo (MASLD, do inglês metabolic‐associated steatotic liver disease); uso de medicamentos hepatotóxicos nos últimos seis meses; uso de medicamentos esteatogênicos (exceto MTX), como corticosteroides sistêmicos, amiodarona, ácido valproico e tamoxifeno nos últimos dois anos ou quimioterapia sistêmica nos últimos cinco anos; ingestão diária de álcool> 20g para mulheres e 30g para homens nos últimos cinco anos; condições que poderiam interferir na análise da rigidez hepática (congestão hepática, ascite, valores de aminotransferase sérica maiores que cinco vezes o limite superior normal, colestase e gravidez). O Comitê de Ética Local de ambos os hospitais aprovou o estudo e todos os pacientes assinaram o termo de consentimento informado.
Procedimentos do estudoOs indivíduos incluídos no estudo foram submetidos à avaliação antropométrica, clínica e laboratorial, medida de VOP‐cf e medidas de rigidez hepática/PAC usando ET. A coleta da amostra de sangue para avaliação metabólica, medidas de rigidez hepática (MRH) e a medida da VOP‐cf foram realizadas no mesmo dia.
Variáveis demográficas, clínicas e laboratoriaisDados demográficos (gênero, idade), antropométricos (índice de massa corporal [IMC], circunferência abdominal) e clínicos (diagnóstico de DM2, hipertensão arterial sistêmica, dislipidemia, SM de acordo com os critérios ATPIII)12 foram coletados. Os dados sobre as características clínicas da psoríase foram o tempo desde o início da psoríase (tempo desde o início da primeira lesão cutânea, lembrado pelo paciente), uso de terapia com IB (a qualquer momento) e dose cumulativa de MTX. Doses cumulativas de MTX ≥ 1.500mg foram consideradas em risco de fibrose hepática.5 Os dados laboratoriais incluíram alanina aminotransferase (ALT), aspartato aminotransferase (AST), gamaglutamil transferase (GGT), colesterol total, HDL‐colesterol, LDL‐colesterol, triglicérides, hemoglobina glicada e contagem de plaquetas. As enzimas hepáticas (AST, ALT e GGT) foram analisadas como valores absolutos e como índices (valor absoluto/limite normal superior).
Rigidez hepática e medidas de parâmetros de atenuação controladaA medida da rigidez hepática foi realizada com pelo menos três horas de jejum por um único operador experiente utilizando FibroScan® TOUCH 502 (Echosens, França) com sondas M e XL projetadas para esse dispositivo. A técnica usada foi descrita anteriormente.13 Apenas resultados com 10 disparos válidos, taxa de sucesso> 60% e razão intervalo interquartil (IIR)/mediana da rigidez hepática <30% foram incluídos na análise. Os resultados foram expressos em quilopascais (kPa). O PAC foi avaliado simultaneamente dentro da MRH válida e foi expresso em decibéis por metro (dB/m). A sonda XL, projetada para avaliar medidas entre 35mm e 75mm de profundidade (contra 25–65mm na sonda M), foi usada nos pacientes nos quais não foi possível obter medidas válidas com a sonda M. O ponto de corte de 10kPa foi usado para descartar FA14 e resultados do PAC ≥ 275dB/m definiram a presença de esteatose.15
Medida da velocidade da onda de pulso carotídeo‐femoral (VOP‐cf)A VOP‐cf foi medida pelo dispositivo e software Complior SP validados (Arthech Medical, Paris, França), por um único operador experiente. As formas de onda carotídea e femoral foram registradas simultaneamente usando mecanotransdutores aplicados diretamente na pele, posicionados em correspondência à artéria carótida interna direita e à artéria femoral direita. O software mediu a diferença de tempo (em milissegundos) decorrido entre o início das ondas de pulso carotídeo e femoral. A distância entre os dois pontos, distância carotídeo‐femoral (em centímetros), foi medida diretamente e multiplicada por 0,8.16 Duas medidas foram obtidas de cada paciente; o resultado foi a média de ambas. Se a diferença entre as duas medidas fosse> 0,5 m/s, uma terceira medida era realizada. A VOP‐cf foi considerada aumentada se ≥ 10 m/s.16
Análise estatísticaOs dados foram registrados em formulários de relato de caso e inseridos no software SPSS 21.0 (IBM Corp, Armonk, Nova York). Variáveis categóricas e contínuas foram analisadas e expressas como frequências para variáveis categóricas, médias com desvios‐padrão e medianas com intervalos interquartis para variáveis contínuas. A análise univariada foi realizada usando o teste Qui‐quadrado ou Fisher para variáveis categóricas e o teste t de Student ou teste de Mann‐Whitney para variáveis contínuas, conforme apropriado. Para a identificação de variáveis independentemente associadas à presença de VOP‐cf ≥ 10 m/s, foi realizada análise de regressão logística binária. As variáveis incluídas no modelo foram aquelas com plausibilidade clínica ou valores de p <0,20 na análise univariada. O nível de significância adotado foi de 5%, e considerados estatisticamente significantes os níveis descritivos (p) abaixo desse valor.
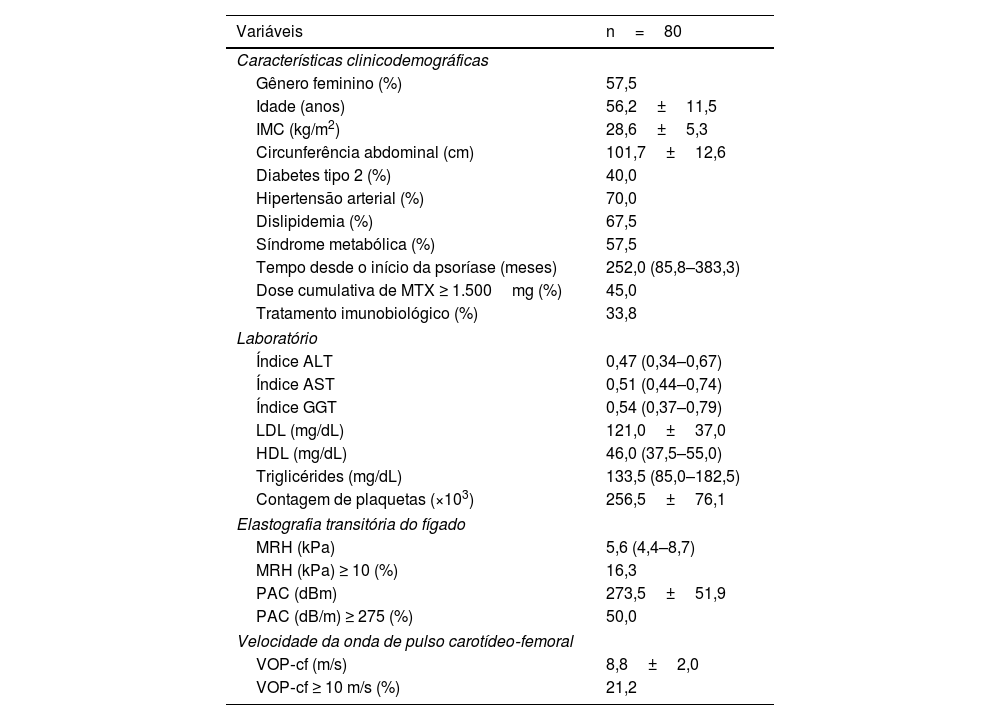
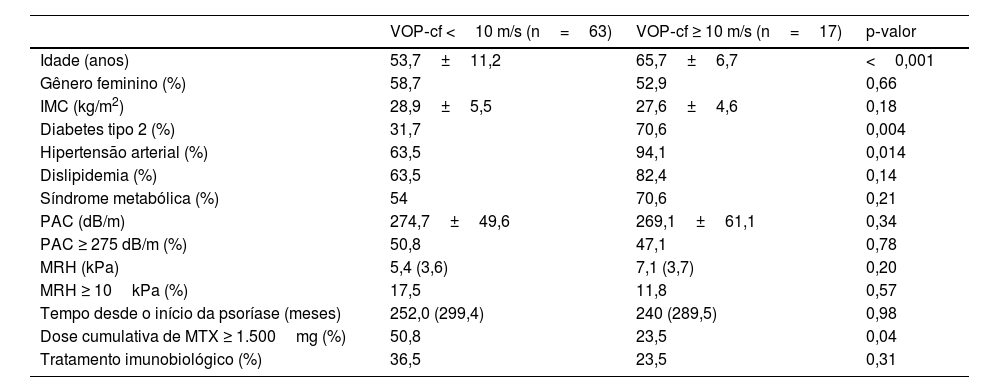
ResultadosDe 2020 a 2022, 80 pacientes foram incluídos (média de idade de 56,2±11,5 anos, 57,5% mulheres, IMC de 28,6±5,3kg/m2). A duração mediana da doença foi de 252 meses (86–383 meses). Todos os pacientes tiveram medidas bem‐sucedidas de VOP‐cf e MRH, bem como coleta de amostra de sangue. Dados demográficos, antropométricos e clínicos são mostrados na tabela 1. Na análise univariada, apenas idade, DM2, hipertensão arterial sistêmica e dose cumulativa de MTX ≥ 1.500mg foram associados com VOP‐cf ≥ 10 m/s (este último inversamente associado; tabela 2). SM, esteatose e fibrose hepática avançada não foram associadas ao aumento da RA. As variáveis incluídas na regressão logística foram idade, gênero, DM2, hipertensão arterial sistêmica, MRH (kPa) e dose cumulativa de MTX ≥ 1.500mg.
Dados clínicodemográficos e laboratoriais de pacientes com psoríase
| Variáveis | n=80 |
|---|---|
| Características clinicodemográficas | |
| Gênero feminino (%) | 57,5 |
| Idade (anos) | 56,2±11,5 |
| IMC (kg/m2) | 28,6±5,3 |
| Circunferência abdominal (cm) | 101,7±12,6 |
| Diabetes tipo 2 (%) | 40,0 |
| Hipertensão arterial (%) | 70,0 |
| Dislipidemia (%) | 67,5 |
| Síndrome metabólica (%) | 57,5 |
| Tempo desde o início da psoríase (meses) | 252,0 (85,8–383,3) |
| Dose cumulativa de MTX ≥ 1.500mg (%) | 45,0 |
| Tratamento imunobiológico (%) | 33,8 |
| Laboratório | |
| Índice ALT | 0,47 (0,34–0,67) |
| Índice AST | 0,51 (0,44–0,74) |
| Índice GGT | 0,54 (0,37–0,79) |
| LDL (mg/dL) | 121,0±37,0 |
| HDL (mg/dL) | 46,0 (37,5–55,0) |
| Triglicérides (mg/dL) | 133,5 (85,0–182,5) |
| Contagem de plaquetas (×103) | 256,5±76,1 |
| Elastografia transitória do fígado | |
| MRH (kPa) | 5,6 (4,4–8,7) |
| MRH (kPa) ≥ 10 (%) | 16,3 |
| PAC (dBm) | 273,5±51,9 |
| PAC (dB/m) ≥ 275 (%) | 50,0 |
| Velocidade da onda de pulso carotídeo‐femoral | |
| VOP‐cf (m/s) | 8,8±2,0 |
| VOP‐cf ≥ 10 m/s (%) | 21,2 |
Os valores são proporções para dados categóricos, média (DP) para dados distribuídos normalmente e medianas (intervalos interquartis) para dados não paramétricos. IMC, índice de massa corporal; Índice ALT, valor absoluto de ALT/limite normal superior; Índice AST, valor absoluto de AST/limite normal superior; Índice GGT, valor absoluto de GGT/limite normal superior; LDL, lipoproteína de baixa densidade; HDL, lipoproteína de alta densidade; MRH, medida de rigidez hepática; PAC, parâmetro de atenuação controlada; VOP‐cf, velocidade de onda de pulso carotídeo‐femoral.
Análise comparativa entre pacientes com psoríase com e sem aumento da rigidez aórtica (VOP‐cf ≥ 10 m/s)
| VOP‐cf <10 m/s (n=63) | VOP‐cf ≥ 10 m/s (n=17) | p‐valor | |
|---|---|---|---|
| Idade (anos) | 53,7±11,2 | 65,7±6,7 | <0,001 |
| Gênero feminino (%) | 58,7 | 52,9 | 0,66 |
| IMC (kg/m2) | 28,9±5,5 | 27,6±4,6 | 0,18 |
| Diabetes tipo 2 (%) | 31,7 | 70,6 | 0,004 |
| Hipertensão arterial (%) | 63,5 | 94,1 | 0,014 |
| Dislipidemia (%) | 63,5 | 82,4 | 0,14 |
| Síndrome metabólica (%) | 54 | 70,6 | 0,21 |
| PAC (dB/m) | 274,7±49,6 | 269,1±61,1 | 0,34 |
| PAC ≥ 275 dB/m (%) | 50,8 | 47,1 | 0,78 |
| MRH (kPa) | 5,4 (3,6) | 7,1 (3,7) | 0,20 |
| MRH ≥ 10kPa (%) | 17,5 | 11,8 | 0,57 |
| Tempo desde o início da psoríase (meses) | 252,0 (299,4) | 240 (289,5) | 0,98 |
| Dose cumulativa de MTX ≥ 1.500mg (%) | 50,8 | 23,5 | 0,04 |
| Tratamento imunobiológico (%) | 36,5 | 23,5 | 0,31 |
Os valores são proporções para dados categóricos, médias (DP) para dados distribuídos normalmente e medianas (intervalos interquartis) para dados não paramétricos. A análise univariada foi realizada usando o teste Qui‐quadrado ou Fisher para variáveis categóricas e o teste t de Student ou teste de Mann‐Whitney para variáveis contínuas. IMC, índice de massa corporal; Índice ALT, valor absoluto de ALT/limite normal superior; Índice AST, valor absoluto de AST/limite normal superior; Índice GGT, valor absoluto de GGT/limite normal superior; N/A, não aplicável; PAC, parâmetro de atenuação controlada; VOP‐cf, velocidade da onda de pulso carotídeo‐femoral.
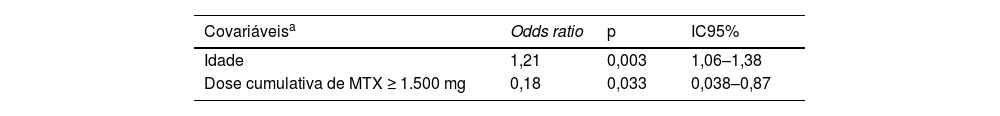
Além do uso de MTX, a idade foi o único outro fator independente associado à VOP‐cf ≥ 10 m/s. A dose cumulativa de MTX ≥ 1.500mg, apresentada em 45% da população, representou fator de proteção cardiovascular, mas não o uso de IB (tabela 3).
Modelo de regressão final para variáveis independentemente associadas à presença de aumento da rigidez aórtica (VOP‐cf ≥ 10 m/s)
| Covariáveisa | Odds ratio | p | IC95% |
|---|---|---|---|
| Idade | 1,21 | 0,003 | 1,06–1,38 |
| Dose cumulativa de MTX ≥ 1.500 mg | 0,18 | 0,033 | 0,038–0,87 |
Este estudo, conduzido em pacientes com psoríase com alta prevalência de SM e seus componentes, como DM2, dislipidemia e hipertensão arterial sistêmica, demonstrou efeito cardiovascular protetor da dose cumulativa de MTX ≥ 1.500mg na aterosclerose subclínica, usando a medida da VOP‐cf para RA. Embora alta prevalência de DHE tenha sido encontrada nesta população, o aumento da RA não foi associado à esteatose ou FA.
Indivíduos com psoríase têm rigidez arterial aumentada bem estabelecida quando comparados aos controles,9,17,18 e na maioria dos estudos ela é independente do efeito de fatores de risco tradicionais, como tabagismo, hipertensão arterial sistêmica e IMC. Isso sugere que a psoríase em si confere risco cardiovascular aumentado, provavelmente em virtude da inflamação crônica. A medida média de VOP‐cf no presente estudo foi de 8,8±2,0 m/s, semelhante à maioria dos estudos que usaram VOP‐cf para análise comparativa.9,19 Todos os estudos anteriores em psoríase foram de caso‐controle, e nenhum deles usou as recomendações estabelecidas para a medida de VOP‐cf, definida por valor de corte padrão de 10 m/s para prever eventos cardiovasculares.16 Portanto, o presente estudo foi o primeiro a relatar a prevalência de aumento da RA usando valor padrão de VOP‐cf ≥ 10 m/s em população de pacientes com psoríase.
A prevalência de VOP‐cf ≥ 10 m/s no presente estudo foi de 21,2%, semelhante à prevalência de 25% encontrada em 477 pacientes com DM2 do estudo aninhado no Rio de Janeiro Type 2 Diabetes Cohort Study,20 também uma população com alto risco cardiovascular. É importante notar que o aumento da RA não foi independentemente associado à SM e seus componentes no presente estudo, e isso corrobora a hipótese de que a própria psoríase poderia aumentar o risco cardiovascular.
Como a MASLD é em si fator de risco para aterosclerose,10,21 a avaliação da RA pode ser útil para prever o risco cardiovascular e de fibrose hepática nessa população. O aumento da RA pode ser a “marca registrada” para vincular os múltiplos mecanismos inflamatórios e mediados por citocinas da hipótese do eixo hepato‐dérmico,22,23 pois reflete os efeitos em longo prazo de fatores de risco estabelecidos e desconhecidos18 para complicações cardiovasculares e hepáticas. O presente estudo é o primeiro a avaliar a associação entre rigidez arterial e DHE em psoríase. Infelizmente, não foi possível demonstrar essa ligação entre fibrose hepática e aterosclerose precoce, provavelmente em virtude do tamanho amostral bastante pequeno. Portanto, estudos com amostras maiores são necessários para esclarecer melhor essa relação potencial.
A associação independente entre idade e aumento da RA reflete os processos fisiopatológicos causados pelo envelhecimento na composição da matriz extracelular das paredes arteriais.18,24 Curiosamente, a duração da doença no presente estudo não teve associação com aumento da RA, embora tenha sido relatado anteriormente em estudo de caso‐controle,25 que confirmou essa associação mesmo após ajuste para fatores de confusão (idade, peso, altura, frequência cardíaca e pressão média central). Poderia ser hipotetizado que, no presente estudo, os pacientes em uso de MTX tiveram benefício no risco cardiovascular, minimizando o efeito da duração da doença.
O efeito protetor do MTX na aterosclerose subclínica na psoríase encontrado neste estudo é pouco relatado na literatura. Usando medidas de espessura íntima‐média carotídea ou braquial e função endotelial, os resultados com MTX e IB são divergentes.21,26 No presente estudo, o risco cardiovascular subclínico (não eventos cardiovasculares) foi avaliado com o método referência e foi possível demonstrar efeito anti‐inflamatório do MTX no risco cardiovascular, apesar da alta prevalência de comorbidades cardiovasculares como hipertensão arterial, dislipidemia e a própria SM em mais de 50% dos pacientes. Esses dados destacam o papel da inflamação na aterosclerose, independentemente do fenótipo metabólico.27,28 Não foi possível demonstrar o mesmo efeito protetor com a terapia com IB, provavelmente em virtude do menor número de pacientes usando IB e/ou devido ao fato de ser terapia mais recente para psoríase.
Ao analisar eventos cardiovasculares, três metanálises com pacientes apresentando inflamação sistêmica (principalmente artrite reumatoide)29–31 demonstraram que o tratamento com MTX foi associado à redução da incidência de eventos cardiovasculares. Na revisão sistemática de Horreau et al.,29 exclusivamente em pacientes com psoríase, dois grandes estudos retrospectivos encontraram efeito protetor do MTX na incidência de eventos cardiovasculares importantes. Em um deles, o tratamento com MTX e agentes biológicos também foi associado à redução do risco de morte e eventos de doenças cardiovasculares em pacientes com psoríase grave em análise subsequente da prática clínica.32
Há algumas limitações no presente estudo. O delineamento transversal não permite que a causalidade seja comprovada. A gravidade da doença não foi medida, e as associações não foram realizadas em relação a essa variável. O tamanho amostral pode ter comprometido as associações potenciais entre fibrose hepática e aterosclerose precoce, bem como o potencial efeito protetor dos IB no risco cardiovascular. Entretanto, a maioria dos estudos de caso‐controle que estabeleceram RA significantemente maior em pacientes com psoríase envolveram amostras variando de 20 a 73 pacientes.18
ConclusãoEfeito protetor cardiovascular do MTX na aterosclerose subclínica foi observado em uma população com psoríase com alta prevalência de SM e seus componentes.
Suporte financeiroEste estudo recebeu suporte financeiro por meio de subsídios 429965/2018‐4 do Conselho Nacional de Pesquisa e Tecnologia, Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Brasil.
Contribuição dos autoresLuciana Agoglia: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Helena Peixoto: Obtenção, análise e interpretação de dados.
Ana Carolina Cardoso: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Lívia Barbosa: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Cecília S.X.L. Victer: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Sueli Carneiro: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Gil F. Salles: Revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Cristiane A. Villela‐Nogueira: participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Maria Chiara Chindamo: Participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Este estudo recebeu suporte financeiro através de subsídios 429965/2018‐4 do Conselho Brasileiro de Desenvolvimento Científico e Tecnológico (CNPq‐Brasil).
Como citar este artigo: Agoglia L, Peixoto H, Cardoso AC, Barbosa L, Victer CSXL, Carneiro S, et al. Psoriasis and cardiovascular risk: associated and protective factors. An Bras Dermatol. 2025;100:456–61.
Trabalho realizado no Hospital Universitário Clementino Fraga Filho, Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, e Hospital Federal de Bonsucesso, Rio de Janeiro, RJ, Brasil.