Desde a sua introdução na prática médica, a microscopia confocal de reflectância (MCR) tem sido uma valiosa ferramenta diagnóstica não invasiva para avaliação de neoplasias benignas e malignas da pele. Também tem sido utilizada como adjuvante no diagnóstico de lesões cutâneas ambíguas que não apresentam propriedades clínicas ou dermatoscópicas características. O uso da MCR levou a diminuição do número de biópsias de lesões benignas. Muitos estudos publicados mostram forte correlação entre MCR e histopatologia, criando assim uma ponte entre a clínica, a dermatoscopia e a histopatologia. Os dermatopatologistas podem potencialmente desempenhar papel importante na interpretação de imagens confocais, com capacidade de correlacionar achados histopatológicos. A MCR também tem se mostrado um importante coadjuvante para delinear as margens tumorais durante a cirurgia, bem como monitorar o tratamento não cirúrgico de cânceres de pele. A tecnologia avançada com sondas menores, como a VivaScope 3000, possibilitou o acesso a lesões em locais anatômicos anteriormente inacessíveis. Essa revisão explica os princípios técnicos da MCR e descreve as características mais comuns da MCR da pele normal com sua correlação histológica correspondente.
Desde a sua introdução na prática clínica, a microscopia confocal de reflectância (MCR) tem sido valiosa no diagnóstico não invasivo de neoplasias benignas e malignas da pele. Tem sido utilizada como ferramenta auxiliar em lesões com características clínicas e dermatoscópicas ambíguas. Assim, a MCR reduziu a necessidade de realizar biópsias de lesões benignas, principalmente em áreas esteticamente sensíveis.
A MCR é uma técnica de imagem não invasiva que fornece detalhes celulares desde a epiderme até a derme papilar. Em contraste com a histopatologia convencional, os cortes são observados no plano horizontal em relação à superfície da pele. A correlação dos achados da MCR e da histopatologia possibilita a inclusão do dermatopatologista como importante colaborador na avaliação e interpretação das imagens adquiridas com a MCR.
Este artigo apresenta uma revisão dos aspectos históricos e técnicos da MCR, bem como uma breve revisão dos achados da pele normal através da microscopia confocal.
Contexto históricoA tecnologia da MCR foi criada em 1955, por Marvin Minsky, e patenteada em 1957. A microscopia confocal proporcionou a capacidade de seccionamento óptico direto, não invasivo e seriado de pele intacta, com observação instantânea de imagens ampliadas com alta resolução, no plano horizontal, enquanto a sonda é deslocada sobre a área em exame.1
A primeira publicação científica com dados e imagens geradas por microscópio confocal foi de autoria de M. David Eggar e Petran, em 1967; os autores descreveram o projeto e a construção do microscópio confocal. Em 1969, e posteriormente em 1971, Davidovits e Egger publicaram os primeiros estudos utilizando o microscópio confocal com varredura a laser na avaliação de tecidos, utilizando fragmento de nervo ex vivo.2,3
A análise de tecidos vivos, no entanto, foi iniciada em 1980, quando vários grupos de pesquisa desenvolveram os primeiros estudos com tecidos de humanos e outros animais. O mapeamento da pele humana com o uso da MCR foi realizado em 1995, por Rajadhyaksha et al., pioneiros na obtenção de imagens da pele de alta resolução instantâneas e não destrutivas.4
Princípios técnicosDesde 1995, o uso da MCR tem aumentado nos principais centros acadêmicos dermatológicos do mundo. Com os avanços da tecnologia e a consequente melhoria na funcionalidade e no design, o dispositivo ajudou a revolucionar a abordagem diagnóstica e o tratamento de neoplasias cutâneas.
O princípio da MCR envolve o uso de uma fonte de luz que ilumina um ponto focal na pele. A imagem refletida é então exibida em um detector após passar por um pequeno orifício, tornando possível que apenas a área em foco seja observada. A tecnologia da MCR é baseada no uso de laser de baixa potência (laser de diodo), que emite luz infravermelha de 830 nanômetros (nm). A seção óptica das imagens da MCR é comparável à resolução das imagens histopatológicas de 30×. Existem dois tipos de equipamentos de MCR atualmente disponíveis para o diagnóstico de lesões de pele. O modelo tradicional (VivaScope 1500; CaliberID, Rochester, NY) compõe as seções ópticas em um mosaico de imagens, propiciando um campo de visão de 838mm2. O modelo portátil (Vivascope 3000; CaliberID, Rochester, NY), introduzido na prática dermatológica em 2011, conta com uma sonda menor que possibilita a avaliação de lesões em áreas curvas da face e áreas anatômicas de difícil acesso. Esse modelo oferece um campo de visão limitado de 131mm2.
O modelo Vivascope 1500 oferece resolução lateral de cerca de 1 micrômetro e resolução axial de 3 a 5 micrômetros. Ele atinge uma profundidade de cerca de 200‐250 micrômetros, propiciando a observação da derme papilar. Em áreas com epiderme mais fina, como a face e membranas mucosas, é possível analisar também a derme reticular superficial. Com esse modelo, um aro de metal com uma janela de plástico é colocado sobre a lesão. O óleo de imersão atua como interface entre a pele e o anel plástico, e o gel de ultrassom é o meio no qual a lente é imersa antes do acoplamento. A MCR varre a pele na direção horizontal, produzindo múltiplas imagens individuais de 0,5×0,5mm2, formando um mosaico de até 8×8mm2. A profundidade precisa é controlada pelo software de navegação e selecionada pelo examinador, até uma profundidade máxima de 250 micrômetros. O operador navega o sistema guiado pela imagem dermatoscópica da lesão, obtida após a colocação do anel de fixação e antes da colocação da lente. Isso permite orientação e imagens sistemáticas da lesão.5,6
O Vivascope 3000 é um modelo com sonda portátil de fácil mobilização. A vantagem desse modelo é sua pequena sonda, alcançando áreas de difícil acesso. O processo de obtenção de imagens é mais rápido com o Vivascope 3000. A desvantagem é o pequeno campo de visão, de 1×1mm2, e a capacidade de fazer apenas cortes verticais em vez de horizontais. O modelo de MCR portátil provou ser particularmente útil no diagnóstico de pápulas faciais solitárias, com sensibilidade de 93% e especificidade de 78% no diagnóstico de carcinoma basocelular.6,7
Aplicações clínicasO microscópio confocal de reflectância tem a vantagem da avaliação “histopatológica virtual”, não invasiva da neoplasia em tempo real.
O dispositivo possibilita avaliar mais da lesão, em contraste com a histopatologia, na qual apenas aproximadamente 2% da amostra é analisada. As imagens obtidas por MCR podem, portanto, potencialmente definir as margens do tumor durante as ressecções cirúrgicas. Por exemplo, alguns estudos têm demonstrado que a MCR é valioso coadjuvante na definição das margens cirúrgicas durante a cirurgia micrográfica de Mohs. Estudos demonstraram sensibilidade de 86% a 96% e especificidade de 89% a 99% na identificação do carcinoma basocelular durante a cirurgia de Mohs.8–10
O microscópio confocal de refletância tem sido usado como ferramenta auxiliar em lesões com características clínicas e dermatoscópicas ambíguas, aumentando a precisão na seleção de neoplasias que requerem biópsia.6,8
Outra indicação importante da microscopia confocal é no monitoramento da resposta ao tratamento não cirúrgico de ceratose actínica, carcinoma espinocelular, carcinoma basocelular e melanoma em áreas fotoexpostas.11–15
Características da MCR da pele normal e sua correlação com a histologiaComo dito anteriormente, existe uma excelente correlação entre a histologia e a MCR – ou seja, a MCR é uma ponte entre a clínica, a dermatoscopia e a histopatologia.
A observação das estruturas com microscopia confocal é feita com base na diferença na refração da luz. Estruturas com alto índice de refração aparecem brilhantes e brancas, enquanto estruturas com baixo índice de refração aparecem escuras. A melanina como agente de alto contraste, com índice de refração de 1,7, propicia o reconhecimento de células individuais ricas em melanina, como os melanócitos, queratinócitos pigmentados e melanófagos. A queratina tem índice de refração de 1,5, possiblitando a detecção de neoplasias de queratinócitos.
As fibras colágenas e células inflamatórias, como os neutrófilos, com índice de refração de 1,34, também aparecem brilhantes nas imagens obtidas com a MCR. As fibras colágenas aparecem como bandas lineares brilhantes na derme, e as células inflamatórias como estruturas pequenas, brancas, arredondadas e homogêneas. As células inflamatórias, apesar de apresentarem índice de refração menor do que a melanina, ainda aparecem como partículas brilhantes na MCR.5,6 Entretanto, a maioria das doenças inflamatórias da pele estudadas com a MCR eram lesões ricas em linfócitos. Os critérios para diferenciação entre linfócitos e neutrófilos não foram estabelecidos.16–18
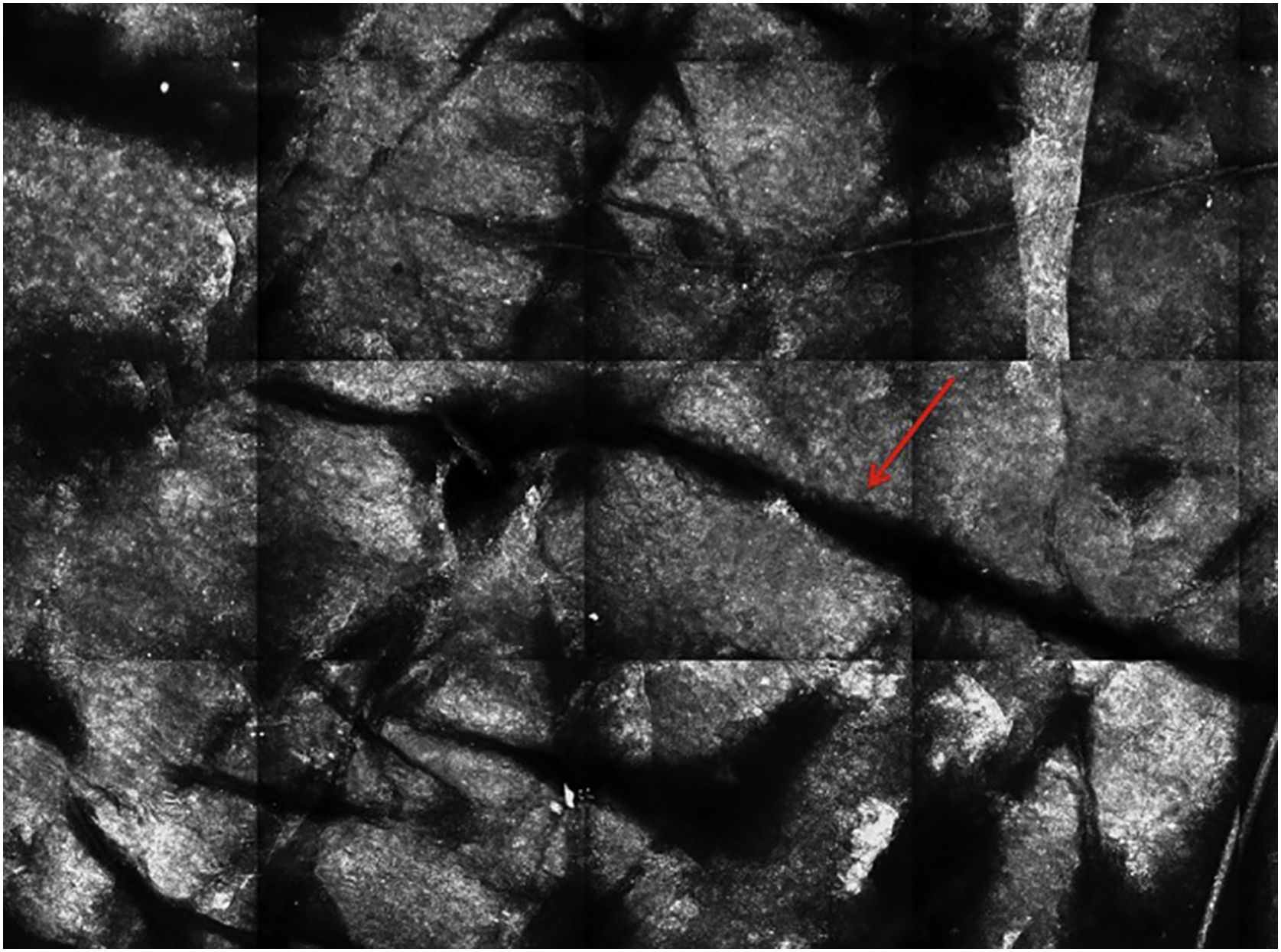
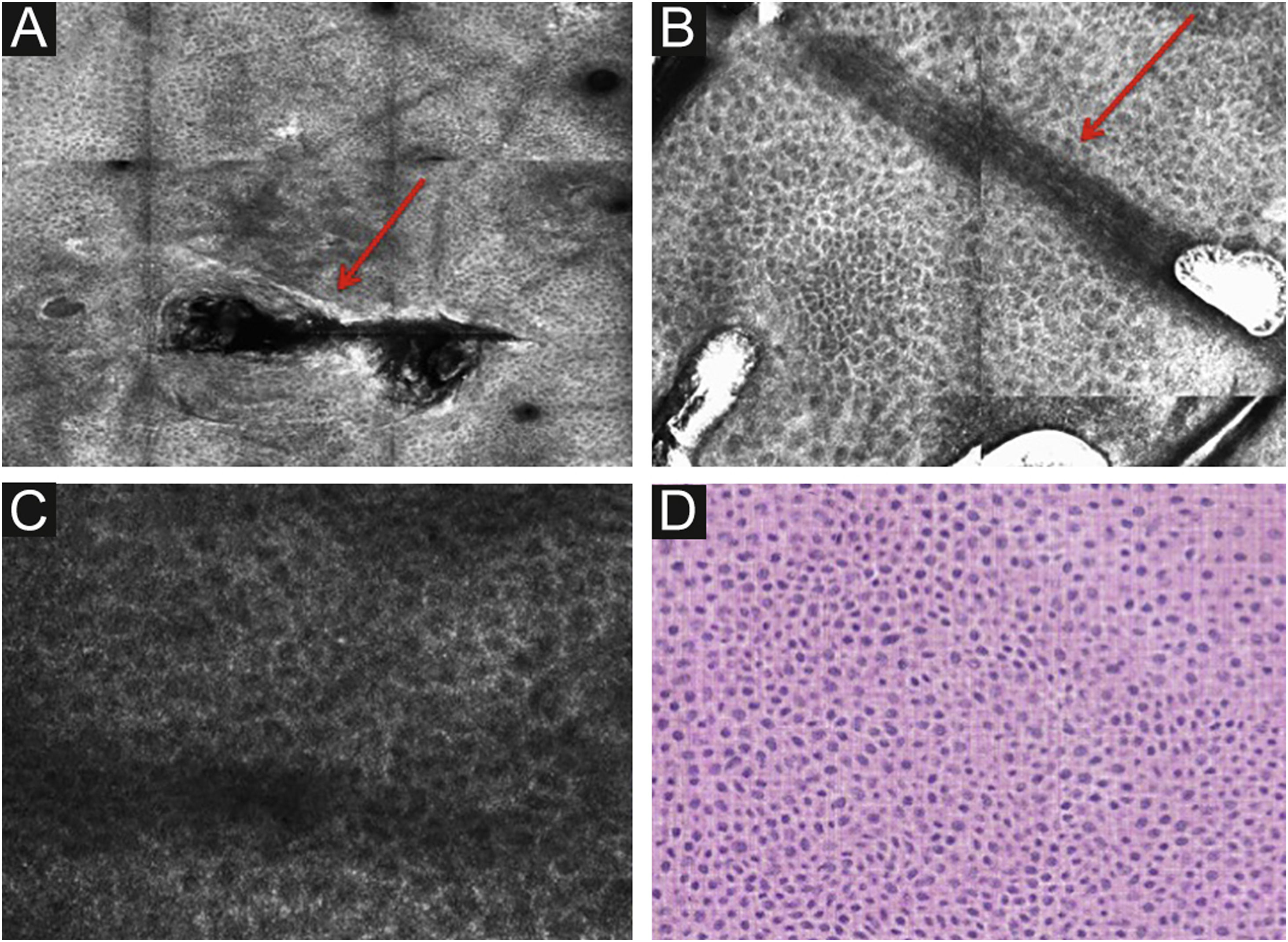
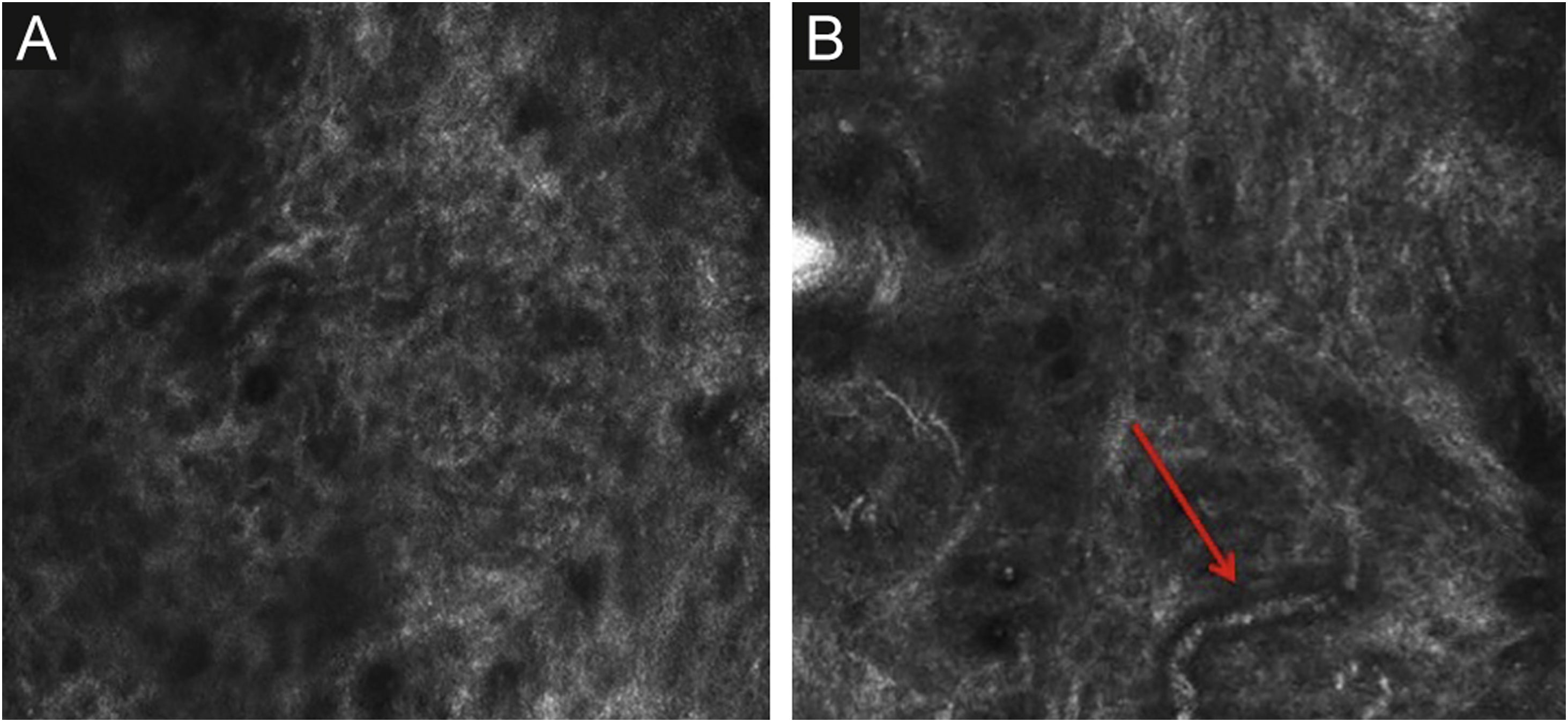
Estrato córneoA primeira camada de pele a ser avaliada é o estrato córneo. A esse nível podem ser observadas células achatadas sem núcleo, que se agregam formando ilhas separadas por fendas escuras (fig. 1). As estruturas escuras lineares observadas representam os dermatóglifos da pele. As células correspondem aos corneócitos anucleados que se destacam na microscopia confocal, em decorrência de seu alto conteúdo de queratina. Nesse nível, as escamas aparecem como estruturas amorfas altamente refletivas (fig. 2A e 2B).5,16
Microscopia confocal de reflectância (MCR) da camada espinhosa‐granular. (A) Padrão típico em favo de mel; estrutura amorfa hiperrefletiva representando escamas (seta vermelha). (B) Padrão típico em favo de mel, estruturas lineares escuras representando os dermatóglifos (seta vermelha). (C) Imagem de MCR com maior ampliação mostrando um padrão típico em favo de mel, caracterizado por células poligonais monomórficas com fino contorno representando os queratinócitos típicos. (D) Histopatologia: queratinócitos típicos com uniformidade de tamanho e forma (Hematoxilina & eosina, 400×).
Aproximadamente 15 a 20μm abaixo do estrato córneo, está a camada granular. Nesse nível, os queratinócitos são achatados, com grânulos internos, caracterizados na microscopia confocal por núcleos centrais escuros, circundados pelo contorno branco e brilhante do citoplasma. Isso se deve aos grânulos de queratina localizados ali. A disposição dos queratinócitos adjacentes uns aos outros nessa camada segue um padrão conhecido como “favo de mel” típico ou regular (fig. 2C).
A camada espinhosa está localizada entre 20 e 100μm de profundidade. Ela aparece na MCR com morfologia similar à da camada granular, com o típico padrão em “favo de mel”, mas com queratinócitos menores.
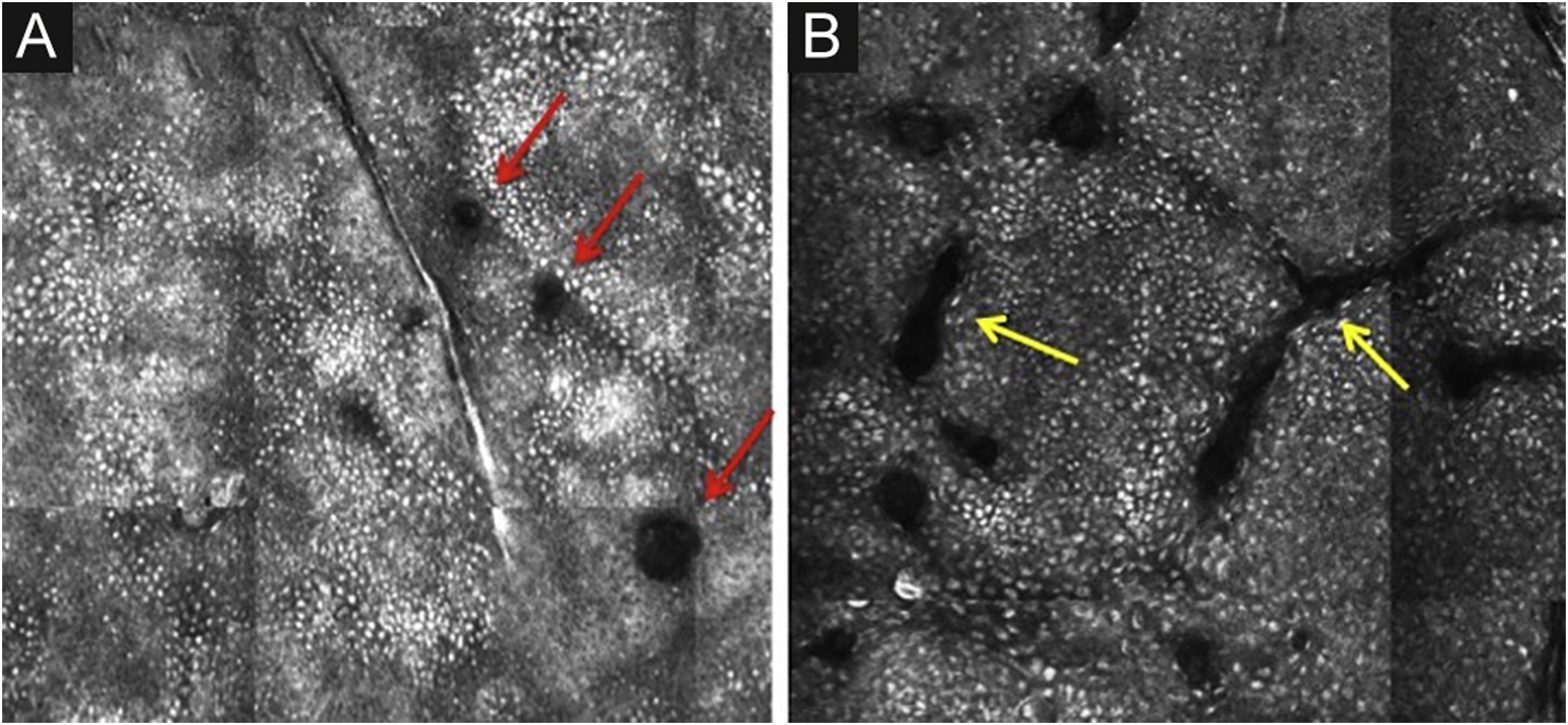
A camada basal está localizada entre 40 e 130μm de profundidade e seu aspecto na MCR varia de acordo com o fototipo da pele. A pele dos fototipos III a IV apresenta padrão conhecido como “calçamento de pedras”, formado por conjuntos de queratinócitos brancos, brilhantes e pequenos (fig. 3). A alta refletividade dessas células deve‐se à capa de melanina supranuclear, proporcionando alta luminância ao redor do núcleo, em contraste com o restante do citoplasma, que é relativamente mais escuro. Os queratinócitos basais na pele fototipo I‐II são menos pigmentados; portanto, essas células não têm aparência tão brilhante na microscopia confocal.5,16
Microscopia confocal de reflectância da camada basal. Padrão em “calçamento de pedras”, caracterizado por conjuntos de pequenas estruturas arredondadas brancas brilhantes representando os queratinócitos basais pigmentados. As estruturas redondas escuras representam os folículos pilosos (setas vermelhas), e as fissuras lineares escuras representam as invaginações da pele (setas amarelas).
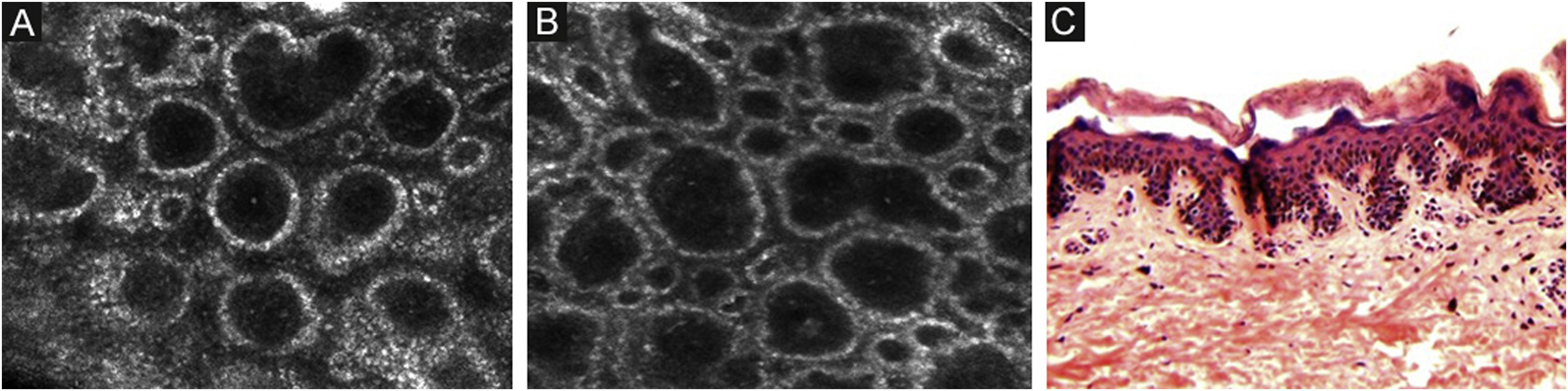
Os melanócitos na junção dermoepidérmica (JDE) geralmente não são identificáveis na pele normal de indivíduos com fototipo I a II. A JDE é caracterizada na MCR por queratinócitos basais brilhantes circundando a papila dérmica escura, criando um padrão conhecido como papilas bem demarcadas, formadas por anéis celulares bem demarcados ao redor de um centro escuro que corresponde à derme papilar (fig. 4).
Microscopia confocal de reflectância da junção dermoepidérmica. (A e B) Papilas bem demarcadas formadas por anéis bem demarcados ao redor de centro escuro representando os queratinócitos pigmentados e/ou melanócitos basais circundando a papila dérmica escura. O padrão anular define papilas bem demarcadas. (C) Histologicamente, o padrão anular representa cones interpapilares alongados, com um número aumentado de melanócitos isolados na camada basal.
A derme papilar e reticular superficial aparecem com baixa refletividade e podem apresentar vasos sanguíneos e fibras de colágeno.5,16
As lesões melanocíticas pigmentadas podem apresentar dois padrões na JDE: o padrão anular, caracterizado por um anel de células brilhantes delimitando as papilas bem demarcadas (fig. 4), e o padrão em malha, caracterizado por cordões alongados e espessamento da região da JDE (fig. 5). Histologicamente, o padrão anular representa cones interpapilares alongados com número aumentado de melanócitos únicos na camada basal. Os queratinócitos basais pigmentados correspondem a um padrão lentiginoso. Em contraste, o padrão em malha corresponde na histopatologia ao alargamento do espaço interpapilar formado por melanócitos agregados, com ninhos predominantemente pequenos e não confluentes na ponta dos cones interpapilares.
Microscopia confocal de reflectância da junção dermoepidérmica. (A) Padrão em malha, caracterizado por cordões hiperrrefletivos alongados, correspondendo ao espessamento juncional. (B) Aumento maior mostrando cordões alongados se interligando; estruturas brancas redondas representam cistos tipo milia (setas vermelhas). (C) Histopatologia mostrando o alargamento do espaço interpapilar, formado por melanócitos agregados, com ninhos predominantemente pequenos e interconectados na extremidade dos cones interpapilares.
A derme papilar e reticular superficial apresenta vasos sanguíneos e fibras de colágeno. As imagens de MCR mostram áreas escuras difusas, com finas espirais hiperrefletivas e estruturas paralelas na derme papilar (fig. 6A), e estruturas brancas rugosas na derme reticular superior. As estruturas brancas representam as fibras de colágeno. Os vasos aparecem como estruturas tubulares escuras (fig. 6B). O movimento das células sanguíneas no interior dos vasos pode ser observado durante a captura de imagens.
Microscopia confocal de reflectância da derme papilar. (A) Áreas escuras difusas, com espirais hiperrefletivas e estruturas paralelas correspondentes aos feixes de colágeno fibrilar. (B) Os vasos aparecem como estruturas tubulares escuras com pequenas estruturas brancas brilhantes correspondentes às células sanguíneas (seta vermelha).
A aparência da “pele normal” pode variar dependendo da localização anatômica, da idade do paciente e da quantidade de dano cutâneo decorrente da exposição crônica ao sol. A tabela 1 resume as principais características da MCR da pele normal e sua correlação com a histologia.
Características da pele normal na microscopia confocal de reflectância e correlação com a histologia
| Características da MCR | Descrição histológica | |
|---|---|---|
| Estrato córneo | Células achatadas sem núcleo que se agregam formando ilhas separadas por fendas escuras | Corneócitos anucleados adjacentes uns aos outros |
| Estruturas amorfas altamente reflexivas | Escamas | |
| Camada espinhosa‐granular | Padrão em favo de mel, formado por estruturas arredondadas adjacentes umas às outras com núcleos centrais escuros circundados por um contorno branco brilhante do citoplasma, devido ao conteúdo de grânulos de queratina | Queratinócitos planos, com grânulos internos |
| Camada basal | Padrão de “calçamento de pedras”, formado por conjunto de queratinócitos brancos brilhantes e pequenos | Queratinócitos pequenos e pigmentados |
| Junção dermoepidérmica | Anéis bem demarcados de células em torno de centro escuro correspondendo às papilas dérmicas | Queratinócitos basais brilhantes circundando a papila dérmica escura |
| Lesões melanocíticas pigmentadas: padrão anelado, caracterizado por uma borda de células brilhantes delimitando as papilas dérmicas; padrão em malha, caracterizado por espessamento juncional | Padrão anular: cones interpapilares alongados com aumento do número de melanócitos isolados na camada basal e queratinócitos basais pigmentados correspondendo a um padrão lentiginoso | |
| Padrão em malha: alargamento do espaço interpapilar formado por melanócitos agregados, com ninhos predominantemente pequenos e não confluentes na extremidades dos cones interpapilares | ||
| Derme papilar | Área escura difusa com finas bandas lineares brilhantes na derme papilar e estruturas brancas grosseiras na derme reticular superior. | As estruturas brancas representam as fibras de colágeno na derme |
| Os vasos aparecem como estruturas tubulares escuras contendo pequenas células brancas redondas | Vasos sanguíneos e linfócitos dentro dos vasos sanguíneos |
MCR, microscopia confocal de reflectância.
Uma limitação da MCR é a incapacidade de analisar estruturas abaixo de 250 mícrons de profundidade. Consequentemente, alterações na derme reticular e áreas invasivas de tumores não podem ser avaliadas. Em lesões com espessamento significativo da epiderme, incluindo lesões palmo‐plantares, o exame com a microscopia confocal é limitado à epiderme.
Existem fatores que também podem comprometer a qualidade da imagem. Hiperceratose e resíduos de cremes contendo partículas com alto índice de refração (por exemplo, protetor solar) podem criar artefatos. A superfície não uniforme da pele também pode resultar na formação de bolhas de ar, que constituem artefatos.
A interpretação das imagens de MCR requer treinamento. Conhecimento robusto em dermatopatologia é uma vantagem, pois as estruturas da MCR se correlacionam com os achados histológicos. Existe o desafio de diferenciar estruturas e células com índice de refração semelhante (ou seja, melanócitos e células de Langerhans no estrato espinhoso).
Estudos têm demonstrado a utilização do microscópio confocal de reflectância como ferramenta auxiliar no diagnóstico de doenças infecciosas e inflamatórias da pele, como psoríase, dermatite de contato, linfoma cutâneo de células T, lúpus eritematoso discoide e onicomicose. Entretanto, faltam estudos com metodologia adequada que demonstrem a capacidade de distinguir diferentes tipos de células inflamatórias com microscopia confocal.4,17,18
Uma série de novos projetos no contexto do desenvolvimento tecnológico parecem promissores para o uso futuro da MCR. Dispositivos que capturam imagens da pele usando escaneamento em linha, em vez de escanear um ponto, já estão sendo desenvolvidos. Isso reduzirá o tempo de aquisição da imagem. Aparelhos de microscopia confocal com software programado para reconhecimento automatizado de detalhes anatômicos da pele também estão sendo estudadas, com possibilidade de reconstrução de imagens em três dimensões.19,20
Por fim, as imagens confocais fluorescentes que aparecem após a injeção intradérmica de contraste in vivo, como o verde de indocianina, também estão em fase de testes, com o objetivo de melhorar a identificação das estruturas observadas com a MCR.21,22
ConclusõesCom quase 20 anos de utilização na prática dermatológica, o microscópio confocal de reflectância provou ser auxiliar diagnóstico eficaz no diagnóstico de uma variedade de neoplasias da pele. Seu uso tem certamente auxiliado no manejo de lesões clinicamente ambíguas, reduzindo o número de biópsias e, portanto, custos, bem como a ansiedade do paciente em relação a procedimentos diagnósticos mais invasivos. Num futuro próximo, com tecnologia avançada, a MCR tem potencial para fornecer informações mais detalhadas em menor período de tempo, para auxiliar o médico no diagnóstico e manejo dos pacientes.
Suporte financeiroNenhum.
Contribuição dos autoresNaiara Fraga Braghiroli fez contribuições substanciais na concepção e planejamento do manuscrito, obtenção, análise e interpretação dos dados; leitura e aprovação da versão final do manuscrito.
Samantha Sugerik participou da revisão, formatação e envio do manuscrito; leu e aprovou a versão final do manuscrito.
Luiz Antônio Rodrigues de Freitas revisou as imagens digitais histológicas, revisou o manuscrito final e aprovou a versão final a ser publicada; leu e aprovou o manuscrito final.
Margaret Oliviero participou da obtenção, análise e interpretação dos dados, bem como da redação do manuscrito e da revisão crítica do conteúdo intelectual importante; leu e aprovou o manuscrito final.
Harold Rabinovitz participou da análise e interpretação dos dados; também revisou o manuscrito final e aprovou a versão final a ser publicada; leu e aprovou o manuscrito final.
Conflito de interessesNenhum.
Como citar este artigo: Braghiroli NF, Sugerik S, Freitas LA, Oliviero M, Rabinovitz H. The skin through reflectance confocal microscopy – Historical background, technical principles, and its correlation with histopathology. An Bras Dermatol. 2022;97:697–703.
Trabalho realizado no Skin and Cancer Associate, Departamento de Dermatologia, Plantation, Estados Unidos.