Risco aumentado de neoplasias malignas secundárias (NMS) associadas à micose fungoide (MF) foi sugerido anteriormente. Contudo, a relação entre esse risco e as características da MF não é bem conhecida.
ObjetivoInvestigar a taxa e os tipos de NMS em uma grande coorte de pacientes com MF, concentrando‐se nas características presentes desses pacientes.
MétodosForam determinadas as características demográficas, o subtipo e o estágio da MF, a relação temporal entre o diagnóstico de MF e o desenvolvimento de NMS. As principais características clínicas da MF neste grupo foram comparadas com as de pacientes com MF sem associação de NMS.
ResultadosEm 730 pacientes com MF com seguimento médio de 67,9±52,4 meses, foram identificados 56 NMS em um total de 52 (7,1%) pacientes. Enquanto 28,8% dos pacientes haviam sido diagnosticados anteriormente com outras neoplasias malignas e posteriormente tiveram diagnóstico de MF, ocorreu o contrário em 53,8% dos pacientes. A maioria dos pacientes com MF associada a NMS apresentava MF em estágio inicial (80,7%) e do tipo clássico (86,5%), sem diferença significante em relação aos pacientes com MF sem associação de NMS; 85,5% e 72,5%, respectivamente. As NMS mais comumente identificadas foram neoplasias malignas hematológicas (64,3%), incluindo papulose linfomatoide (n=22), linfoma de Hodgkin (n=4), linfoma não Hodgkin (n=5) e policitemia vera (n=2). Outras neoplasias malignas associadas foram câncer de mama (n=4), câncer de próstata (n=3), carcinoma de células renais (n=2), melanoma (n=2) e sarcoma de Kaposi (n=2).
Limitações do estudoEstudo de um único centro terciário de dermatologia com desenho retrospectivo.
ConclusãoAlém da conhecida associação com papulose linfomatoide, as neoplasias malignas hematológicas sistêmicas também foram bastante comuns nessa grande coorte de pacientes com MF.
A micose fungoide (MF) é o tipo mais comum de linfoma cutâneo primário, classificado no grupo de linfomas de células T não Hodgkin (LNH) extranodais. A MF possui um variado espectro clínico de lesões cutâneas. Três variantes da MF e várias apresentações clínicas foram descritas. O tipo clássico de MF é a apresentação mais comum e é caracterizado por manchas, placas e tumores que podem ser solitários, localizados ou generalizados. Manchas e placas eritematosas e com descamação fina, com predileção pelas regiões glúteas e outras áreas protegidas do sol, representam o estágio inicial da MF clássica. Lesões tumorais de MF localizadas em qualquer parte do corpo podem ocorrer na fase tardia da MF clássica apenas em um número limitado de pacientes, mas também podem complicar tipos raros de MF. A taxa de envolvimento visceral aumenta em pacientes com MF e lesões tumorais. Entretanto, a maioria dos pacientes com MF apresenta doença em estágio inicial ao longo da vida.1,2 Embora existam estudos sugerindo um risco aumentado de neoplasias malignas secundárias (NMS) em pacientes com MF, particularmente linfomas sistêmicos, os fatores que predispõem às NMS não estão descritos e o rastreamento de rotina ainda não é recomendado.1–23 Os estudos anteriores foram limitados principalmente aos Estados Unidos (EUA)3,8–10,13,15–19 ou Europa (Grã‐Bretanha e Finlândia, Dinamarca, Alemanha, Polónia, Itália),5–7,12,21–23 e raramente foram realizados em outras regiões geográficas.11,14,20 É importante. investigar a epidemiologia das neoplasias malignas associadas à MF em diversas populações, a fim de definir adequadamente o papel patogênico de fatores genéticos e ambientais. Além disso, a relação entre esse risco e as características da MF não é bem conhecida. O objetivo do presente estudo foi investigar a taxa e os tipos de NMS em uma grande coorte de pacientes com MF e descrever as características específicas, incluindo subtipo e estágio de MF nesse grupo de pacientes, comparando‐as com características de pacientes com MF sem associação de NMS.
MétodosPacientes consecutivos com MF acompanhados em um único centro dermatológico terciário entre 2001 e 2023 foram avaliados retrospectivamente quanto à associação de NMS. Todas as NMS (excluindo tumores epiteliais cutâneos) observadas nessa coorte anteriormente, simultaneamente ou após o diagnóstico de MF foram incluídas. Além das características demográficas, subtipo e estágio da MF nesse grupo, foi determinada a relação temporal entre o diagnóstico de MF e o desenvolvimento de NMS. As principais características clínicas da MF nesse grupo foram comparadas com as de pacientes sem associação de MS. Este estudo foi aprovado pelo Comitê de Ética Institucional e conduzido de acordo com a Declaração de Helsinque (Número de aprovação: E‐29624016‐050.99‐837385).
ResultadosEm uma coorte de 730 pacientes com MF com período médio de seguimento de 67,9±52,4 meses, foram identificados 56 NMS em um total de 52 (7,1%) pacientes. Quarenta e oito pacientes tiveram uma, enquanto quatro pacientes tiveram duas NMS. Enquanto 15 (28,8%) pacientes tinham diagnóstico anterior de outra neoplasia maligna e posteriormente tiveram diagnóstico de MF, ocorreu o contrário em 28 (53,8%) pacientes, em um tempo médio de 5,5±5,9 anos e 5,2±4,4 anos, respectivamente. Em nove (17,3%) pacientes MF e NMS foram diagnosticadas simultaneamente (tabela 1).
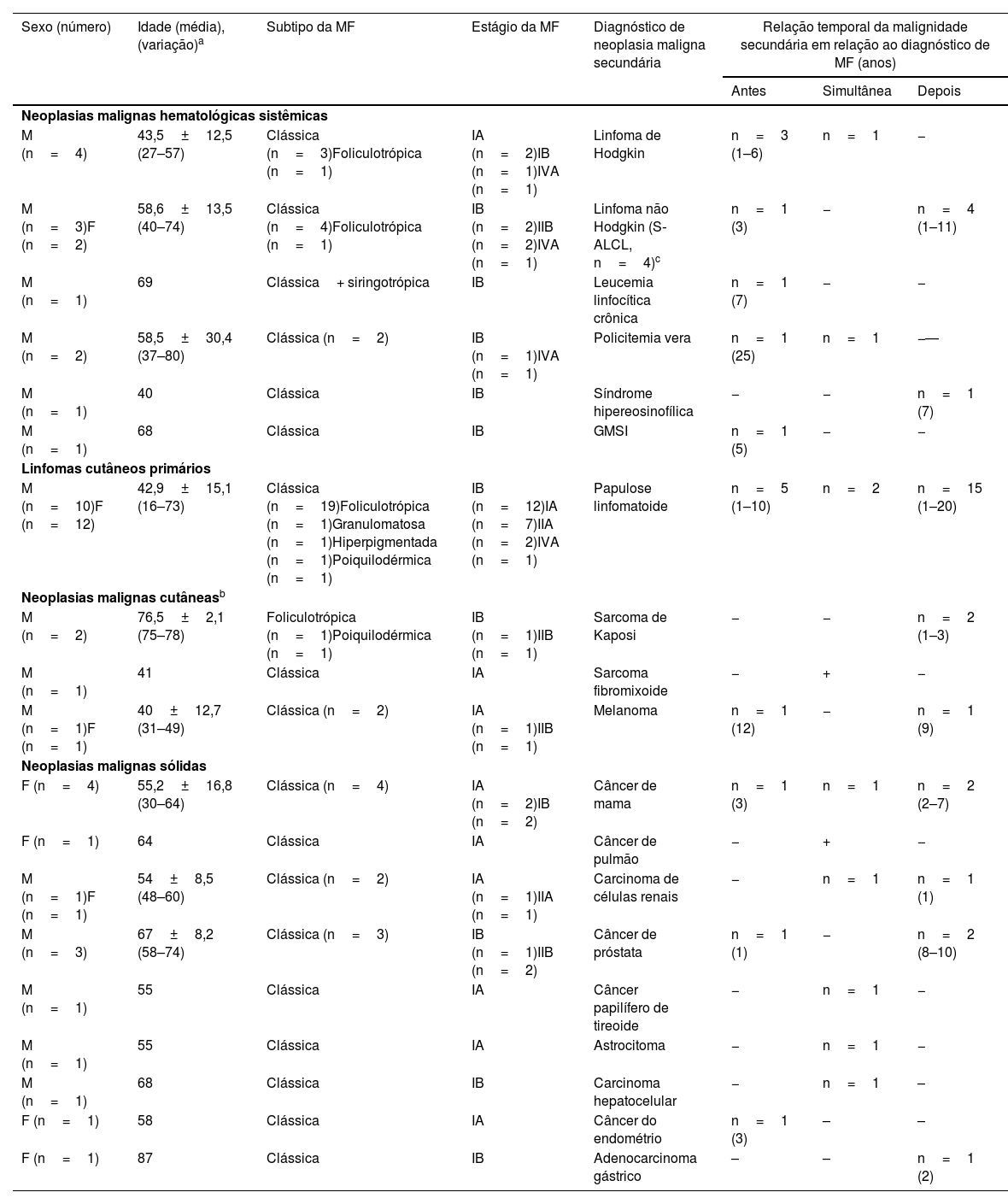
Características clínicas de pacientes com micose fungoide e dados referentes ao diagnóstico de neoplasia maligna secundária
| Sexo (número) | Idade (média), (variação)a | Subtipo da MF | Estágio da MF | Diagnóstico de neoplasia maligna secundária | Relação temporal da malignidade secundária em relação ao diagnóstico de MF (anos) | ||
|---|---|---|---|---|---|---|---|
| Antes | Simultânea | Depois | |||||
| Neoplasias malignas hematológicas sistêmicas | |||||||
| M (n=4) | 43,5±12,5 (27–57) | Clássica (n=3)Foliculotrópica (n=1) | IA (n=2)IB (n=1)IVA (n=1) | Linfoma de Hodgkin | n=3 (1–6) | n=1 | − |
| M (n=3)F (n=2) | 58,6±13,5 (40–74) | Clássica (n=4)Foliculotrópica (n=1) | IB (n=2)IIB (n=2)IVA (n=1) | Linfoma não Hodgkin (S‐ALCL, n=4)c | n=1 (3) | − | n=4 (1–11) |
| M (n=1) | 69 | Clássica+ siringotrópica | IB | Leucemia linfocítica crônica | n=1 (7) | − | − |
| M (n=2) | 58,5±30,4 (37–80) | Clássica (n=2) | IB (n=1)IVA (n=1) | Policitemia vera | n=1 (25) | n=1 | −— |
| M (n=1) | 40 | Clássica | IB | Síndrome hipereosinofílica | − | − | n=1 (7) |
| M (n=1) | 68 | Clássica | IB | GMSI | n=1 (5) | − | − |
| Linfomas cutâneos primários | |||||||
| M (n=10)F (n=12) | 42,9±15,1 (16–73) | Clássica (n=19)Foliculotrópica (n=1)Granulomatosa (n=1)Hiperpigmentada (n=1)Poiquilodérmica (n=1) | IB (n=12)IA (n=7)IIA (n=2)IVA (n=1) | Papulose linfomatoide | n=5 (1–10) | n=2 | n=15 (1–20) |
| Neoplasias malignas cutâneasb | |||||||
| M (n=2) | 76,5±2,1 (75–78) | Foliculotrópica (n=1)Poiquilodérmica (n=1) | IB (n=1)IIB (n=1) | Sarcoma de Kaposi | − | − | n=2 (1–3) |
| M (n=1) | 41 | Clássica | IA | Sarcoma fibromixoide | − | + | − |
| M (n=1)F (n=1) | 40±12,7 (31–49) | Clássica (n=2) | IA (n=1)IIB (n=1) | Melanoma | n=1 (12) | − | n=1 (9) |
| Neoplasias malignas sólidas | |||||||
| F (n=4) | 55,2±16,8 (30–64) | Clássica (n=4) | IA (n=2)IB (n=2) | Câncer de mama | n=1 (3) | n=1 | n=2 (2–7) |
| F (n=1) | 64 | Clássica | IA | Câncer de pulmão | − | + | − |
| M (n=1)F (n=1) | 54±8,5 (48–60) | Clássica (n=2) | IA (n=1)IIA (n=1) | Carcinoma de células renais | − | n=1 | n=1 (1) |
| M (n=3) | 67±8,2 (58–74) | Clássica (n=3) | IB (n=1)IIB (n=2) | Câncer de próstata | n=1 (1) | − | n=2 (8–10) |
| M (n=1) | 55 | Clássica | IA | Câncer papilífero de tireoide | − | n=1 | − |
| M (n=1) | 55 | Clássica | IA | Astrocitoma | − | n=1 | − |
| M (n=1) | 68 | Clássica | IB | Carcinoma hepatocelular | − | n=1 | – |
| F (n=1) | 58 | Clássica | IA | Câncer do endométrio | n=1 (3) | – | – |
| F (n=1) | 87 | Clássica | IB | Adenocarcinoma gástrico | – | – | n=1 (2) |
M, masculino; F, feminino; MF: micose fungoide; GMSI, gamopatia monoclonal de significado indeterminado; S‐ALCL, linfoma anaplásico de grandes células sistêmico.
Observou‐se predominância do gênero masculino em ambos os grupos; 59,6% em pacientes com MF associada a NMS e 59,4% em pacientes com MF sem associação de NMS. A média de idade dos pacientes com MF no momento do diagnóstico de NMS foi de 51,2±17,1 anos, superior à média de idade do diagnóstico de MF (43,5±17,8) na presente coorte principal. A maioria dos pacientes com MF associada a NMS apresentava MF em estágio inicial (80,7%) semelhante aos pacientes com MF sem associação com NMS (85,5%) na presente coorte. O tipo clássico de lesões de MF (86,5%) foi mais comum em pacientes com MF associada a NMS, seguido por MF foliculotrópica (7,7%) compatível com pacientes com MF sem associação de NMS; 72,5% e 7,5%, respectivamente (tabela 1).
As NMS mais comumente identificadas foram as de origem hematológica; 36 neoplasias malignas (64,3%) em 34 pacientes, dos quais 61,8% eram do sexo masculino, e correspondiam a papulose linfomatoide (n=22), linfoma de Hodgkin (LH) (n=4), LNH (n=5), policitemia vera (n=2), leucemia linfocítica crônica (LLC) (n=1), síndrome hipereosinofílica (n=1) e gamopatia monoclonal de significado indeterminado (GMSI) (n=1). Outras neoplasias malignas associadas foram câncer de mama (n=4), câncer de próstata (n=3), carcinoma de células renais (n=2), melanoma (n=2), sarcoma de Kaposi (n=2) seguidas por câncer de pulmão, câncer de tireoide, câncer de endométrio, sarcoma fibromixoide cutâneo, carcinoma hepatocelular, adenocarcinoma gástrico e astrocitoma, estas com um caso cada uma, sendo 55,6% dos pacientes do sexo masculino (tabela 1).
DiscussãoEssa grande série de casos de MF revelou uma associação com papulose linfomatoide como a NMS mais comum nesses pacientes, o que é bem conhecido.2,24 Além disso, várias neoplasias sólidas (n=15), linfomas sistêmicos (n=14), sarcomas cutâneos (n=3) e melanomas cutâneos (n=2) também foram observados nessa grande coorte de pacientes com MF.
A associação de MF e NMS foi avaliada em muitos relatos desde a década de 1950.3 Embora existam muitos estudos descrevendo a associação de MF e NMS na literatura, os grupos incluídos nesses estudos não eram homogêneos, o que dificulta a comparação dos dados disponíveis (tabela 2). Em primeiro lugar, alguns estudos incluíram pacientes apenas com MF7,11,12,14,17–19,21,23 ou síndrome de Sézary,5 enquanto outros incluíram MF e síndrome de Sezary juntas.8,10,15,16,20,22 Além disso, alguns estudos referiram‐se ao seu grupo de pacientes como linfoma cutâneo de células T (LCCT)3,4,6,9,13 (tabela 2). Além disso, alguns estudos antigos concentraram‐se principalmente em neoplasias malignas cutâneas em virtude da possível associação com a fototerapia aplicada no tratamento da MF, com atenção limitada a outras NMS.25 Além disso, alguns dos estudos anteriores avaliaram a associação de MF com apenas um tipo específico de NMS, como melanoma,7 leucemia/linfoma20 ou linfomas sistêmicos de células B.10 No entanto, uma observação consistente na literatura é risco aumentado de desenvolvimento de neoplasias malignas hematológicas secundárias em pacientes com MF, o que também foi apoiado pelo presente estudo. Enquanto 7,1% dos pacientes com MF na série atual apresentavam associação com NMS (excluindo tumores epiteliais cutâneos), mais da metade delas (64,3%) eram neoplasias malignas hematológicas.
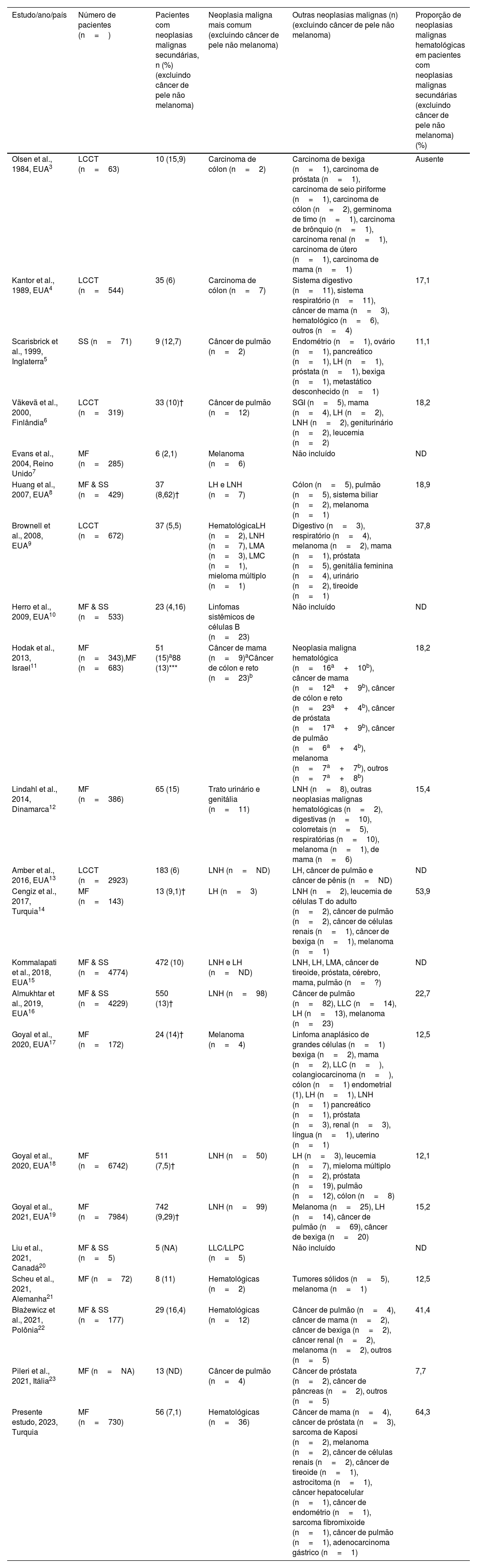
Revisão da literatura sobre neoplasias malignas secundárias em pacientes com micose fungoide
| Estudo/ano/país | Número de pacientes (n=) | Pacientes com neoplasias malignas secundárias, n (%) (excluindo câncer de pele não melanoma) | Neoplasia maligna mais comum (excluindo câncer de pele não melanoma) | Outras neoplasias malignas (n) (excluindo câncer de pele não melanoma) | Proporção de neoplasias malignas hematológicas em pacientes com neoplasias malignas secundárias (excluindo câncer de pele não melanoma) (%) |
|---|---|---|---|---|---|
| Olsen et al., 1984, EUA3 | LCCT (n=63) | 10 (15,9) | Carcinoma de cólon (n=2) | Carcinoma de bexiga (n=1), carcinoma de próstata (n=1), carcinoma de seio piriforme (n=1), carcinoma de cólon (n=2), germinoma de timo (n=1), carcinoma de brônquio (n=1), carcinoma renal (n=1), carcinoma de útero (n=1), carcinoma de mama (n=1) | Ausente |
| Kantor et al., 1989, EUA4 | LCCT (n=544) | 35 (6) | Carcinoma de cólon (n=7) | Sistema digestivo (n=11), sistema respiratório (n=11), câncer de mama (n=3), hematológico (n=6), outros (n=4) | 17,1 |
| Scarisbrick et al., 1999, Inglaterra5 | SS (n=71) | 9 (12,7) | Câncer de pulmão (n=2) | Endométrio (n=1), ovário (n=1), pancreático (n=1), LH (n=1), próstata (n=1), bexiga (n=1), metastático desconhecido (n=1) | 11,1 |
| Väkevä et al., 2000, Finlândia6 | LCCT (n=319) | 33 (10)† | Câncer de pulmão (n=12) | SGI (n=5), mama (n=4), LH (n=2), LNH (n=2), geniturinário (n=2), leucemia (n=2) | 18,2 |
| Evans et al., 2004, Reino Unido7 | MF (n=285) | 6 (2,1) | Melanoma (n=6) | Não incluído | ND |
| Huang et al., 2007, EUA8 | MF & SS (n=429) | 37 (8,62)† | LH e LNH (n=7) | Cólon (n=5), pulmão (n=5), sistema biliar (n=2), melanoma (n=1) | 18,9 |
| Brownell et al., 2008, EUA9 | LCCT (n=672) | 37 (5,5) | HematológicaLH (n=2), LNH (n=7), LMA (n=3), LMC (n=1), mieloma múltiplo (n=1) | Digestivo (n=3), respiratório (n=4), melanoma (n=2), mama (n=1), próstata (n=5), genitália feminina (n=4), urinário (n=2), tireoide (n=1) | 37,8 |
| Herro et al., 2009, EUA10 | MF & SS (n=533) | 23 (4,16) | Linfomas sistêmicos de células B (n=23) | Não incluído | ND |
| Hodak et al., 2013, Israel11 | MF (n=343),MF (n=683) | 51 (15)a88 (13)*** | Câncer de mama (n=9)aCâncer de cólon e reto (n=23)b | Neoplasia maligna hematológica (n=16a+10b), câncer de mama (n=12a+9b), câncer de cólon e reto (n=23a+4b), câncer de próstata (n=17a+9b), câncer de pulmão (n=6a+4b), melanoma (n=7a+7b), outros (n=7a+8b) | 18,2 |
| Lindahl et al., 2014, Dinamarca12 | MF (n=386) | 65 (15) | Trato urinário e genitália (n=11) | LNH (n=8), outras neoplasias malignas hematológicas (n=2), digestivas (n=10), colorretais (n=5), respiratórias (n=10), melanoma (n=1), de mama (n=6) | 15,4 |
| Amber et al., 2016, EUA13 | LCCT (n=2923) | 183 (6) | LNH (n=ND) | LH, câncer de pulmão e câncer de pênis (n=ND) | ND |
| Cengiz et al., 2017, Turquia14 | MF (n=143) | 13 (9,1)† | LH (n=3) | LNH (n=2), leucemia de células T do adulto (n=2), câncer de pulmão (n=2), câncer de células renais (n=1), câncer de bexiga (n=1), melanoma (n=1) | 53,9 |
| Kommalapati et al., 2018, EUA15 | MF & SS (n=4774) | 472 (10) | LNH e LH (n=ND) | LNH, LH, LMA, câncer de tireoide, próstata, cérebro, mama, pulmão (n=?) | ND |
| Almukhtar et al., 2019, EUA16 | MF & SS (n=4229) | 550 (13)† | LNH (n=98) | Câncer de pulmão (n=82), LLC (n=14), LH (n=13), melanoma (n=23) | 22,7 |
| Goyal et al., 2020, EUA17 | MF (n=172) | 24 (14)† | Melanoma (n=4) | Linfoma anaplásico de grandes células (n=1) bexiga (n=2), mama (n=2), LLC (n=), colangiocarcinoma (n=), cólon (n=1) endometrial (1), LH (n=1), LNH (n=1) pancreático (n=1), próstata (n=3), renal (n=3), língua (n=1), uterino (n=1) | 12,5 |
| Goyal et al., 2020, EUA18 | MF (n=6742) | 511 (7,5)† | LNH (n=50) | LH (n=3), leucemia (n=7), mieloma múltiplo (n=2), próstata (n=19), pulmão (n=12), cólon (n=8) | 12,1 |
| Goyal et al., 2021, EUA19 | MF (n=7984) | 742 (9,29)† | LNH (n=99) | Melanoma (n=25), LH (n=14), câncer de pulmão (n=69), câncer de bexiga (n=20) | 15,2 |
| Liu et al., 2021, Canadá20 | MF & SS (n=5) | 5 (NA) | LLC/LLPC (n=5) | Não incluído | ND |
| Scheu et al., 2021, Alemanha21 | MF (n=72) | 8 (11) | Hematológicas (n=2) | Tumores sólidos (n=5), melanoma (n=1) | 12,5 |
| Błażewicz et al., 2021, Polônia22 | MF & SS (n=177) | 29 (16,4) | Hematológicas (n=12) | Câncer de pulmão (n=4), câncer de mama (n=2), câncer de bexiga (n=2), câncer renal (n=2), melanoma (n=2), outros (n=5) | 41,4 |
| Pileri et al., 2021, Itália23 | MF (n=NA) | 13 (ND) | Câncer de pulmão (n=4) | Câncer de próstata (n=2), câncer de pâncreas (n=2), outros (n=5) | 7,7 |
| Presente estudo, 2023, Turquia | MF (n=730) | 56 (7,1) | Hematológicas (n=36) | Câncer de mama (n=4), câncer de próstata (n=3), sarcoma de Kaposi (n=2), melanoma (n=2), câncer de células renais (n=2), câncer de tireoide (n=1), astrocitoma (n=1), câncer hepatocelular (n=1), câncer de endométrio (n=1), sarcoma fibromixoide (n=1), câncer de pulmão (n=1), adenocarcinoma gástrico (n=1) | 64,3 |
LMA, leucemia mieloide aguda; LCCT, linfoma cutâneo de células T; LMC, leucemia mieloide crônica; SGI, sistema gastrintestinal; LH, linfoma de Hodgkin; MF, micose fungoide; ND, não disponível; LNH, linfoma não Hodgkin; SS, síndrome de Sézary; LLC: leucemia linfocítica crônica; LLPC, linfoma linfocítico de pequenas células; EUA, Estados Unidos da América.
Embora a maioria das séries anteriores indique aumento na taxa de associação de NMS e MF, há inconsistências no tipo de neoplasia maligna associada além das hematológicas, e as NMS mais frequentes variaram bastante (tabela 2). Em vários desses estudos, a incidência de NMS foi comparada com a incidência esperada para aquela população, e tentou‐se obter dados mais precisos.3,4,6,8,9,11–13,15,17–19,21 Entretanto, as principais limitações dos estudos anteriores são o pequeno tamanho da amostra, o curto período de seguimento ou estudos realizados a partir de dados de centros de pesquisa oncológica ou registros de câncer que não se concentraram nas características dermatológicas da MF (tabela 2). Além disso, em um dos estudos originados em bancos de dados, afirmou‐se que não é possível investigar adequadamente a associação entre LNH e MF em virtude de possíveis classificações incorretas de MF como LNH em seu banco de dados.11 O presente estudo representa uma das maiores séries originadas de um único centro dermatológico. A maioria dos casos associados à NMS apresentava MF clássica (86,5%) seguida de MF foliculotrópica, o que foi semelhante à distribuição dos pacientes sem associação de MS na presente coorte. Embora a presente coorte principal de MF inclua quase 8% de pacientes pediátricos, todos os casos no grupo associado a NMS eram adultos. Em uma grande série, a média de idade no diagnóstico de NMS foi de 61–72 anos, enquanto foi de 51,2±17,1 anos no presente estudo.19 A predominância masculina, como na maioria dos estudos atuais, também foi observada nos presentes casos de MF associada a NMS (59,6%).9,13,16,21
Em antigo estudo conduzido por Olsen et al. em 1984, a incidência de NMS em pacientes com LCCT foi comparada com a observada na população geral, e a taxa geral de incidência de câncer em pacientes com LCCT foi de 2,4 vezes, e em pacientes brancos do sexo masculino foi de 3,3 vezes, maior que o esperado. Além disso, descobriu‐se que história de quimioterapia anterior e história familiar de neoplasia em parentes de primeiro grau eram mais comuns em pacientes com LCCT que desenvolveram NMS naquele estudo.3 Porém, não houve predomínio de nenhum tipo de NMS e nenhum deles teve origem no tecido linfoide no estudo supracitado. Pelo contrário, foi notável que a revisão da literatura citada nesse relato antigo sobre a associação de MF e NMS entre 1950 e 1980 também tenha mostrado associação entre MF e neoplasias malignas hematológicas.3 Em 544 pacientes com LCCT em um estudo baseado no Programa de Vigilância, Epidemiologia e Resultados Finais (do inglês SEER, Surveillance, Epidemiology, and End Results) durante o período de 1973 a 1983 nos EUA, NMS surgiu em 35 (6%) deles, produzindo um risco relativo (RR) significantemente elevado de 1,7, o que reflete excessos para cânceres de pulmão, cólon e LNH.4 Além disso, o risco de câncer de cólon aumentou com um seguimento mais longo, enquanto os excessos de câncer de pulmão e LNH foram limitados aos primeiros cinco anos de seguimento do LCCT no estudo mencionado acima.4 Em outro estudo conduzido na Inglaterra por Scarisbrick et al. em 1999, no qual foram incluídos 71 pacientes com Síndrome de Sézary (SS), descobriu‐se que a incidência de neoplasias malignas internas em pacientes com SS foi duas vezes maior que a relatada em pacientes de idade semelhante tratados para LH.5
Em um estudo recente com base nos dados da Fundação Italiana de Linfoma (FIL) – Força‐Tarefa de Linfoma Cutâneo, foi demonstrado que o escore médio modificado da Ferramenta de Avaliação Ponderada de Gravidade Modificada (mSWAT, do inglês Modified Severity Weighted AssessmentTool) antes e depois do diagnóstico de NMS mostrou diferença significante (p=0,0037), sugerindo que pacientes com MF e NMS podem ter pior desfecho clínico. Foi levantada a hipótese de que, ao secretar citocinas imunossupressoras ou recrutar células imunossupressoras, uma espécie de ajuda mútua entre as duas neoplasias poderia ser desencadeada.23 Além disso, antes do início da NMS, pacientes com MF precoce foram a maioria, como no presente estudo, enquanto apenas dois apresentavam doença em estágio avançado.23 Em outro estudo conduzido por Goyal et al., uma coorte de pacientes com MF foi pareada com pacientes com diagnóstico de dermatite seborreica por idade, sexo e seguimento e ambos os grupos tinham diagnóstico de neoplasia maligna preexistente na mesma proporção (10%). Naquele estudo, na análise univariada, os pacientes com MF tinham probabilidade significantemente maior de desenvolver NMS do que os pacientes com dermatite seborreica (RR de 8,1).17
Um risco aumentado de linfoma sistêmico subsequente em pacientes com MF foi relatado em vários estudos (tabela 2). Entretanto, essa associação pode indicar relação biológica ainda desconhecida entre linfomas sistêmicos e cutâneos. Ao contrário de muitos relatos, alguns estudos também investigaram a incidência geral de linfomas cutâneos primários em pacientes com neoplasias malignas hematológicas sistêmicas e descobriu‐se que, além da MF, muitos outros linfomas cutâneos primários podem ser observados nesse grupo de pacientes.20 De maneira similar, 42,3% dos pacientes com MF associada a NMS tiveram diagnóstico de papulose linfomatoide no presente estudo. Um estudo que relatou 23 pacientes com MF simultaneamente com neoplasias malignas de células B confirmou que a probabilidade dessa associação é maior do que a esperada pelo acaso.10 Em um estudo anterior na Turquia (Istambul), NMS foram diagnosticadas em 13 (9,1%) dos 143 pacientes com MF, representando taxa mais elevada do que a observada no presente estudo (7,1%). Notavelmente, sete de 13 desses pacientes (53.8%) apresentavam neoplasias malignas hematológicas, semelhante ao resultado do presente estudo (64,3%).14 No presente estudo, a doença em estágio inicial (IA‐IIA) foi observada em 80,7% dos pacientes com MF, semelhante às taxas relatadas por Cengiz et al.14 Diferentemente, foi sugerido que a doença em estágio avançado (estágio IIB ou superior) tivesse probabilidade significantemente maior de desenvolver NMS em algumas séries, o que não foi confirmado pelo presente estudo.17 Hodak et al. compararam uma coorte de base institucional, incluindo 343 pacientes com MF com 846 controles pareados por idade e sexo e um total de 683 pacientes com MF na coorte de base populacional com 1.700 controles pareados por idade e sexo em seu estudo para examinar a associação entre MF e outras neoplasias malignas.11 Nesse estudo em Israel, a proporção do risco de qualquer câncer em pacientes com MF tanto nas coortes populacionais (13%) quanto nas coortes institucionais (15%) foi maior do que nos grupos controle (10% e 9%, respectivamente). Além disso, descobriu‐se que MF e LH, leucemia aguda e câncer de pulmão estavam fortemente associados entre si.11 Em outro estudo realizado nos EUA, incluindo 4.229 pacientes com MF/SS de registros de câncer SEER‐13 diagnosticados entre 1994 e 2014, um total de 550 (13%) pacientes desenvolveram NMS com risco geral aumentado de 26% em comparação com a população geral correspondente.16 Nesse estudo, foi relatado que houve risco significantemente aumentado de LH e LNH em pacientes do sexo masculino, como no presente estudo, e também risco aumentado de melanoma, LLC, LH, LNH e câncer de pulmão em pacientes do sexo feminino.16 Amber et al. observaram que o risco de NMS é maior no primeiro ano após o diagnóstico de MF/SS, com risco aumentado de LH e LNH em pacientes com idade>60 e entre 20–39 anos, respectivamente. Altas taxas de neoplasias malignas hematológicas nesses estudos recentes são importantes evidências que apoiam essa associação significante. Em uma grande coorte de pacientes com neoplasias de células T, NMS se desenvolveram em 10% dos 4.774 pacientes com MF e síndrome de Sézary, e sugeriu‐se que o risco aumentado de câncer de pulmão indica alguma relação biológica dessas doenças, incluindo deleções cromossômicas.15 No presente estudo, nenhuma das neoplasias de órgãos sólidos apresentou aumento acentuado. Notavelmente, na maioria dos pacientes com LH associado, a MF desenvolveu‐se posteriormente, enquanto o LNH foi diagnosticado principalmente durante o período de seguimento dos pacientes com MF. Embora tenha sido postulado anteriormente que vigilância imunológica deficiente, especialmente em estágios avançados de MF, resulta em diminuição da capacidade do organismo de identificar e eliminar células neoplásicas, não sendo, portanto, capaz de evitar o segundo câncer, a maioria dos pacientes do presente estudo estava em estágio inicial, para os quais imunossupressão não é esperada.17 Pacientes com MF em estágio inicial são tratados geralmente com opções direcionadas à pele, incluindo corticosteroides tópicos ou fototerapia, que não foram associados a risco aumentado de neoplasias malignas.2,25 Entretanto, um dos casos de melanoma do presente estudo recebeu terapia de longo prazo com PUVA e ambos os casos com sarcoma de Kaposi usaram corticosteroides tópicos, e podem ter sido desencadeados pela terapia para MF.26 O sarcoma fibromixoide em um dos pacientes do presente estudo não foi relatado anteriormente em associação com MF (tabela 2).
As principais limitações do presente estudo são sua natureza retrospectiva e a realização em um único centro dermatológico.
ConclusãoApesar da presença de viés de confusão em alguns estudos, os dados da literatura apoiam risco aumentado de desenvolver NMS em pacientes com MF. Na presente coorte, a prevalência geral de neoplasias malignas não foi mais alta do que em outros estudos, mas a taxa de neoplasias malignas hematológicas estava relativamente aumentada, o que enfatiza o risco de desenvolvimento desse tipo de neoplasia em pacientes com MF. Além disso, os pacientes da presente coorte não apresentaram diferença significante em termos de subtipo e estágio de MF em comparação com outros grupos de estudo com NMS. Embora não haja evidências suficientes para sugerir a investigação de rotina para NMS em todos os pacientes com MF, cuidados extras devem ser tomados em relação a outras doenças hematológicas se houver apresentação clínica suspeita, achado laboratorial ou anormalidade na imagem radiológica.
Suporte financeiroNenhum.
Contribuição dos autoresTugba Atci: Concepção e planejamento do estudo, obtenção de dados, ou análise e interpretação dos dados, análise estatística, redação do manuscrito ou revisão crítica de conteúdo intelectual importante, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica da literatura, aprovação da versão final do manuscrito
Dilay Yerlioğlu Ak: Obtenção de dados, ou análise e interpretação dos dados, análise estatística, redação do manuscrito ou revisão crítica de conteúdo intelectual importante, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ ou terapêutica de casos estudados, revisão crítica da literatura, aprovação da versão final do manuscrito
Can Baykal: Concepção e planejamento do estudo, obtenção de dados ou análise e interpretação dos dados, análise estatística, redação do manuscrito ou revisão crítica de conteúdo intelectual importante, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica da literatura, aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Atci T, Yerlioğlu Ak D, Baikal C. Evaluation of secondary malignancies in a large series of mycosis fungoides. An Bras Dermatol. 2024;99:370–9.
Trabalho realizado na Faculdade de Medicina de Istambul, Istanbul University, Istambul, Turquia.