Vários tratamentos estão disponíveis para a pele com fotodano avançado, que se caracteriza pela presença de queratoses actínicas (QAs).
ObjetivosAvaliar a eficácia do uso de protetor solar com fotoliase em comparação ao protetor solar comum, bem como comparar a combinação de formulação tópica de antioxidantes versus placebo no tratamento do fotodano avançado.
MétodosEste foi um ensaio clínico fatorial randomizado, duplo‐cego. Os participantes com QAs nos antebraços foram randomizados para aplicar protetor solar (PS) comum ou protetor solar com fotoliase (PS + F) em ambos os antebraços durante o dia. Um dos antebraços em cada grupo foi randomizado novamente para receber antioxidantes tópicos (AOx), e o outro antebraço recebeu creme placebo (ambos para aplicação noturna). Os quatro grupos foram PS/AOx, PS/placebo, PS + F/AOx e PS + F/placebo. A duração do tratamento foi de oito semanas. Os desfechos primários foram eliminação total de QAs e redução da escala de fotoenvelhecimento do antebraço (FPS) e do escore de gravidade de QA. Os desfechos secundários foram redução na contagem de QAs, a taxa de eliminação parcial e a segurança.
ResultadosQuarenta participantes (80 antebraços) foram incluídos. Todos os grupos mostraram melhoras significativas nos resultados na oitava semana. Não houve diferenças significantes entre PS e PS + F para nenhum dos resultados. O uso de AOx levou à redução significante na contagem de QAs (22%; p < 0,05). Eliminação parcial foi obtida em 18 (47,4%) antebraços tratados com AOx e em nove (23,7%) tratados com placebo (p < 0,05). Todos os grupos reduziram o escore FPS, sem diferenças significantes entre eles.
Limitações do estudoO curto período de seguimento e a ausência de reavaliação livre de tratamento foram limitações do presente estudo.
ConclusõesNão há diferença no tratamento do fotodano avançado da pele ao comparar o uso de protetor solar com fotoliase e protetor solar comum; os antioxidantes tópicos tiveram mais eficácia na redução da contagem de QAs do que o placebo.
A exposição da pele à radiação ultravioleta (RUV) promove o fotoenvelhecimento e é o principal fator de risco para o desenvolvimento de queratoses actínicas (QAs).1,2 O espectro UVA promove a formação de espécies reativas de oxigênio (EROs), causando estresse oxidativo e danos ao DNA dos ceratinócitos.2–4 O espectro UVB é responsável pela formação de dímeros de pirimidina no DNA dos ceratinócitos – os principais são os fotoprodutos dímero de pirimidina ciclobutano (DPC) e pirimidina‐pirimidona (6‐4PP).3
O diagnóstico e o tratamento de QAs são importantes porque apresentam risco de progressão para carcinoma espinocelular (CEC).5,6 Geralmente, múltiplas QAs ocorrem na mesma área da pele com fotodano, o que acumula alterações no material genético dos ceratinócitos e define o campo de cancerização cutâneo (CCC).7
Recentemente, a fotoliase, uma enzima monomérica não encontrada nas células de mamíferos placentários, surgiu como alternativa para o tratamento de QA e CCC.8–10 A enzima tem a capacidade de quebrar os dímeros DPC e 6‐4PP através da luz visível, um processo denominado fotorreativação.11 Puig et al. publicaram um artigo de revisão que concluiu que há evidências para apoiar os efeitos benéficos do tratamento com fotoliase tópica em QA e CCC.2
Considerando os danos indiretos causados pela RUV, por meio da formação de EROs, foram iniciados estudos com agentes antioxidantes (AOx). A vitamina C (ácido ascórbico) é o AOx solúvel em água mais prevalente na epiderme.12 Ele neutraliza os radicais livres e EROs nos compartimentos aquosos da pele e desempenha papel importante na regeneração da vitamina E (tocoferol).13 A vitamina E é um AOx solúvel em gordura presente na camada córnea, produzida nas glândulas sebáceas, com capacidade de proteger a membrana celular do estresse oxidativo.12 Murray et al. demonstraram que a combinação de três AOx (ácido L‐ascórbico 15%, alfa‐tocoferol 1% e ácido ferúlico 0,5%), quando comparada ao placebo (veículo), apresentou efeito fotoprotetor ao reduzir o eritema induzido pela RUV, reduzindo significantemente a formação de “sunburns cells”, além de reduzir a expressão de p53 e a formação de dímeros de timina.14
A maioria dos estudos com fórmulas antioxidantes se concentra em suas propriedades fotoprotetoras. Porém, nenhum estudo avaliou sua eficácia no tratamento das QAs. Além disso, a combinação de antioxidantes e fotoliase não foi descrita na literatura até agora.
O objetivo deste estudo foi avaliar a eficácia do uso de protetor solar com fotoliase em comparação ao protetor solar comum, bem como comparar a combinação da formulação tópica de antioxidantes versus placebo no tratamento de fotodano avançado, caracterizado pela presença de QAs e CCC nos antebraços, após intervalo de oito semanas.
MétodosTipo de estudoEste foi um ensaio clínico randomizado (ECR) controlado, com desenho fatorial aberto para protetor solar comum e protetor solar contendo fotoliase e duplo‐cego para antioxidante tópico e creme placebo. O estudo foi aprovado pelo Comitê de Ética da instituição (n° 2.529.697) e foi registrado no Registro Brasileiro de Ensaios Clínicos (n° RBR‐957zf2). A alocação foi feita na proporção de 1:1.
ParticipantesParticipantes de ambos os sexos, com idade entre 60 e 90 anos, com diagnóstico clínico de QA em antebraço (três a dez lesões em cada antebraço) e que não tinham sido submetidos a tratamento para QAs (exceto com protetor solar) nos últimos seis meses foram incluídos após assinatura do termo de consentimento livre e esclarecido.
Os critérios de exclusão foram os seguintes: outras dermatoses extensas afetando os antebraços; hipersensibilidade ou alergia a qualquer uma das substâncias em estudo; uso de qualquer substância imunossupressora sistêmica ou tópica, retinoides orais ou outros tratamentos locais (corticosteroides, anti‐inflamatórios, retinoides); imunocomprometimento; e distúrbios de coagulação.
IntervençõesOs participantes foram randomizados para receber tratamento com protetor solar com fator de proteção solar 99 (FPS 99) contendo fotoliase (PS + F) em lipossomas multilamelares e usando octocrileno, dióxido de titânio, avobenzona e Tinosorb‐S, para ser utilizado duas vezes ao dia com aplicação em ambos os antebraços, ou protetor solar comum com FPS 99 (PS) utilizando como protetores químicos Tinosorb‐M, Tinosorb‐S, avobenzona, octil‐triazona e 4‐metilbenzilideno cânfora, com o mesmo FPS do produto contendo fotoliase, também para uso duas vezes ao dia em ambos os antebraços. Essas intervenções não foram realizadas às cegas para os participantes e pesquisadores, pois não havia possibilidade de ocultar as apresentações dos produtos utilizados.
Os antebraços dos participantes de cada um dos grupos foram randomizados para aplicar creme hidratante (placebo) em um antebraço e creme composto por agentes antioxidantes formulados com 15% de ácido L‐ascórbico, 1% de alfa‐tocoferol e 0,5% de ácido ferúlico no outro antebraço (AOx), ambos aplicados uma vez ao dia. Para essas intervenções noturnas, houve cegamento tanto para os participantes quanto para os pesquisadores.
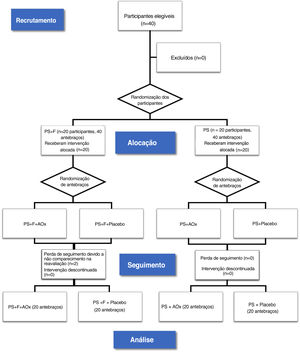
Assim, houve a formação de quatro grupos compostos por antebraços: protetor solar comum e antioxidante tópico (PS/AOx), protetor solar comum e placebo (PS/placebo), protetor solar contendo fotoliase e antioxidante tópico (PS + F/AOx), e protetor solar contendo fotoliase e placebo (PS + F/placebo) – figura 1. O placebo e o AOx foram manipulados em uma emulsão trifásica, de cor branca e inodora. Ambos os produtos foram acondicionados em embalagens a vácuo idênticas, o que evitou a oxidação do ácido ascórbico contido em uma das formulações. As embalagens foram rotuladas apenas com os tópicos de identificação 1 e 2. Após essa randomização final, as embalagens foram identificadas com as letras “D” para aplicação do produto no antebraço direito e “E” para aplicação no antebraço esquerdo, para que o paciente pudesse identificar em qual lado aplicar cada produto. Para cada paciente, os tratamentos propostos duraram oito semanas. Houve padronização das áreas para contagem e avaliação de lesões de QA e CCC, e isso se limitou a uma linha que cruza as articulações metacarpofalangianas como limite distal, e uma linha que se estendia da fossa antecubital ao epicôndilo lateral dos antebraços como limite proximal.
DesfechosOs desfechos primários foram a eliminação total das QAs, redução na atividade de CCC avaliada pela melhora na escala de fotoenvelhecimento do antebraço (FPS, do inglês forearm photoaging scale)1 e a redução no escore de gravidade de QA (AKSS, do inglês actinic queratosis severity score)15 após oito semanas de tratamento.
Os desfechos secundários foram redução na contagem de QAs, taxa de eliminação parcial (redução de 50% ou mais), efeitos adversos relacionados ao tratamento, tolerabilidade e aparecimento de tumores cutâneos não melanomas.
Cálculo da amostraO tamanho da amostra foi calculado para detectar redução na diferença de mais de 10% entre os grupos e desvio padrão equivalente das diferenças. Adotou‐se poder de 0,9, alfa de 0,05 e estimativa de abandono de 10%, resultando em 40 pacientes (80 antebraços).
Randomização e avaliaçõesOs participantes e antebraços foram randomizados em blocos utilizando uma simulação de computador. Após a randomização computacional, as combinações de tratamentos geradas foram separadas individualmente em envelopes lacrados. Os envelopes foram mantidos com o pesquisador e, no momento da inclusão, foi selecionado aleatoriamente um envelope para orientar o tratamento do paciente.
Os participantes foram avaliados em dois momentos: T0, inclusão, randomização, avaliação clínica e início dos tratamentos; T60, avaliação clínica, avaliação de efeitos adversos e tolerabilidade.
No momento da inclusão, as QAs foram contadas e marcadas com uma caneta para cada antebraço, respeitando os limites anatômicos considerados acima; a ficha de avaliação foi preenchida e a escala de fotoenvelhecimento do antebraço e o escore de gravidade da QAs do antebraço foram aplicados.
A escala FPS considera o número de QAs superficiais e hipertróficas, quantidade e gravidade das rugas, lentiginose solar, púrpura visível, cicatrizes atróficas em formato estrelado, elastose e perda de elasticidade. Todos os parâmetros somados formam uma escala que varia de 0 a 192, e valores totais mais altos indicam maior fotodano.1
O escore AKSS considera o número de lesões e as seguintes características: grau de eritema, hiperceratose, infiltração e diâmetro (medido em milímetros) das QAs. Cada um dos critérios é graduado de 0 a 3. As lesões foram caracterizadas individualmente, e os valores foram somados para obter o total na área estudada. Quanto maior o valor total, maior a gravidade das QAs e CCC.15 Esse escore de gravidade foi publicado e validado para QAs e CCC da cabeça. Recentemente, esse escore foi aplicado à avaliação das QAs dos antebraços, e sua validação está em andamento.16
As avaliações dos pacientes em ambos os momentos foram realizadas pelo mesmo pesquisador, que desconhecia se o tratamento tinha utilizado antioxidantes tópicos ou placebo. Os pacientes também não sabiam qual fórmula era o placebo e qual era o antioxidante tópico. Ao final do estudo, a alocação do grupo foi revelada.
Análise estatísticaTodos os participantes incluídos no estudo e randomizados faziam parte da população com intenção de tratar (ITT, do inglês intention to treat). A análise de dados foi realizada para a população ITT utilizando um modelo linear generalizado de efeitos mistos que lida com os dados ausentes em sua estrutura analítica.17
As variáveis categóricas foram apresentadas como números absolutos e porcentagens. As variáveis contínuas foram avaliadas quanto à normalidade pelo teste de Shapiro‐Wilk e representadas por médias e desvios‐padrão, ou medianas e quartis (p25‐p75).
O número de QAs, a escala de FPS e o escore de gravidade de QAs do antebraço foram comparados por tempo e grupos (ao longo do tempo) utilizando o modelo linear generalizado de efeitos mistos, estrutura de covariância robusta, matriz de covariância autorregressiva tipo 1, comparação post‐hoc com a Comparação de Sidak e ajuste de probabilidade binomial ou gama negativo, quando indicado.
O tamanho do efeito foi calculado como a diferença nas médias de cada variável em T60 e T0 e o intervalo de confiança pela técnica de bootstrap com 1.000 reamostragens.
Os dados foram analisados em IBM SPSS 25v. A significância foi fixada em p < 0,05.
ResultadosEntre janeiro de 2019 e janeiro de 2020, 40 participantes foram considerados elegíveis e randomizados para o estudo. Vinte antebraços constituíram parte do grupo PS + F/AOx e do grupo PS + F/placebo. Vinte antebraços constituíram parte dos grupos PS/AOx e PS/placebo. Houve duas desistências no grupo PS + F, não associadas às intervenções, pois os pacientes não retornaram para reavaliação na data agendada (fig. 1).
Os principais dados clínicos e demográficos dos 40 participantes no início do estudo (T0) são apresentados na tabela 1. Não houve diferença significativa entre os grupos para nenhuma das variáveis.
Principais características demográficas dos participantes na inclusão (T0) de acordo com o grupo randomizado
| Variável | PS | PS+F | Total | p‐valor |
|---|---|---|---|---|
| Sexo – n (%) | 0,519 | |||
| Masculino | 9 (45) | 7 (35) | 16 (40) | |
| Feminino | 11 (55) | 13 (65) | 24 (60) | |
| Fototipo – n (%) | 0,08 | |||
| I | ‐ (‐) | 1 (5) | 1 (3) | |
| II | 9 (45) | 13 (65) | 22 (55) | |
| III | 11 (55) | 6 (30) | 17 (43) | |
| Idade (anos)a | 73 (7) | 73 (9) | 73 (8) | 0,938 |
| Escolaridade – n (%) | 0,742 | |||
| Nenhuma | 2 (10) | 2 (10) | 4 (10) | |
| Ensino Fundamental | 15 (75) | 16 (80) | 31 (78) | |
| Ensino Médio | 3 (15) | 2 (10) | 5 (13) | |
| FPSb | 105 (93–114) | 110 (78–118) | 107 (91–116) | 0,391 |
| Contagem de QAs (T0)b | 7 (6–9) | 7 (6–8) | 7 (6–9) | 0,321 |
| AKSS (T0)b | 76 (46–100) | 70 (52–91) | 72 (51–95) | 0,459 |
PS, grupo protetor solar; PS+F, grupo protetor solar + fotoliase; QAs, queratoses actínicas; FPS, Forearms Photoageing Scale; AKSS, AK Severity Score nos antebraços.
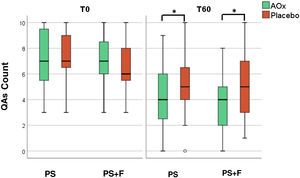
Não houve diferença significativa nos desfechos primários e secundários entre os grupos de protetor solar comum e protetor solar contendo fotoliase (tabela 2). A eliminação total de QAs foi alcançada em três antebraços tratados com antioxidante tópico (7,9%; IC 95% 2,6‐13,2%) e um antebraço tratado com placebo (2,6%; IC 95% 0‐7,9%), sem diferença estatística (p = 0,997). Eliminação parcial foi alcançada em 18 antebraços tratados com antioxidante tópico (47,4%; IC 95% 34,2‐60,5%) e nove antebraços tratados com placebo (23,7%; IC 95% 13,2‐34,2%; p = 0,018).
Principais desfechos clínicos decorrentes dos tratamentos
| PS | PS+F | |||
|---|---|---|---|---|
| AOx | Placebo | AOx | Placebo | |
| T0 | ||||
| Contagem de QAsc | 7 (6‐10) | 7 (7‐9) | 7 (6‐9) | 6 (6‐8) |
| FPSc | 105 (94‐114) | 105 (94‐114) | 113 (73‐117) | 108 (78‐117) |
| AKSSc | 81 (46‐95) | 69 (46‐111) | 70 (53‐92) | 70 (52‐89) |
| T60 | ||||
| Eliminação total d | 2 (10) | 1 (5) | 1 (5) | – (–) |
| FPSc | 79 (66‐93)a | 78 (68‐93)a | 81 (68‐94)a | 85 (74‐95)a |
| AKSSc | 34 (13‐51)a | 38 (18‐62)a | 20 (11‐30)a | 32 (22‐43)a |
| Contagem de QAsc | 4 (3‐6)a,b | 5 (4‐7)a | 4 (2‐5)a,b | 5 (3‐7) |
| Eliminação parciald | 8 (40)b | 5 (25) | 10 (50)b | 4 (20) |
PS, grupo protetor solar normal; PS+F, grupo protetor solar + fotoliase; AOx, grupo com antioxidante tópico; FPS, Forearms Photoageing Scale; AKSS, AK Severity Score nos antebraços.
Houve redução na contagem de QAs em todos os grupos ao longo do tempo (p < 0,05). Além disso, houve redução na contagem de QAs nos grupos que utilizaram antioxidante tópico (PS/AOx e PS + F/AOx) em relação aos que utilizaram placebo (p < 0,05; tabela 2 e fig. 2).
O escore na escala FPS diminuiu para todos os grupos ao longo do tempo (p < 0,05), independentemente do grupo de tratamento (tabela 2). Não houve diferença estatisticamente significativa entre as outras intervenções para esse desfecho.
Da mesma maneira, houve redução do escore AKSS para todos os grupos ao longo do tempo (p < 0,05), sem superioridade para nenhum tratamento (tabela 2).
Os tamanhos de efeito para os desfechos são mostrados na tabela 3. A diferença nas médias de AKSS e eliminação parcial foi maior nos grupos que usaram protetor solar com fotoliase e antioxidante tópico (PS + F/AOx) em comparação com os grupos que utilizaram placebo.
Diferença de percentil (T60‐T0) nos desfechos estudados (médias e intervalos de confiança de 95%)
| PS | PS+F | Total | |||
|---|---|---|---|---|---|
| AOx | Placebo | AOx | Placebo | ||
| Eliminação totala | 10 (0–25) | 5 (0–15) | 6 (0–17) | – (–) | 5 (1–11) |
| FPSb | 22 (15–29) | 20 (14–26) | 22 (12–31) | 17 (8–26) | 20 (17–24) |
| AKSSb | 45 (32–59) | 32 (21–42) | 53 (42–65)c | 34 (27–41) | 41 (35–47) |
| Contagem de QAsb | 2.9 (1.8–4.0) | 2.0 (1.2–2.8) | 3.6 (2.6–4.6) | 1.1 (0.4–1.8) | 2.4 (1.9–2.9) |
| Eliminação parciala | 40 (25–60) | 25 (10–40) | 56 (39–72)c | 22 (11–33) | 36 (26–45) |
PS, grupo protetor solar normal; PS+F, grupo protetor solar + fotoliase; AOx, grupo com antioxidante tópico; FPS, Forearms Photoageing Scale; AKSS, AK Severity Score nos antebraços.
Prurido foi descrito com o uso de antioxidante tópico e placebo por um participante; outro indivíduo descreveu prurido com o uso de protetor solar contendo fotoliase. Não houve relatos de eritema, edema, ulceração ou bolhas, e os tratamentos propostos foram bem tolerados. Houve caso de carcinoma basocelular (CBC) no antebraço esquerdo de um dos participantes, onde ele estava aplicando protetor solar contendo fotoliase e antioxidante tópico. Outro participante desenvolveu carcinoma espinocelular (CEC) no antebraço esquerdo, onde estava aplicando protetor solar comum e antioxidante tópico.
DiscussãoNão foram encontradas diferenças no tratamento de fotodano avançado e CCC na comparação entre o uso de protetor solar com fotoliase e protetor solar comum sem fotoliase. No entanto, o uso de fórmula antioxidante proporcionou redução na contagem de QAs, o que reflete redução na atividade do CCC. Embora o antioxidante tópico seja frequentemente utilizado como um produto antienvelhecimento, o presente estudo mostrou melhora na contagem de QAs, sem mudança significativa em outros aspectos da escala de fotoenvelhecimento do antebraço.
Quando as intervenções foram analisadas ao longo do tempo, todos os parâmetros mostraram melhoras estatisticamente significantes. A redução ou resolução das QAs pode ocorrer em até 21% dos pacientes em um ano.18 No presente ensaio clínico, todos os participantes utilizaram pelo menos protetor solar comum, com redução ou resolução de 38,7% nas QAs nos antebraços. Além disso, em duas publicações foram relatadas que o uso regular de protetor solar reduziu a contagem de QAs em até 25% em pacientes imunocompetentes e 50% em pacientes transplantados com órgãos sólidos.19,20
Puig et al. analisaram as evidências disponíveis nos últimos dez anos sobre o uso de protetor solar contendo fotoliase. Os autores analisaram 11 estudos, totalizando 228 participantes, dos quais apenas três eram ECRs, e concluíram que havia evidências para apoiar o uso de fotoliase para o tratamento de QAs e CCC.2
Um dos ensaios clínicos foi o de Moscarela et al., que comparou o uso de protetor solar com fotoliase e protetor solar comum com FPS 50 em pacientes com quatro ou mais QAs na face e no couro cabeludo. O estudo incluiu 50 participantes, mas teve 14 desistências, resultando em 17 participantes que utilizaram protetor solar com fotoliase e 19 que usaram protetor solar comum com FPS 50. Após seis meses de seguimento, houve redução na contagem de QAs em ambos os grupos, o que não obteve significância estatística. Ao avaliar o subgrupo de participantes com até 10 QAs (n = 20), o grupo de protetor solar com fotoliase mostrou‐se superior na redução da contagem de QAs. Nesse subgrupo, 14% dos participantes que utilizaram protetor solar com fotoliase apresentaram novas lesões em comparação com 54% daqueles que usaram protetor solar comum com FPS 50.21 No presente estudo, apenas um paciente no grupo de protetor solar com fotoliase apresentou novas QAs, contra nenhum no grupo de protetor solar comum.
Eibenschutz et al. conduziram um ensaio clínico com 30 participantes para avaliar a eficácia do protetor solar com fotoliase versus protetor solar comum no tratamento de QAs e CCC da face e do couro cabeludo após sessão de terapia fotodinâmica com metil‐aminolevulinato (MAL‐PDT). Aumento no número de QAs foi observado após nove meses de tratamento nos participantes que utilizaram protetor solar comum, enquanto houve redução nas QAs nos participantes que utilizaram protetor solar com fotoliase (p = 0,001).22
Puig et al. desenvolveram um estudo prospectivo, controlado e não randomizado com 13 participantes com QAs em áreas expostas para avaliar a eficácia do protetor solar com fotoliase versus protetor solar comum por quatro semanas no tratamento de QAs e CCC. Os grupos eram formados por nove participantes utilizando protetor solar com fotoliase e três utilizando protetor solar comum. O estudo analisou os seguintes desfechos: melhora clínica, dermatoscopia, imuno‐histoquímica e aspecto à microscopia confocal. Houve melhora estatisticamente significante em todos os desfechos estudados no grupo que usou protetor solar com fotoliase, mas não houve melhora no grupo que usou protetor solar comum. Entretanto, esse foi um estudo não randomizado, com baixo número de participantes, e a contagem de QAs não foi analisada como desfecho, além de apresentar distribuição desproporcional entre os grupos, o que compromete a validade dos dados.11
O presente ECR não mostrou eficácia superior do protetor solar contendo fotoliase no tratamento de QAs no antebraço em pacientes imunocompetentes, o que contradiz os resultados de estudos anteriores.
O uso de substâncias antioxidantes associadas ao protetor solar tem se tornado frequente, uma vez que vários estudos têm demonstrado efeito fotoprotetor ao reduzir o eritema induzido pela RUV, diminuindo a expressão de p53, diminuindo a formação de “sunburns cells” e diminuindo a expressão de citocinas imunossupressoras.14
A vitamina C neutraliza os radicais livres nos compartimentos aquosos da pele, além de desempenhar um papel importante na regeneração da vitamina E.12,13 A principal função da vitamina E é proteger as membranas celulares do estresse oxidativo.12
A associação de ácido L‐ascórbico 15% com alfa‐tocoferol 1% demonstrou que eles têm efeito sinérgico na pele. Quando o alfa‐tocoferol neutraliza o estresse oxidativo nos lípides, seus produtos oxidados podem ser regenerados pelo ácido L‐ascórbico. Essa interação ajuda a renovar a proteção antioxidante nos tecidos. A formulação contendo os dois produtos dobrou a proteção UV para a pele quando comparada ao ácido L‐ascórbico isoladamente.23,24 Lin et al. demonstraram que a adição de ácido ferúlico a 0,5% aumentou tanto a estabilidade da fórmula quanto dobrou a proteção UV para a pele. É postulado que o ácido ferúlico protege o ácido L‐ascórbico e o alfa‐tocoferol, sofrendo oxidação antes dos outros na fórmula.25
Não há estudos avaliando o uso de antioxidantes tópicos para o tratamento de QAs e CCC. O presente estudo demonstrou efeito benéfico e seguro da combinação de ácido L‐ascórbico 15%, alfa‐tocoferol 1% e ácido ferúlico 0,5% na redução do número de QAs, consequentemente controlando a atividade do CCC.
Uma das limitações do presente estudo foi a ausência da comparação direta entre os grupos utilizando protetor solar comum e protetor solar com fotoliase, tornando essa comparação inferior à comparação entre antioxidante tópico versus placebo. Além disso, o estudo incluiu apenas pacientes com contagens de QAs entre três e dez, e os resultados podem não se aplicar aos pacientes com maior número de lesões, bem como em pacientes imunossuprimidos.
Reconhecemos que o intervalo de seguimento de 60 dias pode estar relacionado fracos resultados apresentados no grupo que utilizou a fotoliase. Talvez para obter melhores resultados, seu uso deva ser prolongado. No entanto, mais estudos devem ser realizados para confirmar essa hipótese. Além disso, como demonstrado por Eibenschutz et al.,22 é possível que a fotoliase tenha a melhor indicação para evitar a recorrência de QAs tratadas por outros métodos, sendo uma alternativa para estabilizar, mas não tratar o CCC.
Também acredita‐se que o uso prolongado de antioxidantes tópicos possa melhorar outros sinais de fotoenvelhecimento, uma vez que estudos mostraram que a redução na transcrição da metaloproteinase‐1da matriz inibe a formação de dímeros de timina, reduzindo o processo de degradação do colágeno e a carcinogênese.26
O ponto forte deste estudo foi a possibilidade de avaliar os efeitos de três intervenções em um desenho de estudo fatorial, em um grupo de pacientes imunocompetentes que frequentemente apresentam QAs em antebraço.
ConclusõesO protetor solar (FPS 99) contendo fotoliase não foi superior ao protetor solar comum (FPS 99) nos desfechos estudados, após oito semanas. O uso da fórmula antioxidante tópica é seguro, tolerável e também demonstrou maior eficácia na redução da contagem de QAs em antebraços quando associada ao protetor solar comum ou protetor solar com fotoliase.
Suporte financeiroEste estudo recebeu suporte financeiro do Fundo de Amparo à Dermatologia do Estado de São Paulo ‐ Sebastião Sampaio (FUNADERSP), n° 73‐2018.
Contribuições dos autoresBruno Augusto Alvares: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Anna Carolina Miolla: Redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e /ou terapêutica dos casos estudados.
Juliano Vilaverde Schimitt: Concepção e planejamento do estudo; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e / ou terapêutica de casos estudados; revisão crítica da literatura.
Helio Amante Miot: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e / ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Luciana Patricia Fernandes Abbade: Concepção e planejamento do estudo; obtenção dos dados, ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e /ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Alvares BA, Miola AC, Schmitt JV, Miot HA, Abbade LP. Efficacy of sunscreen with photolyase or regular sunscreen associated with topical antioxidants in treating advanced photodamage and cutaneous field cancerization: a randomized clinical trial. An Bras Dermatol. 2022;97:157–65.
Trabalho realizado no Ambulatório do Hospital das Clínicas de Botucatu, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.
Este estudo foi registrado no Registro Brasileiro de Ensaios Clínicos (REBEC no. RBR‐957zf2).