O eritema nodoso hansênico é uma reação imunológica grave que complica o curso normal da hanseníase multibacilar. Há um aumento da ativação das células T no eritema nodoso hansênico. As modalidades de tratamento disponíveis até o momento para o manejo são esteroides sistêmicos, talidomida, metotrexato, ciclofosfamida, azatioprina, minociclina e apremilaste, mas nenhum deles é promissor e seguro. Mycobacterium indicus pranii é uma micobactéria atípica com fortes propriedades imunomoduladoras. A vacina para esta micobactéria demonstrou ter efeitos imunoterapêuticos e imunoprofiláticos em pacientes com hanseníase multibacilar. Este relato de caso descreve um paciente com eritema nodoso hansênico recalcitrante crônico que respondeu à vacina para Mycobacterium indicus pranii sem quaisquer efeitos adversos, sugerindo seu papel como nova opção terapêutica nessa reação.
A hanseníase é uma doença infecciosa causada por Mycobacterium leprae. A doença afeta os nervos periféricos, a pele, a mucosa do trato respiratório superior e os olhos. O curso indolente da doença é interrompido por surtos agudos denominados reações hansênicas (reação reversa e eritema nodoso hansênico [ENH]). O ENH é caracterizado por conjuntos de pápulas e nódulos doloridos, febre alta e outros sintomas constitucionais. O tratamento do ENH recalcitrante crônico é difícil e geralmente requer agentes sistêmicos como corticosteroides, talidomida, clofazimina, minociclina ou imunomoduladores, sozinhos ou em combinação, por muitos meses.1 A vacina para Mycobacterium indicus pranii (MIP) demonstrou ter efeitos imunoterapêuticos e imunoprofiláticos em pacientes com hanseníase multibacilar.2 Ela também reduziu a carga bacilar, melhorou as lesões a nível imuno‐histológico, levou à eliminação completa do granuloma e reduziu a duração da terapia multidrogas (TMD) em pacientes com hanseníase.
Essa vacina não foi amplamente testada em pacientes com reações hansênicas, pois havia o risco de precipitar uma reação grave após a vacinação. Nesse caso, a vacina foi testada em um paciente com ENH que era dependente de esteroides e refratário à talidomida e outros medicamentos de segunda linha, e um resultado muito satisfatório foi verificado com uma única dose da vacina para MIP.
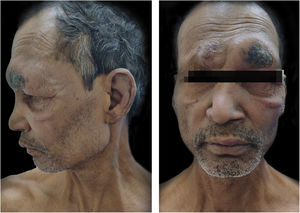
Relato do casoUm homem de 55 anos procurou o ambulatório de dermatologia com história de hanseníase, para a qual fazia uso de TMD havia um ano e meio. Nos últimos 8 meses, o paciente vinha desenvolvendo febre com nódulos doloridos e evanescentes por todo o corpo. O exame físico geral também revelou infiltração difusa com madarose supraciliar (fig. 1). O exame sensorial mostrou padrão de hipoestesia com distribuição em luva e meia. O exame neurológico mostrou espessamento leve simétrico bilateral dos nervos ulnar e fibular comum, mas nenhuma sensibilidade, e a força nos músculos das mãos e dos pés estava dentro do limite normal. O paciente foi diagnosticado como um caso de hanseníase virchowiana com ENH. As investigações de rotina estavam dentro dos limites normais, exceto leucocitose e índice bacteriológico (IB) 5+. De acordo com a escala de gravidade do Erythema Nodosum Leprosum International Study (ENLIST), dor=3, febre=3, lesões=2, inflamação=3, extensão da lesão=2, edema periférico=1, dor óssea=1, artrite=1, linfadenopatia=0 e neurite=0, o escore foi 16.3
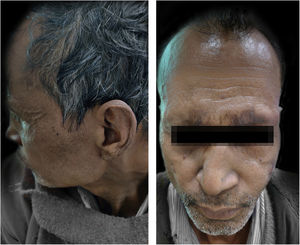
O paciente iniciou tratamento com talidomida 300mg/dia, MB‐TMD com 300mg/dia de clofazimina, metilprednisolona 32mg e analgésicos para alívio da dor. Após duas semanas, o paciente começou a desenvolver neurite ulnar com aumento de dormência tanto nas mãos quanto nos pés. Por isso, a talidomida foi interrompida e minociclina 100mg foi iniciada. Entretanto, não houve melhora no ENH após um mês. Em seguida, o paciente também começou a receber metotrexato oral 15mg/semana. Mesmo após quatro semanas de tratamento com uma combinação de metilprednisolona, metotrexato, minociclina, analgésico e MB‐TMD, a condição do paciente permaneceu a mesma, com o aparecimento frequente de lesões. Em seguida, todos os medicamentos foram interrompidos, exceto a TMD e os analgésicos, e a vacinação MIP foi planejada após obtermos o consentimento. O paciente recebeu a vacina para MIP, 0,1mL por via intradérmica em ambos os braços (ao redor da inserção do músculo deltoide). O paciente não se queixou de nenhum efeito colateral decorrente da vacinação. A condição do paciente melhorou muito após duas semanas (fig. 2). Posteriormente, ele recebeu TMD potencializada com minociclina e analgésicos pelos seis meses seguintes. No seguimento posterior (após duração total do tratamento de dois anos e três meses), o paciente foi avaliado clinicamente e o IB foi reduzido para 4+sem recorrência.
DiscussãoA OMS lançou uma “Estratégia global para a hanseníase 2016–2020” de 5 anos, em abril de 2016, intitulada “Aceleração rumo a um mundo sem hanseníase”. Com base no total de casos no final de 2018, a taxa de prevalência da hanseníase corresponde a 0,2/10.000, de acordo com a OMS.4 A incidência de ENH em pacientes com hanseníase multibacilar é de até 24%. O ENH pode ocorrer antes, durante ou após o tratamento anti‐hanseníase, mas é mais comum nos primeiros seis meses de tratamento.
O ENH é uma complicação inflamatória imunomediada. Ele ocorre em razão da liberação de mediadores pró‐inflamatórios, como o fator de necrose tumoral (TNF)‐alfa, interferon (IFN)‐gama e interleucinas (IL)‐2, IL‐6 e IL‐12, IL‐17.5 Há um aumento da ativação de células T no ENH não tratado. A proporção de células T regulatórias para células T efetoras de memória diminuiu no ENH em comparação com os controles com hanseníase virchowiana (HV) e mais células T são antígeno‐experientes no ENH.6
Corticosteroide em altas doses são a base do tratamento do ENH, mas seu uso prolongado leva a sérios efeitos adversos e dependência de esteroides. Os medicamentos de segunda linha, como talidomida, clofazimina, pentoxifilina, ciclofosfamida e metotrexato, também são muito eficazes e usados como agentes poupadores de esteroides.1 Às vezes, o ENH crônico torna‐se refratário aos medicamentos de segunda linha e representa um dilema terapêutico. Uma pesquisa bibliográfica no PubMed revelou o papel de azatioprina, inibidores do TNF‐α, minociclina e apremilaste no tratamento do ENH recalcitrante crônico, mas alguns deles estão associados a efeitos adversos inaceitáveis, maior duração e alto custo de tratamento (tabela 1).7–9
Lista de medicamentos experimentados no ENH recalcitrante crônico
| Medicamento | Referência | Tipo de estudo | Dose e duração | Pacientes | Tipo de hanseníase e duração | ENH refratário a medicamentos | IB‐pré/pós‐tratamento |
|---|---|---|---|---|---|---|---|
| Infliximabe | Faber WR et al. N Engl J Med. 2006;355:739 | Relato de caso (letter) | 300mg i.v. nas semanas 1, 2, e 6 | 52 anos, sexo feminino | HBV, 8 meses | Prednisolona | 5+/não disponível |
| Talidomida | |||||||
| Pentoxifilina | |||||||
| Etanercepte | Michele L et al. Clinical Infectious Diseases, 2011;52(5):e133‐5 | Relato de caso | 50 mg/semana s.c.×2 anos | 33 anos sexo feminino | HV, 2 meses | Prednisona | 2+a 4+/ não disponível |
| Talidomida | |||||||
| Clofazimina | |||||||
| Chowdhry S et al. Int J Mycobacteriol,2016;5(2):223‐5 | Relato de caso | 50 mg/semana s.c.×16 semanas | 49 anos, sexo masculino | HV, 2 meses | Prednisolona | 6+/não disponível | |
| Clofazimina | |||||||
| Talidomida | |||||||
| Minociclina | |||||||
| Claritromicina | |||||||
| Ofloxacina | |||||||
| Pentoxifilina | |||||||
| Azatioprina | |||||||
| Santos JRS et al. An Bras Dermatol. 2017;92(4):575‐7 | Relato de caso | 50 mg/semana s.c.×11 meses | 40 anos, sexo masculino | HV, 1 ano | Prednisolona | Não disponível | |
| Talidomida | |||||||
| Minociclina | Narang T et al JAMA Dermatol. 2015;151(9): 1026‐8 | Estudo piloto prospectivo | 100 mg/dia×3 meses | 10 pacientes | 8 HV+1 HBV+1 histoide no último ano | Prednisolona | 2+/ diminuição de 1 log |
| Clofazimina | |||||||
| Talidomida | |||||||
| Pentoxifilina | |||||||
| Colchicina | |||||||
| Hidroxicloroquina | |||||||
| Azatioprina | |||||||
| Azatioprina | Jitendra SSV et al. J Clin Diagn Res. 2017;11(8):FD01‐FD02 | Relato de caso | 100 mg/dia×12 meses | 48 anos, sexo masculino | HV, 4 anos | Prednisolona | 6+/não disponível |
| Clofazimina | |||||||
| Talidomida | |||||||
| Apremilaste | Narang T et al. Br J Dermatol. 2020;182(4):1034‐7 | Relato de caso | 30 mg BID 2×/dia seguida do escalonamento da dose padrão na primeira semana×5 meses | 34 anos, sexo masculino | HV, 8 meses | Prednisolona | Não disponível |
| Clofazimina | |||||||
| Colchicina | |||||||
| 31 anos, sexo masculino | HV, 12 meses | Minociclina | |||||
| Pentoxifilina | |||||||
| Talidomida |
HV, hanseníase virchowiana; HBV, hanseníase borderline virchowiana; ENH, eritema nodoso hansênico; IB, índice bacteriológico; i.v., intravenoso; s.c., subcutâneo.
A vacina para MIP é uma suspensão autoclavada de micobactérias não patogênicas. Ela modula a resposta imune celular em direção ao tipo protetor Th1, que converte quase 98% dos contatos saudáveis normais lepromina‐negativos para um estado lepromina‐positivo.2 Anteriormente, a vacina era evitada em reações hansênicas, pois havia a suspeita de que precipitasse as mesmas. Mas a observação do presente estudo sobre o uso de uma única dose da vacina MIP no ENH recalcitrante crônico fornece uma visão sobre como eliminar o estado de reação aguda da doença também. O ENH é desencadeado quando há abundância de bacilos fragmentados ou granulares nos tecidos. Foi postulado, ainda, que há um desequilíbrio de subconjuntos de células T imunorreguladoras no ENH. Isso se manifesta como um aumento da proporção de células T auxiliares (CD4+) para células T‐supressoras/citotóxicas (CD8+) no sangue. Uma diminuição nas células T CD8+pode favorecer a formação e a deposição de complexos imunes. Após a imunização com a vacina para MIP, há uma eliminação bacteriológica acelerada e indução de secreção de IFN‐γ, TNF‐α e IL‐12, maior atividade citotóxica das células NK e células T CD8+e diminuição do recrutamento de células B.10 Essa é a possível explicação do papel da vacina para MIP no ENH.
Como existem opções terapêuticas limitadas no ENH, a utilização dessa vacina em alguns casos resistentes ao tratamento só nos ajudará no futuro. Embora este caso sugira que a vacina para MIP não é apenas uma modalidade preventiva, mas também uma terapia complementar a outros regimes anti‐ENH, serão necessários ensaios clínicos randomizados futuros para explorar mais possibilidades com essa vacina.
Suporte financeiroNenhum.
Contribuições dos autoresSunil Kumar Gupta: Concepção e planejamento do estudo, obtenção, análise e interpretação dos dados; redação do manuscrito.
Sushantika Kumari: Concepção e planejamento do estudo, obtenção, análise e interpretação dos dados; redação do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Gupta SK, Kumari S. Chronic recalcitrant erythema nodosum leprosum: therapeutic dilemma and role of mycobacterium indicus pranii vaccine. An Bras Dermatol. 2022;97:49–53.
Trabalho realizado no All‐India Institute of Medical Sciences, Gorakhpur, UP, Índia.