O folículo piloso é uma estrutura única, uma das mais dinâmicas entre os mamíferos. Ele é capaz de reproduzir em cada novo ciclo os mecanismos moleculares que o desenvolveram no período fetal. Embora muitas pesquisas tenham sido feitas a respeito do folículo piloso humano, pouco tem sido esclarecido a respeito do papel das citoqueratinas (CKs) no seu desenvolvimento.
ObjetivoEstudar a imunoexpressão das CKs no folículo piloso em desenvolvimento de embriões/fetos humanos.
MétodosUm estudo imuno‐histoquímico foi desenvolvido com fragmentos de pele de fetos humanos entre a 4‐25 semanas de idade gestacional, para avaliar a expressão das CK1, CK10, CK13, CK14, CK16 e CK20 nos folículos pilosos em desenvolvimento de embriões e fetos humanos.
Limitações do estudoEstudo de caráter retrospectivo que avaliou um bom número de anticorpos, porém com um número limitado de casos para cada marcador.
Resultados/conclusãoVerificou‐se que as CKs foram expressas num período intermediário do desenvolvimento folicular. Inicialmente foram expressas as CKs epiteliais (CK1, CK14, CK10, CK13) e as CKs epiteliais proliferativas como, por exemplo, a CK16, marcadores de maturação celular e queratinização folicular. Posteriormente, a CK20 foi expressa em folículos pilosos primitivos mais desenvolvidos como previamente relatado na literatura.
Os folículos pilosos estão em constante renovação, reproduzem os mesmos mecanismos embrionários que o formaram primeiramente no período fetal.1 Os folículos pilosos desenvolvem‐se precocemente em torno da 9ª e 12ª semana de gestação originados de uma proliferação do estrato germinativo da epiderme. Os queratinócitos se diferenciam e formam a bainha radicular externa (BRE), a bainha de companhia, a bainha radicular interna e a haste capilar propriamente dita.2 Seu desenvolvimento obedece um padrão crânio caudal de desenvolvimento e os primeiros folículos pilosos são observados na região da face e sobrancelha.2
Uma área extremamente desafiadora é como o desenvolvimento folicular e sua maturação ocorrem. O desenvolvimento folicular e sua posterior diferenciação envolvem uma complexa série de eventos nos quais fatores de crescimento geram o remodelamento da matriz celular e de moléculas como proteoglicanos.3–6
As citoqueratinas (CKs) são as principais proteínas que estruturam as células epiteliais, fornecem forma, resistência e manutenção dos contatos intercelulares; no folículo piloso além da função estrutural, são marcadores de maturação folicular e de citodiferenciação. São divididas em duas famílias, as do Tipo 1, as queratinas ácidas, e as do Tipo 2, as queratinas básicas.7 No total, 26 queratinas são consideradas específicas do folículo piloso, comparável às 29 expressas no epitélio.8
Uma gama de mutações nas CKs está relacionada a doenças que afetam a estrutura e a densidade dos cabelos em humanos e animais. Doenças como hipotricoses e o moniletrix já foram relacionadas a mutações específicas de algumas CKs.9–11 Outras doenças que podem afetar o folículo piloso, como o líquen plano pilar, mostram um padrão alterado na expressão de determinadas CKs que poderiam ser usadas como marcadoras precoces para essa doença.12,13 Assim, as CKs podem ser alvo para desenvolvimento de fármacos e métodos diagnósticos que possam auxiliar no diagnóstico precoce e tratamento de doenças do folículo piloso.
Embora já exista uma literatura vasta sobre os folículos pilosos e sobre as CK, pouco é conhecido sob a expressão das CK durante a diferenciação dos folículos pilosos humanos. Devido à importância das CK no desenvolvimento dos folículos pilosos e a escassez de informações sobre esse assunto, estudamos o padrão de expressão das CK no folículo piloso humano em desenvolvimento.
MétodosUm estudo retrospectivo que envolveu cortes histológicos provenientes de áreas pilosas de fragmentos de pele de embriões/fetos humanos em diferentes estágios gestacionais (4–2 semanas) foi obtido através dos arquivos do Laboratório de Dermatopatologia, Departamento de Dermatologia, Universidade de São Paulo. O estudo foi submetido à Comissão de Ética desta instituição. Parecer n° CEP: 0172/08. As regiões analisadas e padronizadas foram: couro cabeludo, face, supercílio, membro superior, dorso e genitais. As morfologias das estruturas foram avaliadas previamente em Hematoxilina e eosina para melhor caracterização das estruturas. Nesses cortes foi feito estudo imuno‐histoquímico com os seguintes marcadores: CK1, CK10, CK13, CK14, CK16 e CK20.
Protocolo imuno‐histoquímicoOs cortes de 3 μm foram desparafinizados e diafanizados em dois banhos de xilol. A seguir os cortes foram reidratados em cadeia descendente de etanol e imersos em solução de hidróxido de amônia a 10%. Recuperação dos sítios antigênicos ocorreu de várias formas, dependeu do anticorpo primário usado (tabela 1).
Anticorpos monoclonais usados e peculiaridades do protocolo
| Anticorpo primário | Clone | Empresa | Recuperação antigênica | Diluição | Incubação |
|---|---|---|---|---|---|
| Citoqueratina 1 | 34BB4 | Novo Castra | Micro‐ondas | 1:25 | “Overnight” |
| Citoqueratina 14 | AB‐1 | Neomakers | Micro‐ondas | 1:40 | “Overnight” |
| Citoqueratina 16 | DE‐K10 | Dako | Micro‐ondas | 1:50 | “Overnight” |
| Citoqueratina 10 | DE‐K10 | Dako | Micro‐ondas | 1:50 | “Overnight” |
| Citoqueratina 13 | M 7003 | Dako | Micro‐ondas | 1:50 | “Overnight” |
| Citoqueratina 20 | Clone Ks20.8 | Dako | Micro‐ondas | 1:50 | “Overnight” |
Após a lavagem, o material foi incubado em solução de peróxido de hidrogênio 20 volumes, em seguida os cortes foram imersos duas vezes em solução de TRIS Ph 7,4 e posteriormente, foram incubados com solução de 0,5% BSA (Sigma), 2,5% SFB (Cultilab) em TRIS e incubados com o soro primário diluído em solução de 1% BSA (Sigma) em TRIS. Os procedimentos posteriores foram sempre precedidos de lavagens no tampão TRIS. Após a incubação com o anticorpo primário, os espécimes foram incubados com o reagente En Vision (Dako). Para a revelação, os espécimes foram incubados na solução com agente DAB (Sigma). Os cortes histológicos foram então contracorados com Hematoxilina de Carazzi e posteriormente desidratados em cadeia ascendente de álcoois, diafanizados em três banhos de xilol e montados em resina Permount® para o exame microscópico. Controles negativos foram feitos através da incubação de espécimes com soro não imune. Todas as reações de imuno‐histoquímica foram feitas paralelamente com tecidos adultos como controles negativo/positivo.
Os resultados obtidos nas reações imuno‐histoquímicas foram analisados por dois observadores e tabulados de forma qualitativa. Foram considerados positivos (+) os espécimes que apresentaram imunomarcação e negativos (‐) os espécimes que não apresentaram imunoexpressão.
Todos os resultados foram registrados pelo sistema de fotomicrografia digital Axio Vision (Zeiss e Axiophot).
ResultadosForam avaliados 73 espécimes provenientes de áreas pilosas de embriões ou fetos que variaram de 4‐25 semanas de idade gestacional. Foram avaliados os seguintes marcadores: CK1, CK10, CK13, CK14, CK16, CK20, nas regiões como: couro cabeludo, face, supercílio, membro superior, dorso e genitais e os resultados podem ser avaliados na tabela 2 e figura 1. Analisamos todos os casos obtidos nos arquivos do Laboratório de Dermatopatologia referente a áreas pilosas de cada marcador. Foram obtidos 12 espécimes para CK1; 14 espécimes para CK14; 9 espécimes para CK10; 10 espécimes para CK13; 21 espécimes para CK16 e apenas 7 espécimes para CK20.
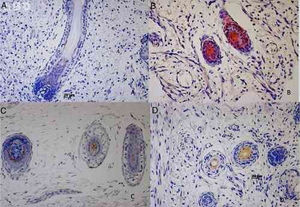
Imunomarcação das citoqueratinas epiteliais no folículo piloso humano em desenvolvimento. (A) Imunoexpressão da CK1 em um feto de 19 semanas de gestação. (B) Imunoexpressão da CK14 em um feto de 12 semanas de gestação. (C) Imunoexpressão da CK20 em um feto de 21 semanas de gestação. (D) Imunoexpressão da CK16 em um feto de 12 semanas de gestação.
A imunomarcação para CK1, CK10, CK13 foi notada a partir da 12ª semana gestação nos folículos pilosos primitivos e até a 25ª semana gestacional nos folículos mais plenamente desenvolvidos; 25%, 55%, 70% das lâminas marcaram positivamente para a CK1, CK10 e CK13 respectivamente, na BRE, no território do óstio folicular, infundíbulo, glândula sebácea e papila dérmica. As principais regiões marcadas foram a pálpebra, face e genital. A imunomarcação para CK14 foi vista em folículos primitivos de embriões de 9 semanas de gestação na região do membro superior e dorso e até em folículos mais desenvolvidos com 21 semanas gestacionais; 100% dos casos marcaram positivamente para a CK14, na BRE. Todas as regiões analisadas foram marcadas.
CK16 e CK20A imunomarcação para CK16 foi vista em folículos primitivos de embriões de 12 semanas de gestação na região da face até em folículos mais desenvolvidos com 23 semanas gestacionais; 61% das lâminas marcaram positivamente para a CK16, na BRE. Todas as regiões analisadas foram marcadas. A imunomarcação para CK20 foi vista em folículos primitivos de embriões de 14 semanas de gestação na região do couro cabeludo até folículos mais desenvolvidos com 25 semanas gestacionais; 57% fetos marcaram para CK20, no território da BRE e papila dérmica. Todas as regiões analisadas foram marcadas.
DiscussãoEste estudo avaliou o padrão de expressão das CK no folículo piloso humano em desenvolvimento. Existem poucos trabalhos na literatura sobre esse tema.
Schirren et al. foram os pioneiros em mostrar que as células foliculares germinativas do placoide folicular fetal humano expressavam CK5, CK6, CK14, CK17 e CK19 e que posteriormente, com desenvolvimento folicular, o padrão de expressão nas CKs de cada porção do folículo piloso se alterava.14
De acordo com os dados obtidos verificou‐se que entre nove e 14 semanas gestacionais, CK1, CK14, CK10, CK13, CK16 e CK20 tornaram‐se expressas. Apenas dois dos nossos marcadores foram avaliados por Schirren et al., a CK14 e CK10. Essas CKs foram encontradas nos folículos pilosos em desenvolvimento, a CK14 nas fases mais iniciais ainda na fase de placoide e também posteriormente. Já a CK10 num folículo piloso um pouco mais diferenciado, na região do istmo na BRE, nas células suprabasais do infundibulum junto com CK14. Os resultados desse trabalho foram semelhantes aos nossos, a imunomarcação manteve o padrão crânio caudal de distribuição.
Segundo os dados obtidos, a CK14 foi a primeira a ser expressa em embriões com menos de 12 semanas de vida, em torno da 9ª semana gestacional. Inicialmente, tanto a CK1 e quanto a CK14 foram expressas na região no istmo. Estudos que envolveram as CK1 e Ck14 mostraram que a expressão de CK1 ocorre em todas as camadas epidérmicas, enquanto que a expressão de CK14 predominava na região epidérmica perifolicular.15
Observa‐se tambem que a CK1, CK10, CK13 e CK16 foram expressas com 12 semanas de idade gestacional. Estudos que envolveram as Ck1 e Ck14 através da via de sinalização Shh mostraram achados conflitantes. Na superexpressão da CK1, os camundongos no período embrionário foram incapazes de desenvolver folículos pilosos. No outro modelo experimental, na superexpressão da CK14, ocorreu uma hiperproliferação folicular, além de múltiplas lesões tipo carcinoma basocelular nos animais analisados.16,17
É descrito na literatura que a hiperproliferação das camadas epiteliais ocasionada por uma superexpressão de CK1 durante o desenvolvimento embrionário altera a capacidade das células basais de iniciar um programa de diferenciação celular adequado para formação dos folículos pilosos.16 Assim, as CK1 e CK14 têm um papel importante na formação do folículo piloso fetal através da cascata de sinalização Shh. O exato tempo, localização e concentração da expressão dessas CKs nessa via de sinalização Shh afetam o fenótipo dos folículos pilosos no período fetal embrionário, mas sem alterações nos folículos pilosos pós‐natais.16
A CK10 é uma CK epitelial classicamente relacionada à hiperceratose epidermolítica, seu moisacismo e mutações eventuais podem estar relacionadas a essa doença ou doenças que a mimetizam.18 Em nosso trabalho a CK10 imunomarcou os folículos pilosos na BRE, assim como CK1 e CK14.
No presente estudo, a CK16 foi expressa em regiões mais proliferativas do folículo piloso, principalmente na região do bulbo. A CK16, assim como as CK6 e CK17, é uma CK proliferativa e de reparação, é expressa em estados patológicos e ao redor de tecidos em cicatrização. Corroborando os nossos achados, é descrito que essas CKs hiperproliferativas são expressas nos folículos pilosos em desenvolvimento, quando já existe uma diferenciação epitelial.14
A CK13 é uma CK epitelial já usada como imunomarcadora de neoplasia intraepitelial oral. Mais recentemente foi avaliada sua expressão junto com a CK17, como imunomarcador para neoplasia intraepitelial vulvar. No folículo piloso em desenvolvimento foi observada em nosso trabalho imunomarcando a BRE dos folículos pilosos fetais em desenvolvimento, assim como as outras CK epiteliais.19
A CK20 é um marcador para as células de Merkel. Assim como na literatura, a sua imunoexpressão foi detectada em folículos pilosos em um estágio mais avançado de desenvolvimento, a partir da 14ª semana de idade gestacional. A literatura relata presença de células de Merkel na BRE de folículos pilosos de vibrissas de roedores. Em humanos, nos folículos pilosos fetais primitivos, a CK20 foi marcada na camada basal do infundíbulo, mas não em áreas profundas dos folículos pilosos, inclusive o bulbo e a derme.20 No nosso trabalho, conforme a literatura, encontramos expressão para CK20 nos folículos pilosos já desenvolvidos em torno da 25ª semana gestacional na região da papila dérmica e na BRE, porém também em folículos em período intermediário de desenvolvimento com 14 semanas gestacionais.
ConclusãoA morfogênese do folículo piloso é uma reestruturação do tecido epitelial e do tecido mesenquimal para formar uma unidade pilossebácea completamente diferenciada. Nós observamos que os padrões de expressão das CKs durante o desenvolvimento dos folículos pilosos são dinâmicos como visto por outros autores na epiderme.15 As CKs iniciam sua expressão nos folículos pilosos humanos em torno da 9ª semana de idade gestacional, a CK14 é a primeira a ser identificada e com a maior percentual de marcação. Nossos dados confirmam a literatura que mostra que as CKs são marcadores de maturação do desenvolvimento dos folículos pilosos e são expressas a partir da fase de placoide folicular. Inicialmente a expressão dessas CKs coincide com as CKs expressas no epitélio primitivo: CK1, CK14, CK10, CK13 e a CK proliferativa: CK16. Como previamente relatado na literatura, a CK20 foi expressa em folículos pilosos mais desenvolvidos a partir da 14ª semana gestacional. Os resultados quando colocados em conjunto indicam que desde as fases mais precoces do desenvolvimento folicular os folículos pilosos progressivamente e coordenadamente se preparam para proteger a pele do feto para o parto e estímulo ambiental. As compreensões dessas etapas de maturação são importantes para o entendimento da estrutura dos folículos pilosos normais e sua função no adulto na saúde e na doença. Nosso trabalho serviu para preencher uma lacuna na literatura sobre um tema pouco estudado. Nós também acreditamos que se identificarmos os padrões de diferenciação das CKs nos folículos pilosos em humanos podemos gerar questionamentos e incitar investigações, além de abrir possibilidade para terapias regenerativas, identificação de biomarcadores precoces e potenciais alvos diagnósticos para as doenças do folículo piloso. Entretanto, são necessários outros estudos investigativos para avaliar melhor o desenvolvimento e expressão proteica dos folículos pilosos humanos e colaborar no diagnóstico e tratamento das doenças relacionadas a essa estrutura.
Suporte financeiroFundo de Apoio à Dermatologia (Funaderm), da Sociedade Brasileira de Dermatologia. Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Contribuição dos autoresLaura Maria Andrade Silva: Análise estatística; aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Ricardo HSIEH: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Silvia Vanessa Lourenco: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Neusa Yuriko Sakai Valente: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Geise Rezende Paiva: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Juliana Dumet Fernandes: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Silva LMA, Hsieh R, Lourenco SV, Valente NYS, Paiva GR, Fernandes JD. Immunostaining study of cytokeratins in human hair follicle development. An Bras Dermatol. 2020;95:278–82.
Trabalho realizado no Instituto de Medicina Tropical de São Paulo, Universidade de São Paulo, São Paulo, SP, Brasil.