Os nevos azuis comuns, descritos pela primeira vez por Jadassohn‐Tieche em 1906, são proliferações melanocíticas compostas por células pigmentadas reminiscentes dos precursores melanocíticos dendríticos derivados da crista neural embrionária. Ocorrem comumente nas faces dorsais das extremidades, no couro cabeludo e nas nádegas de crianças e jovens adultos. Histopatologicamente, os nevos azuis são compostos por uma proliferação dérmica circunscrita simétrica de melanócitos dendríticos fusiformes, dérmicos e pigmentados, que têm uma propensão a se estender ao redor das estruturas anexiais ou feixes neurovasculares. Essas células dendríticas estão misturadas com um número variável de melanócitos ovais reminiscentes de células névicas intermediárias (tipo B) e células fusiformes neurotizadas (tipo C). Os nevos azuis comuns surgem a partir da proliferação do pool melanocítico, dendrítico, dérmico, residual originado da crista neural, possivelmente iniciado por inflamação dérmica ou outros estímulos. Esses nevos podem surgir de células‐tronco precursoras mutadas na derme, capazes de se diferenciar em nevos azuis.1,2
O homólogo humano da proteína silver locus (Pmel17 ou gp100) em camundongos é uma proteína de membrana tipo I específica de melanócitos. É importante para a formação de fibrilas melanossomais que auxiliam na maturação dos pré‐melanossomas do estágio I para o estágio II. O anticorpo HMB45 foi desenvolvido a partir de um extrato de uma metástase linfonodal de melanoma. Ele reage especificamente com a forma glicosilada de gp100 restrita à matriz fibrilar de pré‐melanossomas de estágio II.3 O gene correspondente à proteína definida por HMB45 foi recentemente clonado e designado gp 100‐cl. O HMB‐45 se liga aos melanossomas do estágio I e II e à porção não melanizada do estágio III, enquanto os melanossomas do estágio IV e os complexos de melanossomas encontrados em macrófagos e queratinócitos são negativos.3–5 A imunorreatividade do HMB‐45 é frequentemente observada em melanócitos fetais e neonatais (proteína oncofetal), mas não em melanócitos adultos em repouso. O HMB45 é re‐expresso na maioria dos melanomas malignos, nos melanócitos ativados, como algumas células névicas juncionais, nevos atípicos, nevos traumatizados e melanócitos de nevos azuis.3,5
Até o momento, o conhecimento sobre os padrões de expressão da proteína HMB45 em nevos azuis comuns é limitado.6,7 O objetivo deste estudo foi avaliar a maturação dos melanócitos dérmicos, utilizando a expressão da proteína HMB45, em uma série de nevos azuis comuns. Para atingir esse objetivo, as amostras fixadas em formalina e emblocadas em parafina de nevos azuis comuns (20 casos) e nevos intradérmicos (20 casos) foram obtidas dos arquivos do Departamento de Patologia, e dos arquivos de consulta deste autor, no Assuit University Hospital. Os cortes histológicos imunomarcados foram revisados para avaliar a expressão dos marcadores melanocíticos (S100: clone 4C4.9, Melan A: clone: A103, HMB45: clone HMB45; anticorpos monoclonais) e de proliferação celular (Ki67: clone 30‐9; anticorpo policlonal). O número de células positivas para HMB45 (coloração citoplasmática) foi avaliado em 100 células em quatro campos de grande aumento e relatado como a porcentagem de células positivas de acordo com outros grupos.8 Os dados foram analisados no software SPSS (versão 17, IL, Chicago).
Os pacientes com nevos azuis incluíam 11 mulheres e 9 homens. A média de idade era de 53,3 ± 4,1 anos (variação: 7 a 88 anos). Os locais com maior frequência de nevos azuis foram cabeça e região cervical (nariz, fronte e couro cabeludo: nove casos), extremidades (região do ombro e braço: sete casos) e região dorsal (dois casos) e tórax (dois casos). A maioria dos casos era pigmentada, com aspecto clínico semelhante à queratose seborreica ou nevos atípicos. Todos os nevos azuis e intradérmicos comuns mostraram coloração forte e difusa para S100 e Melan‐A em toda a lesão. Nenhuma imunomarcação significativa para KI‐67 foi observada em nevos azuis ou intradérmicos (o índice de marcação de Ki‐67 foi de 0 a 1%). Nenhum dos casos de nevos intradérmicos apresentou expressão da proteína HMB45. Em contraste, todos os nevos azuis expressaram a proteína HMB45. Três padrões de expressão foram observados: difuso, irregular ou como células positivas para HMB45 esparsas (figs. 1 e 2). A porcentagem de células positivas variou de 5 a 85% (valor médio: 49,2 ± 6,4). Não houve correlação entre os valores de expressão de HMB45 e as características clínicas (idade e sexo do paciente, ou local, tamanho das lesões).
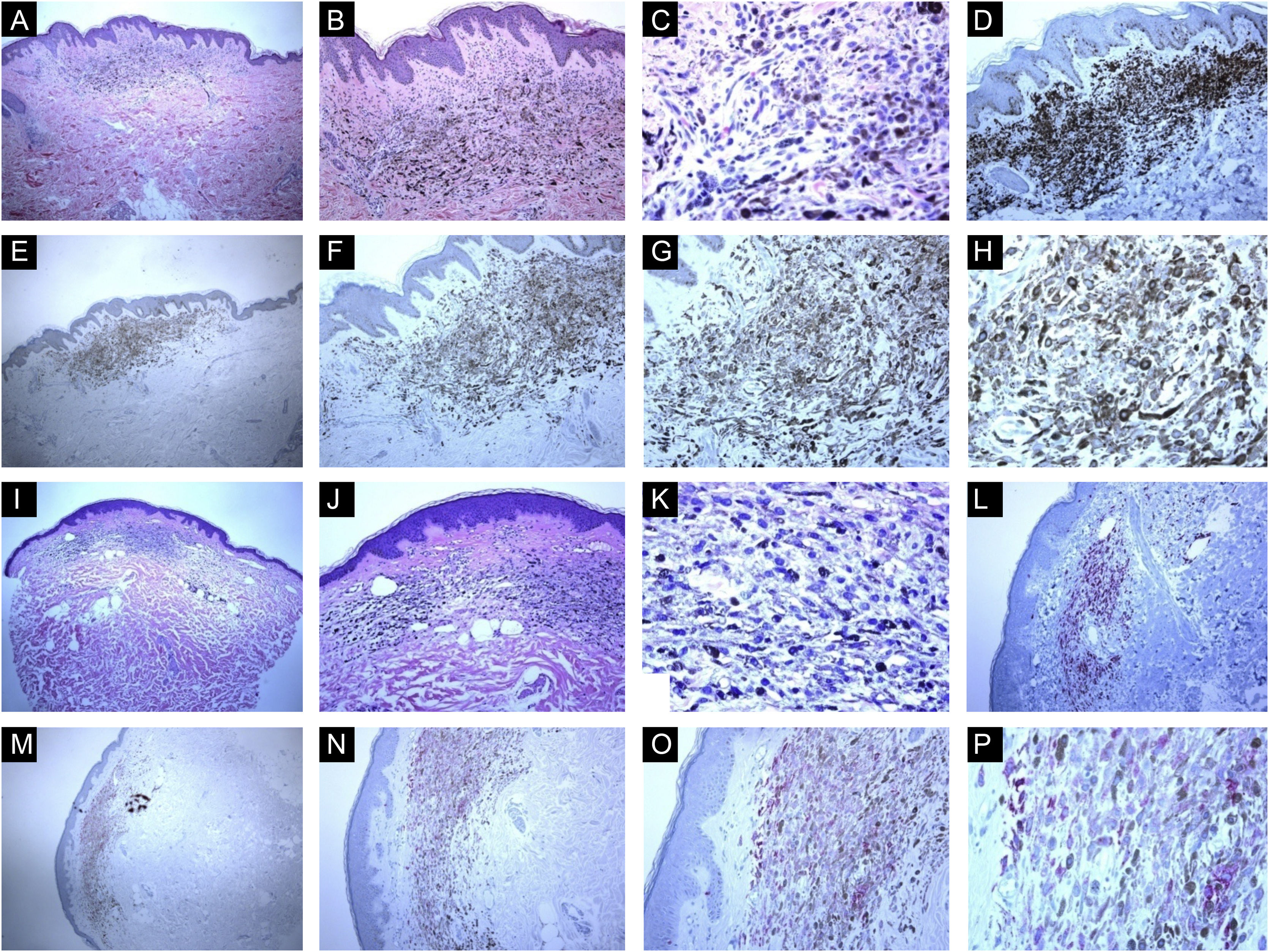
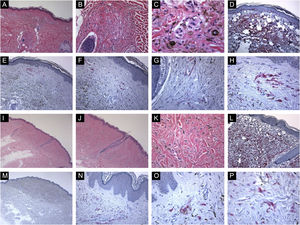
Características imuno‐histológicas de nevos azuis comuns com expressão da proteína HMB45 (padrões de coloração difusos ou irregulares). (A, B e C), Caso de uma paciente de 59 anos que apresentou mácula brilhante hiperpigmentada de 0,5cm na pele do braço direito. Histopatologicamente, a lesão é composta por uma proliferação de melanócitos dendríticos e fusiformes, misturados com macrófagos carregados de pigmento (“melanófagos”). Figuras mitóticas e atividade melanocítica juncional estão ausentes. A maturação histológica é observada nas partes periférica e profunda da lesão, onde as células fusiformes se insinuam isoladamente entre as fibras colágenas espessadas da derme reticular. Infiltrado linfocítico perivascular esparso também é visto. Não há necrose celular individual ou células em mitose. (D), A avaliação imuno‐histoquímica adicional foi realizada com os controles positivos e negativos adequados que revelaram forte imunomarcação difusa para Melan‐A. (E, F, G e H), As células tumorais apresentam expressão da proteína HMB45 em toda a lesão (padrão difuso de coloração). (I, J, K e L), Caso de uma paciente de 63 anos com mácula hiperpigmentada de 0,4cm na parede torácica. Os cortes histológicos mostram uma mistura de melanócitos epitelioides dendríticos e melanófagos na derme reticular média em meio a feixes de colágeno. (L), Não há mitoses ou necrose celular individual ou infiltrado de células inflamatórias: Avaliação imuno‐histoquímica adicional foi realizada com os controles positivos e negativos adequados que revelaram forte coloração difusa para Melan‐A. (M, N, O e P), As células tumorais apresentam expressão difusa da proteína HMB45 em toda a lesão.
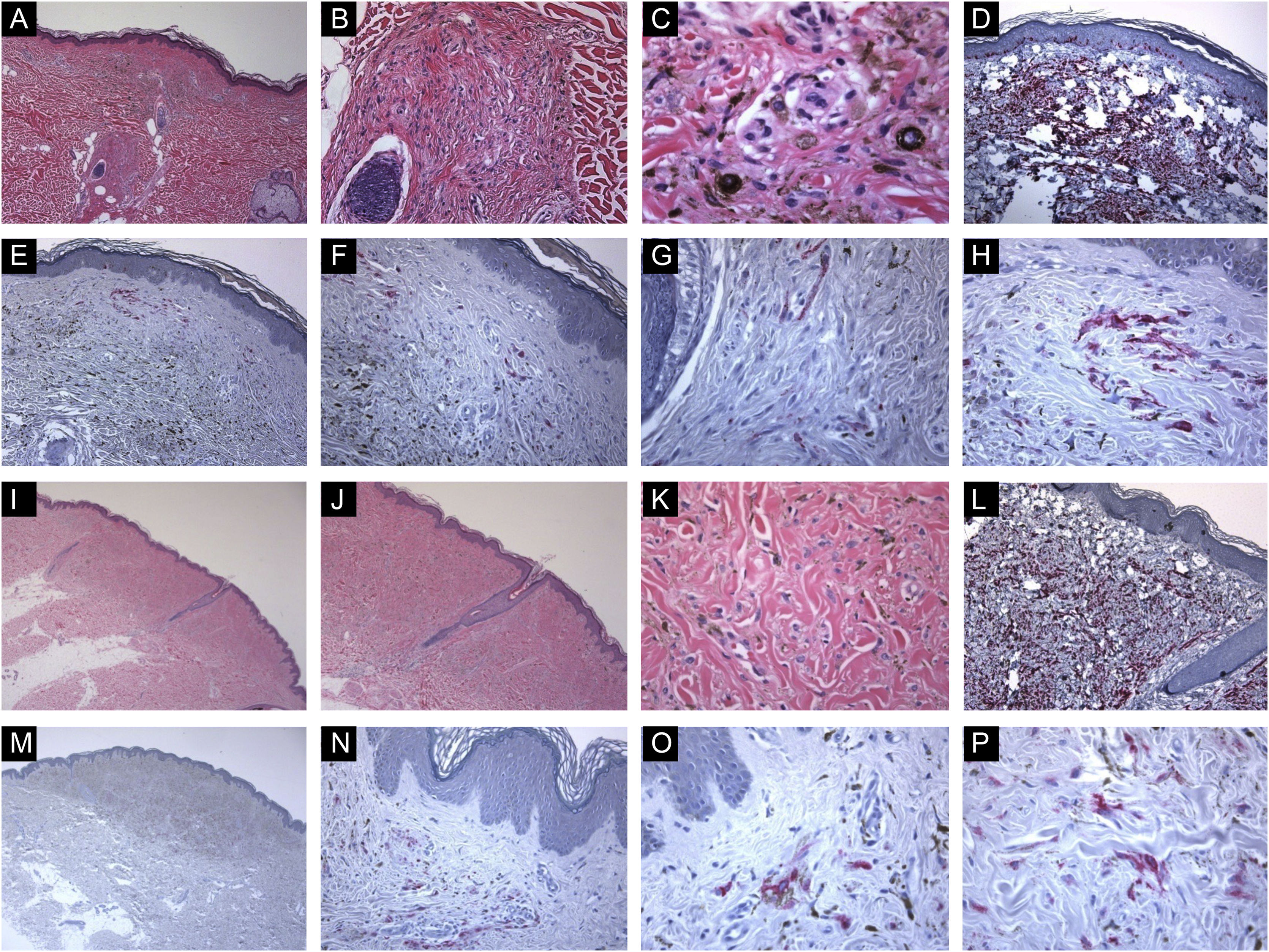
Características imunohistológicas de nevos azuis comuns com expressão da proteína HMB45 (padrões de coloração celular irregulares ou individuais). (A, B e C), Caso de uma paciente de 56 anos com mácula hiperpigmentada, de 0,2cm, no meio da região dorsal superior. Histopatologicamente, há um crescimento dérmico bem circunscrito e simétrico composto por melanócitos alongados e finamente ramificados insinuados entre as fibras de colágeno da derme superior e média. Os melanócitos estão misturados com alguns melanófagos. Há agregação perianexial (perifolicular) dos melanócitos. (D), Avaliação imuno‐histoquímica adicional foi realizada com os controles positivos e negativos adequados que revelaram forte coloração difusa para Melan‐A em toda a lesão. (E, F, G e H), Alguns grupos de melanócitos dérmicos positivos para HMB45 são observados (padrão irregular de coloração). (I, J, K e L), Caso de uma paciente de 49 anos com lesão lisa, marrom‐acinzentada, medindo 0,7cm, na pele da região glútea esquerda. Cortes histológicos mostram alteração da derme por um crescimento simétrico que consiste em uma mistura variável de melanócitos dendríticos, alguns melanófagos e fibrose. Não há atipia citológica aparente, necrose celular ou atividade mitótica. Avaliação imuno‐histoquímica adicional foi realizada com os controles positivos e negativos adequados que revelaram forte coloração difusa para Melan‐A em toda a lesão. (M, N, O e P), Observam‐se ocasionalmente células névicas dérmicas positivas para HMB45 (padrão de coloração de células individuais).
Vários estudos indicaram que a coloração para HMB‐45 pode evidenciar o padrão de “maturação imuno‐histoquímica” das lesões melanocíticas. Os melanócitos juncionais ou superficiais ativados do tipo A (células epitelioides) expressam HMB45, enquanto os melanócitos do tipo C profundamente localizados (células fusiformes) não expressam esse anticorpo.3,5 Consistente com investigações anteriores,6 todos os nevos azuis comuns neste estudo mostraram uma expressão variável da proteína HMB45. Wood et al. examinou imunohistoquimicamente a expressão da proteína HMB45 em nevos azuis. Eles encontraram forte reatividade difusa de HMB45 em todos os nevos azuis celulares e expressão variável da proteína HMB45 na maioria dos nevos azuis comuns. Os autores sugeriram que os nevos azuis têm um fenótipo ativado. De maneira similar, Sun et al. relataram a expressão da proteína HMB45 em 16 casos de nevos azuis. Os autores sugeriram que as células dos nevos azuis são derivadas de uma célula precursora que tem algumas características comuns tanto do melanócito quanto da célula de Schwann.7
Neste estudo, a expressão preservada da proteína HMB45 nas porções superficial e profunda das lesões indica ausência de maturação imuno‐histoquímica nos nevos azuis. Essa expressão preservada da proteína HMB45 nessas células névicas é indicativa de seu fenótipo ativado com formação ativa de melanossomas. Embora os mecanismos subjacentes a esse fenótipo ativado em nevos azuis comuns sejam desconhecidos, pode ser atribuído à liberação de fatores de crescimento melanocíticos, como fator de crescimento de hepatócitos, endotelina‐1 e hormônio estimulador de α‐melanócitos. Esses fatores podem alterar a glicosilação da proteína HMB45 durante vários estados patogênicos dos melanócitos, ajudar a ativar a melanogênese e estimular a motilidade e a proliferação das células residuais normais em repouso nos pools de melanócitos dérmicos.9 É possível que as células dos nevos azuis comuns tenham origem a partir de células‐tronco melanocíticas, dérmicas, extrafoliculares, ativadas. Estas últimas persistem após o terem origem na bainha nervosa superficial dos nervos periféricos. Essas células podem proliferar, dando origem a precursores de melanócitos migratórios com fenótipo ativado e expressão da proteína HMB45.10 Em conclusão, este estudo relatou a expressão da proteína HMB45 nos melanócitos dérmicos do nevo azul comum, indicando seu fenótipo ativado. Os mecanismos subjacentes desse fenótipo ativado, como o papel dos fatores de crescimento, deverão ser objeto de investigações futuras.
Suporte financeiroNenhum.
Contribuição dos autoresMahmoud Rezk Abbelwahed Hussein contribuiu total e exclusivamente para o seguinte: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Hussein MR. HMB45 protein expression and the immunohistochemical maturation in common blue nevi: a reappraisal. An Bras Dermatol. 2022;97:387–90.
Trabalho realizado no Departamento de Patologia, Faculdade de Medicina, Assiut University Hospitals, Egito.