Eliminar a hanseníase (MH) é meta global da Organização Mundial da Saúde (OMS). Para isso, o combate à doença no Brasil é de vital importância, visto que o país detém 13% do número absoluto de casos novos da doença no mundo.1
Identificar precocemente possíveis casos de MH na comunidade, seja por médicos generalistas, de diferentes especialidades ou dermatologistas, é essencial para reduzir a propagação da moléstia e combater sequelas relacionadas ao diagnóstico tardio. Logo, é imprescindível investir no treinamento diagnóstico da comunidade médica, enfermeiros e agentes comunitários de saúde.2
É necessário, no entanto, que se tenha em mente que muitos casos não seguem a apresentação clássica da doença, dificultando seu diagnóstico, o que torna também necessário o conhecimento de formas cujas manifestações extrapolem o acometimento dos sítios cutâneo e neurológico.
Apresentamos um paciente do sexo masculino, de 48 anos, com dor testicular com irradiação para a região inguinal, calafrios, insônia, sudorese noturna e perda ponderal espontânea de 9kg em dois meses. Ao exame físico, apresentava linfonodomegalia inguinal bilateral, com linfonodos móveis, de aspecto parenquimatoso, de 3cm de diâmetro, sem acometimento de outras cadeias linfonodais. No exame ultrassonográfico da região inguinal, foram vistos linfonodos aumentados, com arquiteturas habituais de aspecto reacional, bem como esplenomegalia na ultrassonografia do abdome. O hemograma evidenciou linfopenia.
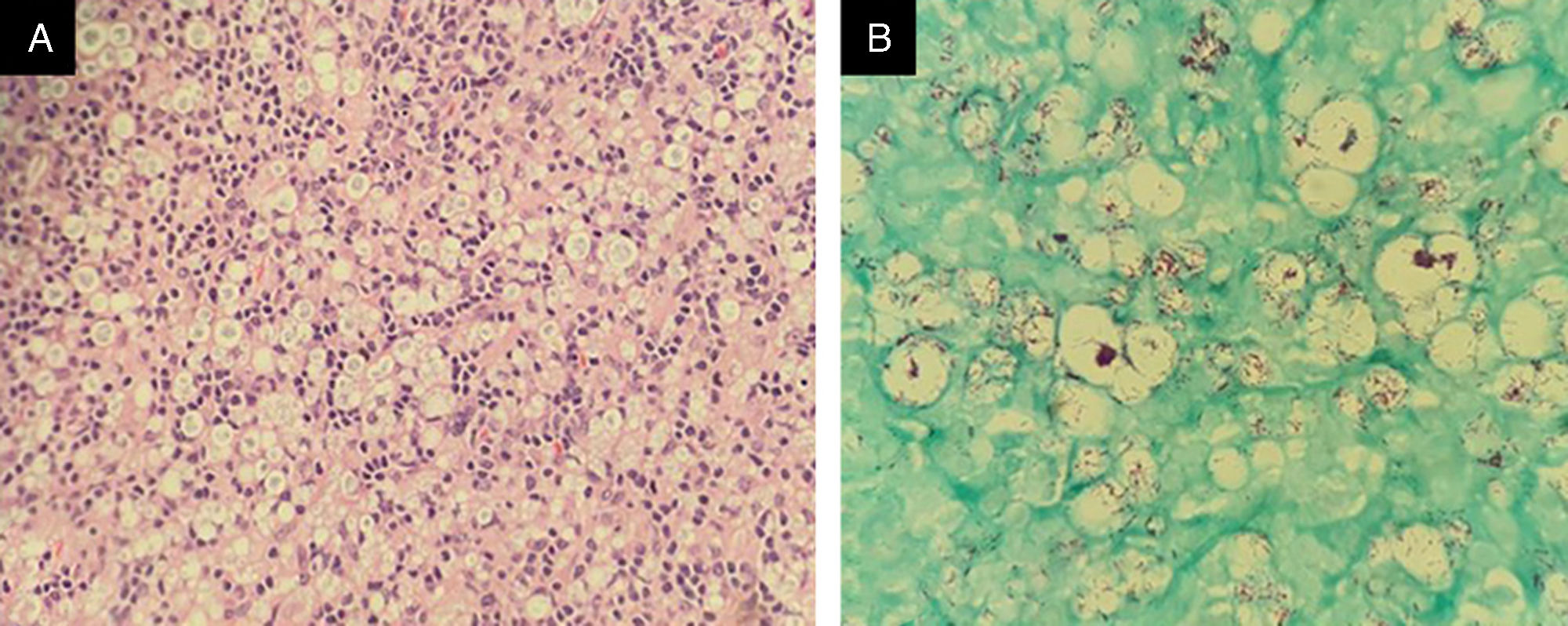
Fez‐se a hipótese pela clínica médica de linfoma não Hodgkin; foi realizada biopsia de um dos linfonodos, cujo exame anatomopatológico evidenciou desorganização do estroma linfonodal com acentuado número de histiócitos. Na coloração por Fite‐Faraco, foram observados inúmeros bacilos álcool‐ácido resistentes organizados em globias, firmando‐se o diagnóstico de envolvimento ganglionar por MH (fig. 1).
Biopsia de linfonodo inguinal. (A) Presença de infiltrado histiocítico difuso, com desorganização do estroma linfonodal e presença de linfócitos típicos (Hematoxilina & eosina, 40×). (B) Presença de inúmeros bacilos álcool‐ácido resistentes, organizados em globias dentro de histiócitos xantomatosos (Fite‐Faraco, 100×).
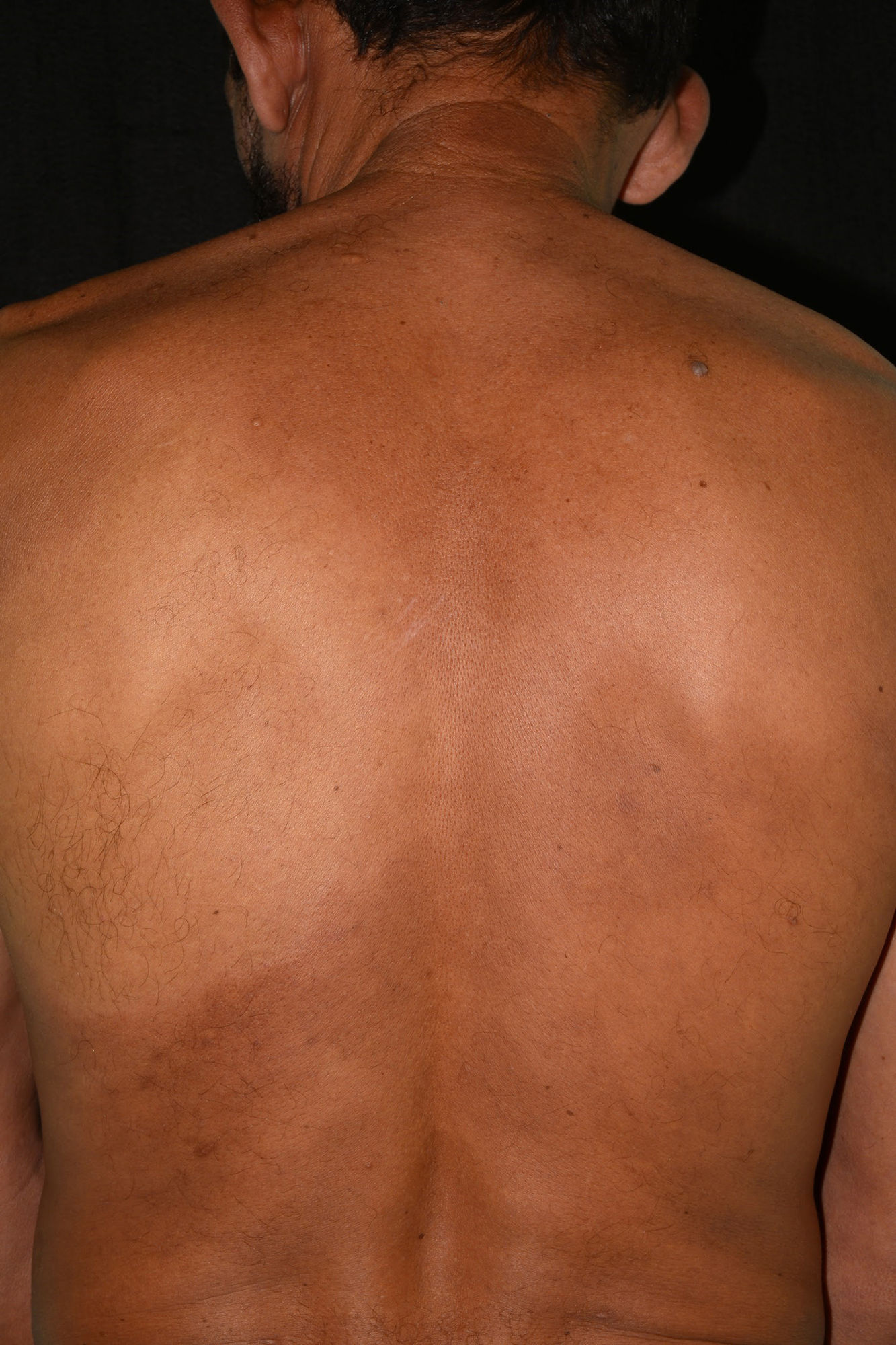
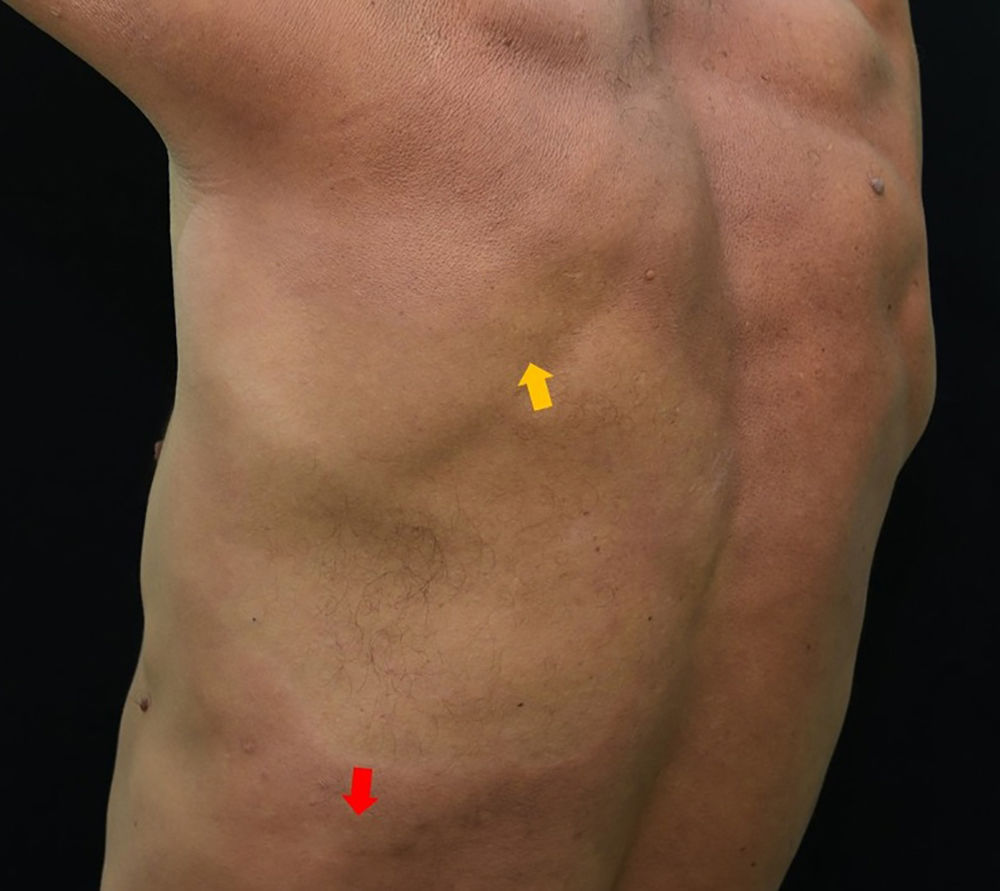
Quando da interconsulta à Dermatologia, ao exame físico observou‐se mancha hipocrômica infraescapular esquerda, anestésica ao exame estesiométrico (figs. 2 e 3). Além disso, toda a área perilesional apresentava aparente infiltração cutânea difusa. Havia também espessamento indolor dos nervos ulnares, bilateralmente, e discreta infiltração dos lóbulos da orelha.
Mancha hipocrômica acometendo a região escapular e infraescapular, estendendo‐se até a região costal esquerda, anestésica. Na seta amarela é possível visualizar a área biopsiada com suspeita de hanseníase. Na seta vermelha é possível ver discreta infiltração periférica, que também foi biopsiada.
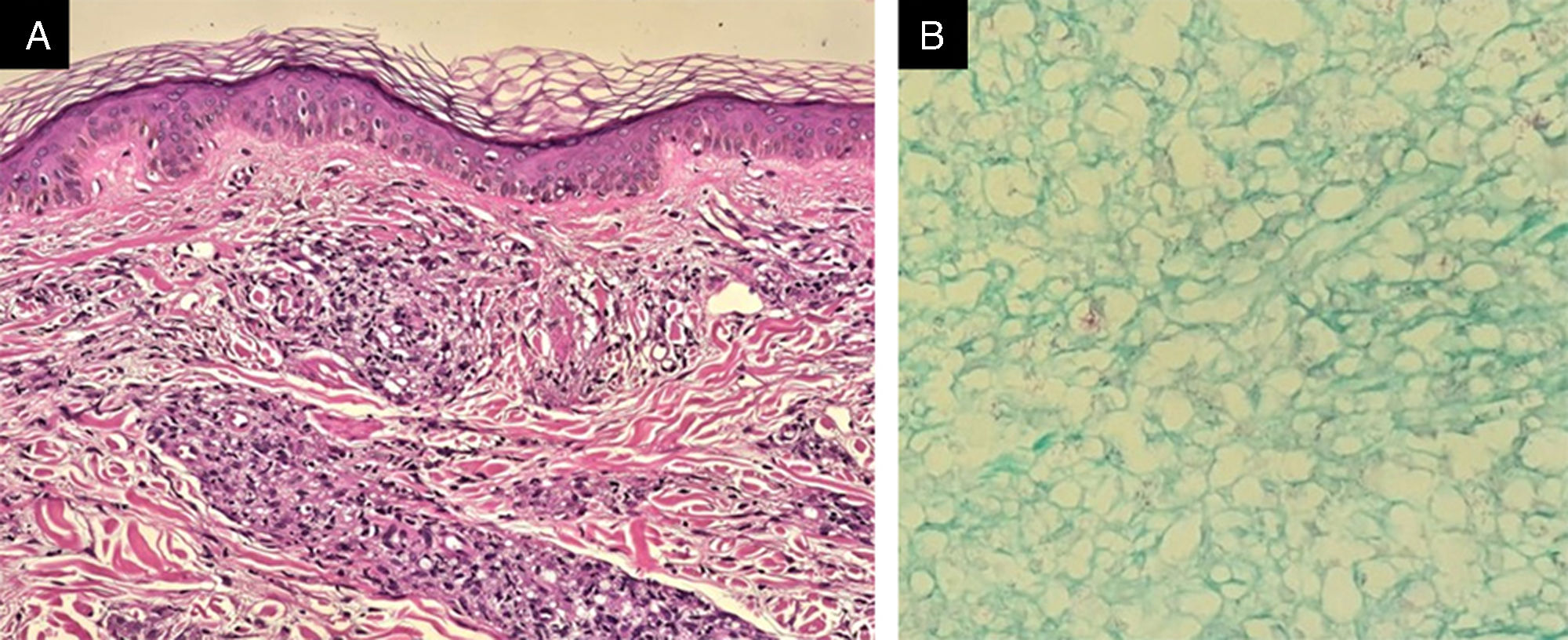
Realizou‐se biopsia da lesão hipocrômica infraescapular, considerada lesão suspeita ao exame físico, e da região perilesional com discreta infiltração. O exame histológico da área hipocrômica evidenciou infiltrado inflamatório perivascular discreto, negativo para bacilos na coloração de Fite‐Faraco. Os achados histológicos da região perilesional infiltrada, no entanto, mostraram presença de retificação epidérmica (faixa de Unna), associada à presença de granulomas malformados perineurais na derme, ricos em histiócitos xantomatosos com inúmeros bacilos, confirmando o acometimento por Mycobacterium leprae (fig. 4), de modo que a mancha hipocrômica evidenciada e suspeita para hanseníase era, na realidade, área de pele com menor comprometimento pelo bacilo quando comparada à área mais gravemente acometida no exame histopatológico.
Biopsia de pele da região adjacente à mancha hipocrômica visualizada nas figuras 2 e 3: à esquerda, presença de faixa de Unna e infiltrado granulomatoso mal delimitado, rico em histiócitos xantomatosos (Hematoxilina & eosina, 100×); à direita, presença de bacilos íntegros e organizados em globias (Fite‐Faraco, 40×).
Investigou‐se a baciloscopia dos pontos‐índice, cujo índice baciloscópico detectado foi 4,4. Firmado o diagnóstico de MH dimorfo‐virchowiana, iniciou‐se tratamento com poliquimioterapia multibacilar (PQT‐MB).
A MH é doença considerada “grande imitadora”, com ampla variedade de manifestações clínicas, podendo representar desafio diagnóstico em determinadas situações.3 Há relatos de MH mimetizando doenças como sarcoidose, linfomas cutâneos, infiltrado linfocítico de Jessner e doenças do tecido conjuntivo.4 A grande variabilidade da apresentação clínica reflete o espectro imunológico do hospedeiro em relação à infecção por M. leprae, podendo apresentar resposta imune de padrão Th1 e Th2 em formas clínicas polares ou ambos os padrões em formas interpolares.5
O envolvimento linfonodal em pacientes hansênicos pode ocorrer como parte do envolvimento visceral em pacientes multibacilares. Histologicamente, o sistema retículo‐endotelial apresenta envolvimento e infiltração por M. leprae em padrão espectral, semelhante ao que ocorre nas lesões da pele. Na MH virchowiana, há envolvimento hepático em 85% dos casos e esplênico em cerca de 41%, semelhante ao que ocorre no caso em questão.6
Há relatos de casos nos quais linfomas simulam MH virchowiana, ou até mesmo há a coexistência de ambas as doenças.4,7,8 Contudo, no caso descrito, a hipótese de linfoma não Hodgkin foi descartada pela ausência de linfocitose atípica no hemograma, bem como no exame histopatológico dos linfonodos acometidos.
Convém lembrar que aproximadamente 1/3 dos pacientes diagnosticados com MH multibacilar pode apresentar reação hansênica tipo II (RR2) no momento do diagnóstico, o que torna necessário excluir a possibilidade de RR2 com infiltração linfonodal nos casos com linfonodomegalia.9 No caso descrito, a ausência de dor, febre, sintomas neurológicos ou lesões típicas de eritema nodoso hansênico levaram à sugestão de provável envolvimento linfonodal em paciente com MH dimorfo‐virchowiana. Ademais, o comprometimento linfonodal na histopatologia não evidencia áreas necróticas ou infiltrado com linfócitos polimorfonucleares, como se costuma observar em pacientes com reação hansênica linfonodal.10 De fato, quatro meses após o início do tratamento, o paciente apresentou o surgimento de nódulos eritematosos difusamente pelo tegumento e sintomas neurológicos (dor importante à palpação dos nervos ulnares bilateralmente e piora do exame estesiométrico palmoplantar), firmando‐se o diagnóstico de RR2.
Em conclusão, é imprescindível o olhar atento do médico para a possibilidade de acometimento pelo bacilo de Hansen em órgãos além da pele e do sistema nervoso periférico. Ressalte‐se, portanto, importância da quebra da cadeia de transmissão, especialmente no diagnóstico de pacientes multibacilares, como o do caso descrito que, após a definição diagnóstica, foi tratado com PQT‐MB.
Suporte financeiroNenhum.
Contribuição dos autoresVictor Henrique Murback dos Reis: Concepção e desenho do estudo; coleta de dados, ou análise e interpretação de dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Anna Carolina Miola: Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Cesar Augusto Zago Ferreira: Concepção e desenho do estudo; coleta de dados, ou análise e interpretação de dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Simone de Pádua Milagres: Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Joel Carlos Lastória: Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Juliano Vilaverde Schmitt: Concepção e desenho do estudo; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Reis VHM, Miola AC, Ferreira CAZ, Milagres SP, Lastória JC, Schmitt JV. Borderline lepromatous leprosy with lymph node infiltration: Dermatology helps helping to clarify challenging diagnoses. An Bras Dermatol. 2025;100:615–8.
Trabalho realizado no Ambulatório de Dermatologia, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.