A psoríase é doença cutaneoarticular de etiologia desconhecida. Acredita‐se que seja doença imunomediada por células T, com predominância de células Th1 e Th17. Semelhante à psoríase, a língua geográfica é doença inflamatória com participação das células Th17 e apresenta relação com a psoríase.
ObjetivoInvestigar as respostas inflamatórias e a via Th17 na psoríase e língua geográfica.
MétodosEstudo transversal, com 46 participantes com diagnóstico clínico de psoríase e língua geográfica. Os participantes foram categorizados em: A) pacientes com psoríase vulgar; B) pacientes com língua geográfica e psoríase vulgar; e C) pacientes com apenas língua geográfica. Todos os pacientes foram submetidos à biópsia de pele e oral para exame histopatológico e análise imuno‐histoquímica com anticorpos anti‐IL6, anti‐IL17 e anti‐IL23.
ResultadosA análise histopatológica das lesões revelou predomínio do infiltrado inflamatório mononuclear. Entretanto, a intensidade moderada prevaleceu nos grupos psoríase vulgar e língua geográfica e psoríase vulgar. A imunopositividade aos anticorpos apresentou um padrão de marcação citoplasmática, predominantemente basal, tanto na psoríase quanto na língua geográfica. Em relação à IL‐6 no psoríase vulgar e língua geográfica, a marcação foi mais intensa do que no grupo de pacientes com apenas língua geográfica. A IL‐17 apresentou uma marcação mais acentuada e extensa quando comparada às demais interleucinas. Na língua geográfica, o padrão de imunorreatividade foi semelhante, porém menos intenso do que na marcação cutânea. A IL‐23 apresentou imunopositividade semelhante entre a língua geográfica e a psoríase.
Limitações do estudoO tamanho da amostra.
ConclusãoA resposta inflamatória e a imunomarcação com as interleucinas 6, 17 e 23 são semelhantes na língua geográfica e na psoríase, reforçam a associação entre essas condições.
A psoríase é doença inflamatória crônica e imunomediada que afeta de 1% a 3% da população mundial.1 Embora sua etiologia seja desconhecida, acredita‐se que seja doença imunológica de base genética, caracterizada pela ativação imunológica inapropriada desencadeada por linfócitos T, predominantemente Th1 e Th17.2,3 As interleucinas (IL) 17 e 23 são responsáveis pelo desenvolvimento e pela manutenção das células Th17, atuam na produção de IL‐22 e IL‐6, que estimulam a proliferação de queratinócitos. Os altos níveis de ILs em lesões de pele de pacientes com psoríase aumentaram o interesse pela atuação da IL‐23 e Th17 na psoríase.2,4,5
A psoríase apresenta expressão variável, de acordo com o componente genético e fatores ambientais, pode afetar outros locais como a mucosa oral.6–8 A lesão oral mais fortemente associada à psoríase é a língua geográfica (LG), caracterizada por áreas irregulares de perda de papilas filiformes, frequentemente circunscritas por uma linha branco‐amarelada.8–10 Assim como a psoríase, a LG é uma doença inflamatória crônica com base genética e imunológica, com envolvimento da IL‐6 e IL‐17 em seu desenvolvimento.10–13
A ocorrência de manifestações orais da psoríase é pouco relatada na literatura e suas semelhanças clínicas, histológicas e imunogenéticas com a LG criam controvérsias sobre a real existência de uma lesão oral causada pela psoríase ou se a LG pode ser um marcador de gravidade da doença de pele, uma vez que essas lesões são mais encontradas na psoríase grave.8,9,14–19 Assim, mais estudos são necessários para melhor compreensão da patogênese e a associação entre essas condições.
O objetivo deste estudo foi investigar e comparar as respostas inflamatórias e a via Th17 por meio da evolução da expressão de IL‐6, IL‐17 e IL‐23 na psoríase e na LG.
MétodosEstudo transversal, com 46 participantes com idade superior a 18 anos, com diagnóstico clínico de psoríase vulgar e LG. Com base em exames dermatológicos e estomatológicos, os participantes foram categorizados em três grupos: A) PV, composto por 11 pacientes com psoríase vulgar; B) PV‐LG, composto por 15 pacientes com LG e psoríase vulgar; e C) NPS, composto por 20 pacientes com LG sem psoríase. Os participantes foram excluídos se tivessem outras doenças de pele, doenças autoimunes, doenças metabólicas, doenças cardiovasculares graves, infecções por vírus da hepatite B ou C ou HIV, uso de medicamentos imunossupressores, alergias ou possibilidade de gravidez no momento da avaliação.
Todos os pacientes foram submetidos à anamnese, exame clínico e biópsia cutânea e oral com punch de 5mm para avaliação histopatológica e análise imuno‐histoquímica com anticorpos anti‐IL6, anti‐IL17 e anti‐IL23. A seleção da área de biópsia foi baseada no exame clínico. Pacientes com psoríase vulgar tiveram a biópsia feita em lesões típicas, que são placas eritematosas‐descamativas bem demarcadas, com escamas prateadas. Pacientes com LG tiveram a biópsia feita em áreas com halo branco e atrofia. Após a remoção cirúrgica, os fragmentos de tecido foram fixados em formaldeído tamponado com fosfato a 10% e incluídos em blocos de parafina. Uma lâmina foi corada com hematoxilina e eosina e preparada para análise histopatológica da resposta inflamatória.
As lâminas coradas com hematoxilina e eosina foram digitalizadas com aumento de 40×com o uso do sistema de ultrarresolução ScanScope® (Aperio Technologies, Ca, EUA) e todas as alterações histológicas foram analisadas e descritas detalhadamente. Fez‐se análise qualitativa e quantitativa, avaliaram‐se o tipo de célula predominante (polimorfonucleares ou mononucleares) e a intensidade do infiltrado inflamatório. Para a classificação da intensidade, todas as lâminas digitalizadas foram analisadas e aquela com infiltrado inflamatório mais intenso foi selecionada. Na amplificação de 40×, a área mais celular foi capturada e as células foram contadas manualmente com uma grade auxiliar, total de 360 células. Desse modo, o número total foi dividido por três e o infiltrado inflamatório da área mais celular foi considerado como leve se abaixo de 120 células, moderado se entre 120 e 240 células e intenso se acima de 240 células.
Posteriormente, fragmentos de tecido em blocos de parafina foram organizados em Tissue Macroarray (TMaA) para feitura de imuno‐histoquímica (IHQ) e posterior análise.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa (02330258000‐10) e todos os participantes assinaram um termo de consentimento.
Construção de tecidos Macroarray (TMaA)Para montar os blocos de TMaA, os blocos de parafina com fragmentos de pele foram agrupados de acordo com o tipo de psoríase. Os fragmentos retirados dos blocos parafinados foram colocados em cassetes identificados e imersos em banho de parafina líquida a 57°C. Moldes metálicos foram preparados para receber os fragmentos identificados. Para isso, uma fina camada de parafina líquida foi colocada em um molde metálico para a adesão do tecido. Após a fixação dos tecidos no molde metálico, com pinças anatômicas, a parafina líquida foi vagarosamente inserida para a construção dos blocos de parafina. Três blocos de parafina de TMaA foram construídos; os blocos de parafina doadora. Para cada bloco de parafina, secções de 5 μm foram coletadas em lâminas de vidro carregadas positivamente para IHC.20
Imuno‐histoquímicaA expressão de IL‐6, IL‐17 e IL‐23 foi demonstrada imuno‐histoquimicamente pela técnica de imunoperoxidase. Os anticorpos primários usados foram: anticorpo monoclonal de rato anti‐IL6 humana (Abcam, ab9324; EUA; diluição 1:8000), anticorpo monoclonal de rato anti‐IL17 humana (Abcam, ab79056; USA; diluição 1:1500) e anticorpo monoclonal de rato anti‐IL23 humana (Abcam, ab115759; EUA, diluição 1:1000). Após desparafinização e reidratação, a atividade da peroxidase endógena foi bloqueada com peróxido de hidrogênio a 3% por 30 minutos. A recuperação antigênica foi feita com tampão citrato (pH 6,0) em banho‐maria (96°C) por 40 minutos. A ligação proteica não específica foi bloqueada com bloqueio proteico sem soro (durante 15 minutos). As secções foram incubadas por 10 horas em câmara úmida a 4°C com os anticorpos primários. As lâminas foram subsequentemente incubadas com Dako EnVision+Dual Link System‐HRP (Dako, K4061; EUA) durante 30min. A visualização foi feita por incubação durante 3 minutos no sistema cromogênico líquido 3,3’diaminobenzidina (Dako, K3468;). As seções foram contrastadas com a hematoxilina de Harris. Um fragmento de amígdala foi usado como controle positivo para anticorpo anti‐IL‐6, linfonodo para anti‐IL‐17 e rim para anti‐IL‐23. Controles negativos foram feitos por omissão do anticorpo primário.
Análise imuno‐histoquímicaImagens temporárias digitais de lâminas de TMaA coradas com IHC foram obtidas em aumento de 40×com o scanner Aperio CS2 (Leica Biosystems, EUA). Depois disso, as seções foram visualizadas pelo software ImageScope™ (Leica Biosystems, EUA) com a análise subsequente de todos os fragmentos. A expressão proteica IL‐6, IL‐17 e IL‐23 foi demonstrada pela marcação citoplasmática positiva nos queratinócitos, células inflamatórias, células endoteliais e fibroblastos. A análise imuno‐histoquímica foi feita de maneira qualitativa e quantitativa, considerou o padrão, a localização, intensidade e extensão da marcação. Áreas inadequadas para análise, como dobras teciduais e outros artefatos, foram excluídas.
Análise estatísticaTodos os testes estatísticos foram feitos no SPSS (Statistical Package for the Social Sciences, 22.0). As variáveis categóricas foram descritas por meio de proporções e as variáveis numéricas como mediana, média, desvio‐padrão (DP) e intervalo. Para avaliar a diferença entre duas ou mais variáveis categóricas, foi aplicado o teste exato de Fisher. O nível de significância estatística estabelecido para todas as análises foi de 5% (p <0,05).
ResultadosA idade dos 46 participantes incluídos neste estudo variou entre 18 e 85 anos, com média de 52 (DP=15), mostrou‐se uma leve preferência pelo sexo feminino com 27 (58%) casos.
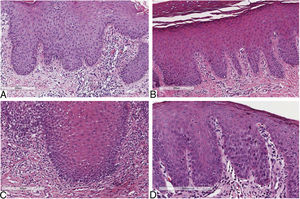
Considerando‐se lesões de pele de pacientes psoriásicos, o infiltrado inflamatório superficial foi predominantemente mononuclear em 100% dos casos. A intensidade do infiltrado variou entre os pacientes, foi moderada em seis (54%), leve em três (37%) e intensa em dois (19%). A análise comparativa dos critérios histológicos entre LG e lesões cutâneas em pacientes com e sem psoríase revelou que ambas as lesões apresentavam infiltrado inflamatório predominantemente mononuclear. No entanto, a intensidade moderada predominou em pacientes com LG e psoríase e pacientes com psoríase exclusivamente; p=0,078 (tabela 1) (fig. 1).
Aspectos histopatológicos das lesões orais e cutâneas dos pacientes com língua geográfica, língua geográfica com psoríase e apenas psoríase
| Aspectos histopatológicos | Língua geográfica sem psoríase, n=20 (%) | Língua geográfica com psoríase, n=15 (%) | Psoríasen=11 (%) | pa |
|---|---|---|---|---|
| Infiltrado inflamatório superficial | – | – | – | 0,514 |
| Mononuclear | 19 (95%) | 15 (100%) | 11 (100%) | |
| Polimorfonuclear | 1 (5%) | – | – | |
| Intensidade do infiltrado inflamatório | – | – | – | 0,078 |
| Leve | 9 (45%) | 2 (13%) | 3 (27%) | |
| Moderado | 5 (25%) | 11 (74%) | 6 (55%) | |
| Intenso | 6 (30%) | 2 (13%) | 2 (18%) |
A imunomarcação dos três anticorpos (anti‐IL6, anti‐IL17 e anti‐IL23) apresentou padrão de coloração citoplasmático semelhante, predominaram basal e parabasal, tanto na LG quanto na psoríase. Quando a camada basal foi significativamente mais hiperplásica, a coloração foi mais proeminente e extensa. O infiltrado inflamatório mononuclear mostrou o mesmo padrão de coloração para todos os anticorpos usados.
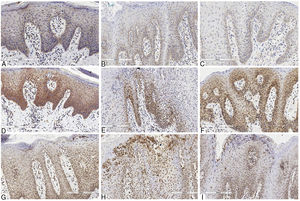
Em relação à IL‐6, na lesão cutânea houve imunopositividade no terço basal do epitélio, proporcional à hiperplasia da camada basal. A coloração epitelial foi mais forte nas regiões com hiperceratose mais intensa. A imunopositividade na derme foi observada no infiltrado inflamatório mononuclear, principalmente nos linfócitos, assim como no endotélio. A coloração foi mais intensa na LG de pacientes com psoríase do que naqueles sem psoríase. Isso pode ser porque a primeira apresentava hiperplasia da camada basal mais proeminente, semelhantemente ao padrão da pele (fig. 2).
Aspectos imuno‐histoquímicos das interleucinas na psoríase e língua geográfica: interleucina 6 – A, Psoríase; B, Língua geográfica em paciente psoriásico; C, Língua geográfica. Interleucina 17 – D, Psoríase; E, Língua geográfica em paciente psoriásico; F, Língua geográfica. Interleucina 23 – G, Psoríase; H, Língua geográfica em paciente psoriásico; I, Língua geográfica.
A IL‐17 apresentou coloração mais evidente e extensa quando comparada às outras interleucinas avaliadas. Nas lesões de pele houve imunopositividade nos dois terços inferiores da epiderme, embora algumas áreas apresentassem extensão à camada superficial devido à hiperplasia intensa. O padrão de coloração foi mais homogêneo, intenso e extenso em todos os fragmentos quando comparado à coloração anti‐IL6. Na LG de pacientes com psoríase, o padrão de imunomarcação foi semelhante ao encontrado na LG de pacientes não afetados pela psoríase. No entanto, essa coloração foi menos intensa do que nas lesões de pele e não houve diferença significativa entre os dois padrões, como foi encontrado para a coloração de IL‐6. Na LG de pacientes não psoriásicos, o padrão de imunomarcação encontrado foi mais semelhante aos encontrados em lesões de pele (fig. 2).
A IL‐23 apresentou imunopositividade basal e suprabasal nas lesões cutâneas, estendeu‐se às camadas superficiais do epitélio e mais intensa e extensa do que a IL‐6. Os neutrófilos infiltrados no epitélio (microabscessos de Munro) também foram corados com esse anticorpo. Na derme, houve positividade no infiltrado mononuclear e no endotélio, semelhante aos outros anticorpos usados. Na LG de pacientes com psoríase ou não, o padrão de coloração foi o mesmo encontrado nas lesões da psoríase, com predomínio basal e suprabasal, mais intenso e extenso do que a IL‐6, e neutrófilos no epitélio também corados, porém menos intensos do que na coloração da pele (fig. 2).
DiscussãoA psoríase é doença cutânea e articular comum, imunologicamente mediada e desencadeada por linfócitos T, com produção de citocinas dos tipos Th1 e Th17.1,3 A via Th17 tem sido associada à imunopatogênese da psoríase e outras doenças imunomediadas, como a LG.13 Autores sugerem uma associação entre essas duas condições. Além da alta prevalência em pacientes psoriásicos, a LG apresenta similaridades clínicas, etiológicas, microscópicas e genéticas com a psoríase.8,9,14–19 Como alguns pacientes apresentam LG mas não apresentam psoríase, é difícil para alguns autores aceitar essa condição bucal como manifestação da psoríase.18,21–23 Além disso, existem poucos estudos com aspectos histológicos e imuno‐histoquímicos da LG e sua correlação com a doença de pele. Na literatura revisada, não houve estudos que avaliaram aspectos inflamatórios da LG em comparação com a psoríase.
Os achados microscópicos da psoríase são muito característicos, tais como: aumento regular da camada espinhosa com espessamento das porções inferiores; espessamento e inchaço das papilas; paraqueratose; ausência de camada granular; presença de microabscessos de Munro; hipotrofia suprapapilar que ocasionalmente apresentava uma pequena pústula espongiforme; e infiltração de células inflamatórias, principalmente linfócitos T, macrófagos e neutrófilos, na derme e na submucosa.8,24,25 Tais características também podem ser encontradas na LG.8,26 Nosso estudo propõe uma análise comparativa focada na resposta inflamatória em que o tipo e a intensidade do infiltrado inflamatório foram avaliados em LG e psoríase. Ambas as condições apresentaram predomínio do infiltrado inflamatório mononuclear, foi prevalente a moderada intensidade na psoríase e LG de pacientes com psoríase. O infiltrado inflamatório tem sido destacado na psoríase e é particularmente composto por linfócitos T.27 Além disso, não encontramos estudos que apresentassem essa análise na literatura levantada.
Femiano (2001) fez avaliação histológica, comparou as lesões da LG em pacientes psoriásicos e não psoriásicos. O primeiro grupo apresentou análises histologicamente compatíveis com psoríase. No último grupo, as mesmas características foram observadas em 80% dos indivíduos. Assim, o autor considerou a LG uma manifestação oral da psoríase, mas sugere a possibilidade de ter outro tipo de LG não associado à psoríase.26 Embora as diferenças histológicas encontradas no presente estudo sejam discretas, corrobora a teoria formulada por Femiano (2001) de outro tipo de LG em pacientes não psoriásicos.
A análise imuno‐histoquímica foi direcionada à imunorreatividade dos anticorpos anti‐IL6, anti‐IL17 e anti‐IL23 em LG e psoríase. No presente estudo, essa análise evidenciou semelhança na distribuição e quantidade de células imunopositivas na pele e nas lesões orais, reforçou a associação entre elas.
Goodman et al. (2000) avaliaram a expressão de IL‐6 em tecidos psoriásicos lesionados, não lesionados e normais, revelaram maior expressão na pele psoriásica lesionada do que em áreas não lesionadas e em pele normal. Além disso, observou‐se predominância de IL‐6 nas papilas, no plexo vascular superficial e nos queratinócitos epidérmicos.28 Grossman et al. (1989) evidenciaram imunorreatividade para anti‐IL6 em queratinócitos, células endoteliais e na maior parte do infiltrado dérmico da psoríase em placa. Houve marcação citoplasmática em todos os casos e, em alguns casos, houve também marcação nuclear e de membrana. Os queratinócitos da camada basal foram mais intensamente marcados que os da camada espinhosa.29 Nosso estudo revelou semelhanças entre os três grupos, que apresentaram o mesmo padrão de imunopositividade nas células endoteliais, queratinócitos e infiltrado inflamatório dérmico, exibiram marcação citoplasmática, predominantemente na região basal e camadas suprabasais. Alikhani et al. (2014) analisaram a concentração de TNF‐α e IL‐6 na saliva de pacientes com LG e mostraram um aumento significativo dessas citocinas nessa lesão. Os autores concluíram que a LG é uma condição inflamatória e imunomediada, reforçaram sua associação com a psoríase.11
Cerca de 15 anos atrás, a expressão de IL‐17 foi detectada em fragmentos de pele de pacientes psoriásicos, enquanto não foi evidenciada em tecidos controles normais, sugeriu o envolvimento de IL‐17 na imunopatogênese da psoríase.30 A IL‐17 é a citocina homônima produzida pelos subgrupos Th17 de linfócitos T.4,30
Li Zhang et al. (2010) fizeram análise imuno‐histoquímica da IL‐17 em 24 fragmentos de pele com psoríase, confirmaram que essa interleucina foi significativamente maior nesses pacientes do que em indivíduos saudáveis, foi correlacionada à gravidade da doença. Este estudo indica a IL‐17 como uma citocina pró‐inflamatória capaz de amplificar o desenvolvimento de inflamação cutânea e manter o suporte da dermatite crônica por meio da estimulação de queratinócitos.31 Nosso estudo demonstrou que a IL‐17 está presente em grande número no infiltrado inflamatório mononuclear, além da imunopositividade nos queratinócitos basais e suprabasais das áreas de hiperplasia epitelial e endotélio vascular. Isso ocorre porque os queratinócitos fazem parte do sistema imune e também das células endoteliais, desempenham um papel central na ativação de vias envolvidas na imunopatogênese da psoríase, atuam primeiramente como um antígeno que se apresenta aos linfócitos T.32–34 Aqui, o mesmo que em psoríase, a coloração intensa de IL‐17 na LG demonstra que essa interleucina também está envolvida na patogênese dessa lesão oral. Baron (2017) relatou um caso de LG associada à acrodermatite contínua de Hallopeau com bom resultado para o secukinumab, um anticorpo monoclonal seletivo anti‐IL17A.13 Esse achado corrobora com a teoria de que a IL‐17 está envolvida em ambas as condições.
Em relação à IL‐23, é citocina‐chave envolvida na resposta imune protetora contra infecções bacterianas e fúngicas, embora sua produção descontrolada também possa promover autoimunidade inflamatória.2,35 Estudos laboratoriais identificaram o eixo IL‐23/IL‐17 como via primária de sinalização que leva a mudanças características moleculares, celulares e estruturais na pele psoriásica. Na presença de IL‐23, secretada principalmente por células dendríticas dérmicas inflamatórias (DCs), as células Th17 aumentam em número e produzem grandes quantidades de IL‐17, que impulsionam a regulação positiva de muitos genes relacionados à psoríase produzidos pelos queratinócitos epidérmicos. Além das CDs dérmicas, os queratinócitos epidérmicos e os macrófagos dérmicos também produzem IL‐23 e podem contribuir para a patogênese e a manutenção das lesões psoriásicas. Novos resultados de pesquisas indicam que a IL‐23 é uma das citocinas mais importantes na patogênese da psoríase.2,35 Song et al. (2016) mostraram, por imuno‐histoquímica, que as expressões de IL‐23 e IL‐17 foram observadas na epiderme e área dérmica perivascular na psoríase, sugeriram que essas interleucinas desempenham um papel importante nessa doença.36 No presente estudo, pudemos observar uma coloração mais intensa da IL‐17; no entanto, a IL‐23 também mostrou coloração semelhante, confirmou a ligação entre essas duas interleucinas. Em resposta à IL‐23, essas células Th17 criam um ambiente imunológico que desencadeia a hiperproliferação de queratinócitos e leva ao recrutamento de outras células imunes.1,35 Além disso, demonstramos pela primeira vez o envolvimento dessa interleucina em LG e a coloração de neutrófilos com IL‐23, principalmente nas áreas de microabscessos de Munro. Foi descrito que os neutrófilos na fase inicial da lesão psoriásica atingem a epiderme, constituem o microabscesso de Munro. Os neutrófilos são conhecidos por sua produção relevante de mediadores pró‐inflamatórios e, uma vez que essas células expressam o receptor de IL‐17, a IL‐17 pode representar um sinal importante de autoamplificação autócrina. Além disso, os neutrófilos respondem à IL‐23, o que leva a um aumento do número de neutrófilos IL‐17+e IL‐23+na psoríase.2
ConclusãoNosso estudo mostra que a resposta inflamatória e a imunomarcação das interleucinas 6, 17 e 23 são frequentemente similares tanto na LG quanto na psoríase, reforça a possibilidade de haver um tipo de LG que represente uma manifestação oral da psoríase. Portanto, a via Th17 parece desempenhar um papel central na LG, independentemente da presença de psoríase. Mais estudos são necessários para uma melhor compreensão do papel da via Th17 na patogênese da LG.
Suporte financeiroCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes). Fundo de Apoio à Dermatologia (FUNADERM) da Sociedade Brasileira de Dermatologia/Brazilian Society of Dermatology.
Contribuição dos autoresBruna Lavinas Sayed Picciani: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Tábata Alves Domingos: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Thays Teixeira‐Souza: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Anna Karoline Fausto‐Silva: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Eliane Pedra Dias: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Sueli Carneiro: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Os autores querem agradecer às agências CAPES e FUNADERM ‐ Sociedade Brasileira de Dermatologia pelo apoio financeiro.
Como citar este artigo: Picciani BLS, Domingos TA, Teixeira‐Souza T, Fausto‐Silva AK, Dias EP, Carneiro S. Evaluation of Th17 pathway in the psoriasis and geographic tongue. An Bras Dermatol. 2019;94:677–83.
Trabalho realizado no Programa de Pós‐graduação em Patologia, Faculdade de Medicina, Universidade Federal Fluminense, Niterói, RJ, Brasil.