Juntamente com o aumento da administração de vacinas contra COVID‐19, nos últimos meses, a detecção de possíveis reações cutâneas adversas aumentou, destacando a possibilidade de que não apenas a infecção por SARS‐CoV‐2, mas também as vacinas contra COVID‐19 possam induzir manifestações cutâneas.1,2 A esse respeito, reações de hipersensibilidade do tipo I (p. ex., urticária, angioedema e anafilaxia) e reações de hipersensibilidade do tipo IV (p. ex., reações inflamatórias no local da injeção, erupções cutâneas morbiliformes e semelhantes a eritema multiforme) são as mais comumente observadas; também foram observadas reações semelhantes a pitiríase rósea, reativações de herpes‐zóster e angiopatias funcionais (p. ex., lesões semelhantes a frieiras e eritromelalgia).2 Por outro lado, há dados muito limitados sobre doenças cutâneas autoimunes após a vacina contra SARS‐CoV‐2.2 Que seja de conhecimento dos autores, embora existam poucos casos de morfeia induzida pela infecção por COVID‐19 descritos na literatura, é relatado aqui o primeiro caso de morfeia generalizada induzida por uma vacina de mRNA contra a COVID‐19.4
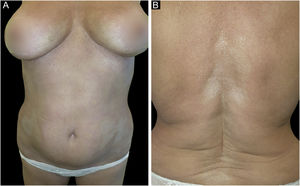
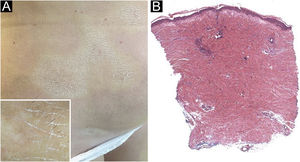
A paciente do sexo feminino, 61 anos, caucasiana, procurou o serviço de dermatologia com história de 10 placas simétricas, esbranquiçadas, xeróticas e escleróticas, com três meses de evolução, com diâmetro variando entre 5 e 12cm, localizadas na região abdominal, membros inferiores, dorso e membros superiores (figs. 1A‐B e 2A). A dermatoscopia de uma das lesões mostrou proeminentes feixes fibróticos esbranquiçados (fig. 2A). A história familiar e pessoal da paciente era negativa para doenças autoimunes e inflamatórias crônicas da pele. Ela nunca havia apresentado fenômeno de Raynaud, não apresentava esclerodactilia, nem acometimento facial ou acometimento de pregas ungueais. A paciente relatou que as primeiras lesões surgiram na região abdominal 15 dias após a primeira dose da vacina Comirnaty‐Pfizer® SARS‐CoV‐2, e as lesões cresceram em número e tamanho 15 dias após a segunda dose da vacina. As lesões cutâneas surgiram inicialmente como placas eritematosas e pruriginosas, tornando‐se posteriormente esbranquiçadas e escleróticas. Foi realizada biópsia cutânea de uma lesão no abdome. A histopatologia mostrou espessamento e hialinização do tecido conjuntivo da derme profunda e gordura subcutânea, com atrofia das estruturas anexiais, aumento de fibroblastos e colágeno denso na derme profunda (fig. 2B). As investigações laboratoriais mostraram presença de anticorpos antinucleares (1:160 em padrão homogêneo), presença de anticorpos contra o domínio de ligação ao receptor SARS‐CoV‐2 em 113 U/mL (valores normais: <80 U/mL), enquanto anticorpos para antígenos nucleares extraíveis foram negativos. Com base na correlação clinicopatológica, estabeleceu‐se diagnóstico final de morfeia generalizada (MG) e foi iniciada terapia com creme de propionato de clobetasol a 0,05%, associada a tratamento sistêmico com metotrexato 7,5mg/semana, com dose única de 5mg de ácido fólico, 1 ×/semana.
Placas esbranquiçadas e escleróticas localizadas no abdome e região inguinal. (A) Detalhe inferior esquerdo: dermatoscopia evidenciando feixes fibróticos esbranquiçados proeminentes e perda de pelos na área afetada. (B) Histopatologia exibindo espessamento e hialinização do tecido conjuntivo da derme profunda e hipoderme, com atrofia das estruturas anexiais, aumento de fibroblastos e colágeno denso na derme profunda (Hematoxilina & eosina, 50×).
A MG é caracterizada por mais de quatro placas, medindo pelo menos 3cm, que envolvem duas ou mais regiões anatômicas e difere da esclerodermia pela ausência de fenômeno de Raynaud, esclerodactilia, envolvimento facial, envolvimento de pregas ungueais e autoanticorpos específicos.3 No presente caso, o início da MG pode ser justificado pelo fato de que as vacinas podem ocasionalmente causar um novo surto de doenças autoimunes. De fato, a proteína spike da vacina SARS‐CoV‐2 compartilha semelhanças genéticas com proteínas humanas, e é fator importante que pode desencadear doenças autoimunes após a vacinação em decorrência do mimetismo molecular e da geração de linfócitos autorreativos.2 Ao mesmo tempo, embora o aparecimento de doenças cutâneas após vacinas contra a COVID‐19 possa representar associação de causalidade, o número muito grande de casos que receberam vacinas SARS‐CoV‐2 durante os últimos meses pode induzir a vieses,2 associando também com vacinas manifestações cutâneas que poderiam ter ocorrido independentemente. Desse modo, este é um dos poucos casos de MG surgindo após a vacina SARS‐CoV‐2, e outros casos são necessários para avaliar melhor a possível associação de MG com essa vacinação. O relato de possíveis efeitos colaterais das vacinas contra a COVID‐19 é importante para a prática clínica diária; ao mesmo tempo, até o momento, as vacinas contra a COVID‐19 mantêm alto perfil de segurança e, portanto, a população não deve ser desencorajada a se vacinar.
Suporte financeiroNenhum.
Contribuição dos autoresGiovanni Paolino: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Matteo Ricardo Di Nicola: Redação do manuscrito ou revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Nathalie Rizzo: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Santo Raffaele Mercuri: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; aprovação da versão final do manuscrito.
Nathalie Rizzo e Santo Raffaele Mercuri dividem a coautoria final.
Conflito de interessesNenhum.