O penfigoide bolhoso (PB) é uma doença autoimune cutânea grave associada a diferentes comorbidades, como doenças neurológicas, hipertensão e diabetes mellitus. Recentemente, o uso de inibidores da dipeptidil peptidase‐4/gliptinas (DPP4i) para controlar a hiperglicemia foi associado ao aumento da prevalência de diabetes mellitus tipo 2 (DM2) em pacientes com PB recém‐diagnosticado,1 demonstrando que a associação de diferentes medicamentos a certas comorbidades pode ser parcialmente responsável pela relação observada de algumas comorbidades com o PB. Consequentemente, perguntamos se os medicamentos utilizados para tratar outras comorbidades podem ter modificado o risco de desenvolver PB nesse cenário. Este é o relato dos achados sobre a associação de PB com medicamentos não antidiabéticos utilizados no momento do diagnóstico de PB em uma coorte de centro único de pacientes idosos (≥ 70 anos) com DM2 tratados com DPP4i.
A coorte de PB consistiu em 45 pacientes com DM2 em tratamento com DPP4i com PB recém‐diagnosticado após janeiro de 2010. Os critérios diagnósticos para PB são apresentados na tabela 1.1 Todos os pacientes com PB nesta coorte foram tratados uniformemente, de acordo com a diretriz institucional, com a descontinuação da DPP4i e a combinação de corticosteroides sistêmicos em doses progressivamente reduzidas e metotrexato, utilizado como agente poupador de corticosteroide. Os controles incluíam 98 pacientes idosos com DM2 sem PB tratados com DPP4i por pelo menos os últimos 30 meses antes da inclusão no estudo, pareados em uma proporção de 1:2 por sexo, idade (dentro de 2 anos) e ano de diagnóstico. Utilizando o software SPSS, as variáveis categóricas foram comparadas com o teste χ2, e os odds ratios de risco proporcionais de Cox e de Mantel‐Haenszel (OR ± IC95%) foram calculados entre pacientes com e sem PB ao nível de p < 0,05. Os achados fazem parte de um estudo retrospectivo aprovado pelo Comitê de Ética e Pesquisa da instituição.
Critérios para o diagnóstico de penfigoide bolhoso (PB)
| Todos os três critérios devem ser atendidos: |
| (a) Apresentação clínica relevante |
| (b) Biópsia de pele com lesão consistente com PB |
| (c) Um resultado consistente com o diagnóstico de PB em pelo menos um dos seguintes exames laboratoriais rotineiramente disponíveis: imunofluorescência direta, imunofluorescência indireta ou ELISA |
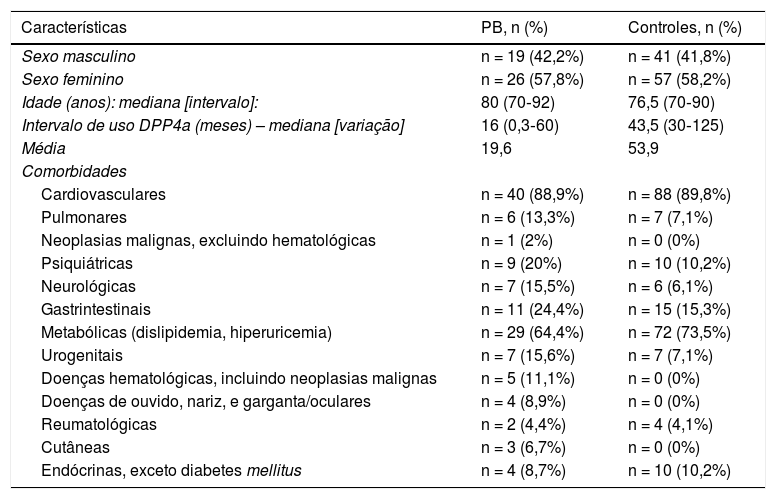
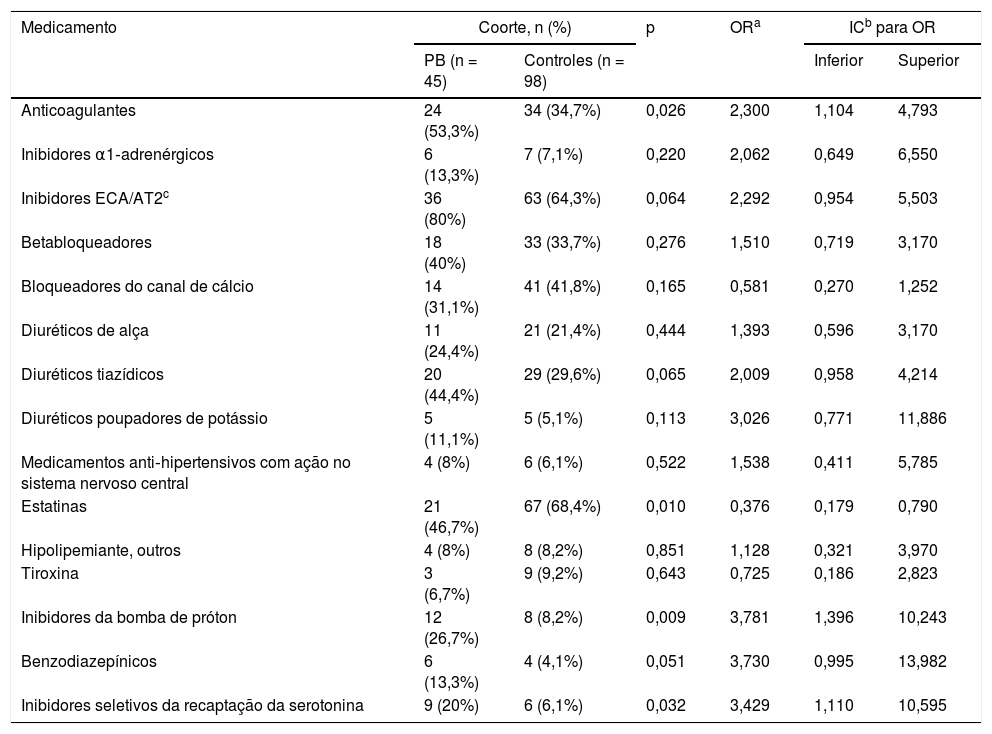
O espectro da DPP4i empregada não diferiu entre os pacientes com e sem PB (p = 0,06). Os principais dados demográficos e de histórico médico dos pacientes com PB e controles estão resumidos na tabela 2. Os grupos de medicamentos foram incluídos na análise quando pelo menos 10/143 pacientes estavam em tratamento regular utilizando medicamentos de cada grupo. Avaliando esses grupos juntos, um risco significantemente maior de PB foi encontrado para pacientes em uso de anticoagulantes, inibidores da bomba de prótons e inibidores seletivos da recaptação da serotonina, enquanto o risco de PB foi significantemente menor para aqueles com DM2 em uso de estatinas (tabela 3). Além disso, a relação da ingestão de estatina com um risco reduzido de PB foi a única associação que permaneceu significativa após a concentração da análise nos quatro grupos de medicamentos acima (HR de Cox = 0,165; IC95% = 0,038‐0,723; p = 0,017). A principal limitação deste estudo é o número relativamente pequeno de participantes; entretanto, as coortes eram razoavelmente homogêneas, com um número evidente de pacientes com PB incluídos.
Principais características demográficas e dados da história da doença de pacientes com penfigoide bolhoso (PB) (n = 45) e controles (n = 48)
| Características | PB, n (%) | Controles, n (%) |
|---|---|---|
| Sexo masculino | n = 19 (42,2%) | n = 41 (41,8%) |
| Sexo feminino | n = 26 (57,8%) | n = 57 (58,2%) |
| Idade (anos): mediana [intervalo]: | 80 (70‐92) | 76,5 (70‐90) |
| Intervalo de uso DPP4a (meses) – mediana [variação] | 16 (0,3‐60) | 43,5 (30‐125) |
| Média | 19,6 | 53,9 |
| Comorbidades | ||
| Cardiovasculares | n = 40 (88,9%) | n = 88 (89,8%) |
| Pulmonares | n = 6 (13,3%) | n = 7 (7,1%) |
| Neoplasias malignas, excluindo hematológicas | n = 1 (2%) | n = 0 (0%) |
| Psiquiátricas | n = 9 (20%) | n = 10 (10,2%) |
| Neurológicas | n = 7 (15,5%) | n = 6 (6,1%) |
| Gastrintestinais | n = 11 (24,4%) | n = 15 (15,3%) |
| Metabólicas (dislipidemia, hiperuricemia) | n = 29 (64,4%) | n = 72 (73,5%) |
| Urogenitais | n = 7 (15,6%) | n = 7 (7,1%) |
| Doenças hematológicas, incluindo neoplasias malignas | n = 5 (11,1%) | n = 0 (0%) |
| Doenças de ouvido, nariz, e garganta/oculares | n = 4 (8,9%) | n = 0 (0%) |
| Reumatológicas | n = 2 (4,4%) | n = 4 (4,1%) |
| Cutâneas | n = 3 (6,7%) | n = 0 (0%) |
| Endócrinas, exceto diabetes mellitus | n = 4 (8,7%) | n = 10 (10,2%) |
Medicamentos em pacientes com penfigoide bolhoso associado ao uso de DPP4i e em pacientes sem PB, com uso de DPP4i
| Medicamento | Coorte, n (%) | p | ORa | ICb para OR | ||
|---|---|---|---|---|---|---|
| PB (n = 45) | Controles (n = 98) | Inferior | Superior | |||
| Anticoagulantes | 24 (53,3%) | 34 (34,7%) | 0,026 | 2,300 | 1,104 | 4,793 |
| Inibidores α1‐adrenérgicos | 6 (13,3%) | 7 (7,1%) | 0,220 | 2,062 | 0,649 | 6,550 |
| Inibidores ECA/AT2c | 36 (80%) | 63 (64,3%) | 0,064 | 2,292 | 0,954 | 5,503 |
| Betabloqueadores | 18 (40%) | 33 (33,7%) | 0,276 | 1,510 | 0,719 | 3,170 |
| Bloqueadores do canal de cálcio | 14 (31,1%) | 41 (41,8%) | 0,165 | 0,581 | 0,270 | 1,252 |
| Diuréticos de alça | 11 (24,4%) | 21 (21,4%) | 0,444 | 1,393 | 0,596 | 3,170 |
| Diuréticos tiazídicos | 20 (44,4%) | 29 (29,6%) | 0,065 | 2,009 | 0,958 | 4,214 |
| Diuréticos poupadores de potássio | 5 (11,1%) | 5 (5,1%) | 0,113 | 3,026 | 0,771 | 11,886 |
| Medicamentos anti‐hipertensivos com ação no sistema nervoso central | 4 (8%) | 6 (6,1%) | 0,522 | 1,538 | 0,411 | 5,785 |
| Estatinas | 21 (46,7%) | 67 (68,4%) | 0,010 | 0,376 | 0,179 | 0,790 |
| Hipolipemiante, outros | 4 (8%) | 8 (8,2%) | 0,851 | 1,128 | 0,321 | 3,970 |
| Tiroxina | 3 (6,7%) | 9 (9,2%) | 0,643 | 0,725 | 0,186 | 2,823 |
| Inibidores da bomba de próton | 12 (26,7%) | 8 (8,2%) | 0,009 | 3,781 | 1,396 | 10,243 |
| Benzodiazepínicos | 6 (13,3%) | 4 (4,1%) | 0,051 | 3,730 | 0,995 | 13,982 |
| Inibidores seletivos da recaptação da serotonina | 9 (20%) | 6 (6,1%) | 0,032 | 3,429 | 1,110 | 10,595 |
A ingestão de estatinas pode diminuir o risco de desenvolver PB em pacientes com DM2 tratados com DPP4i, modificando certos processos inflamatórios, provavelmente promovendo uma mudança anti‐inflamatória por meio da inibição das células Th17 e da produção de IL‐17.2 Por exemplo, em um modelo animal de asma alérgica, a sinvastatina modificou o influxo de células inflamatórias, incluindo eosinófilos e Treg, nos tecidos‐alvo.3 Recentemente, Guo et al.4 relataram uma associação significativamente aumentada do uso de espironolactona com o risco de desenvolver PB em pacientes tratados com DPP4i, mesmo após o ajuste para fatores de confusão (HR = 5,50; IC95% = 1,25‐7,51). Notavelmente, embora não tenha sido avaliado especificamente o efeito da espironolactona, não foi possível confirmar um risco maior de PB em pacientes tratados com qualquer diurético poupador de K (tabela 3). É possível que a variação de fatores genéticos em populações remotas (como pacientes coreanos vs. gregos), incluindo diferenças na suscetibilidade de PB e/ou farmacogenômica divergente, possam explicar as diferenças na suscetibilidade da associação de certos medicamentos ao desenvolvimento de PB.
Foi sugerido que o PB induzido por DPP4i pode se tornar uma doença modelo para o melhor entendimento dos princípios básicos da autoimunidade.5 Tentar esclarecer o papel de outros medicamentos no desencadeamento de PB em pacientes com DM2 tratados com DPP4i em estudos prospectivos com amostras de pacientes suficientemente grandes poderá fornecer contribuições essenciais para delinear os pontos ainda não esclarecidos na patogênese dessa doença.
Suporte financeiroNenhum.
Contribuição dos autoresAgoritsa Gravani e Ioannis Bassukas foram responsáveis pelo desenho do estudo.
Agoritsa Gravani, Panagiota Christou e Stelios Tigas coletaram os dados. Todos os autores contribuíram para a análise dos dados.
Agoritsa Gravani foi responsável pela 1ª versão do manuscrito; todos os autores revisaram criticamente e aprovaram a versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Gravani A, Christou P, Tigas S, Bassukas ID. Co‐medications and dipeptidyl peptidase‐4 inhibitors associated bullous pemphigoid. An Bras Dermatol. 2021;96:782–4.
Trabalho realizado no University Hospital of Ioannina, Ioannina, Grécia.