O melanoma cutâneo é neoplasia com alta taxa de mortalidade e risco de metástases para órgãos à distância. A medida micrométrica de Breslow é considerada o mais importante fator para avaliação de prognóstico e conduta, mensurada a partir da camada granulosa até a porção mais profunda da neoplasia. Apesar de sua ampla utilização, a medida da espessura de Breslow apresenta algumas imprecisões, como não considerar as variações da espessura da epiderme nas diferentes localizações do corpo ou quando há ulceração.
ObjetivoAvaliar a aplicabilidade de medida de Breslow modificada, mensurada a partir da membrana basal em vez da camada granulosa, na tentativa de predizer o resultado do linfonodo sentinela e da sobrevida dos pacientes com melanoma.
MétodosFoi realizada análise retrospectiva e transversal com base na avaliação de lâminas coradas pela hematoxilina & eosina de 275 casos de melanoma submetidos à biopsia de linfonodo sentinela de 2008 a 2021 em um centro de referência no Brasil.
ResultadosAnálise do modelo de Cox para avaliar o impacto da espessura de Breslow e da espessura de Breslow modificada na sobrevida revelaram que ambos os métodos são estatisticamente significantes. A regressão logística revelou associação significante entre ambas as mensurações e a presença de metástase em linfonodos sentinelas.
ConclusãoA medida da profundidade do melanoma a partir da membrana basal (medida de Breslow modificada) é capaz de predizer o tempo de sobrevida e o resultado do linfonodo sentinela, assim como a espessura de Breslow convencional.
O melanoma cutâneo é neoplasia que surge de melanócitos e, em estádio avançado, frequentemente leva a metástases para órgãos distantes.1 A incidência de melanoma tem aumentado nas últimas décadas em populações de pele clara, provavelmente relacionada ao comportamento recreacional e exposição solar. Acredita‐se que ele surja como consequência de uma complexa interação de fatores ambientais e constitucionais.2
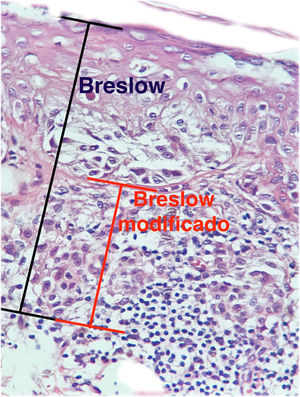
A profundidade de invasão como fator prognóstico foi reportada por Alexander Breslow em 1970, que demonstrou correlação da espessura do melanoma com risco de recorrência e metástase.3,4 A medida micrométrica de Breslow tornou‐se o fator mais importante para prognóstico e conduta, utilizado amplamente e correspondendo ao principal fator para os sistemas de estadiamento, incluindo o da American Joint Committee on Cancer.5 A medida de Breslow é mensurada utilizando‐se micrômetro ocular calibrado, desde a porção mais superficial da camada granulosa até a porção mais profunda do tumor.6,7 Entretanto, a medida de Breslow apresenta algumas limitações. Por exemplo, quando há presença de ulceração, a medida de Breslow pode ser subestimada em virtude da quantidade de tumor perdido que não é levado em consideração; e, quando há ausência da camada granulosa, como ocorre na região ungueal, a mensuração pode ser desafiadora.8 Além disso, a medida de Breslow não leva em conta as variações de espessura da epiderme normal nos diferentes sítios anatômicos, podendo mostrar diferenças mesmo quando o componente invasivo tem espessura semelhante, já que inclui a espessura total da epiderme.
A profundidade de invasão também é fator prognóstico do carcinoma de células escamosas do colo uterino, por exemplo. Nesse tumor, contudo, a profundidade de invasão do tumor é medida a partir da base do epitélio, não havendo influência da espessura do epitélio ou da presença de ulceração.9,10
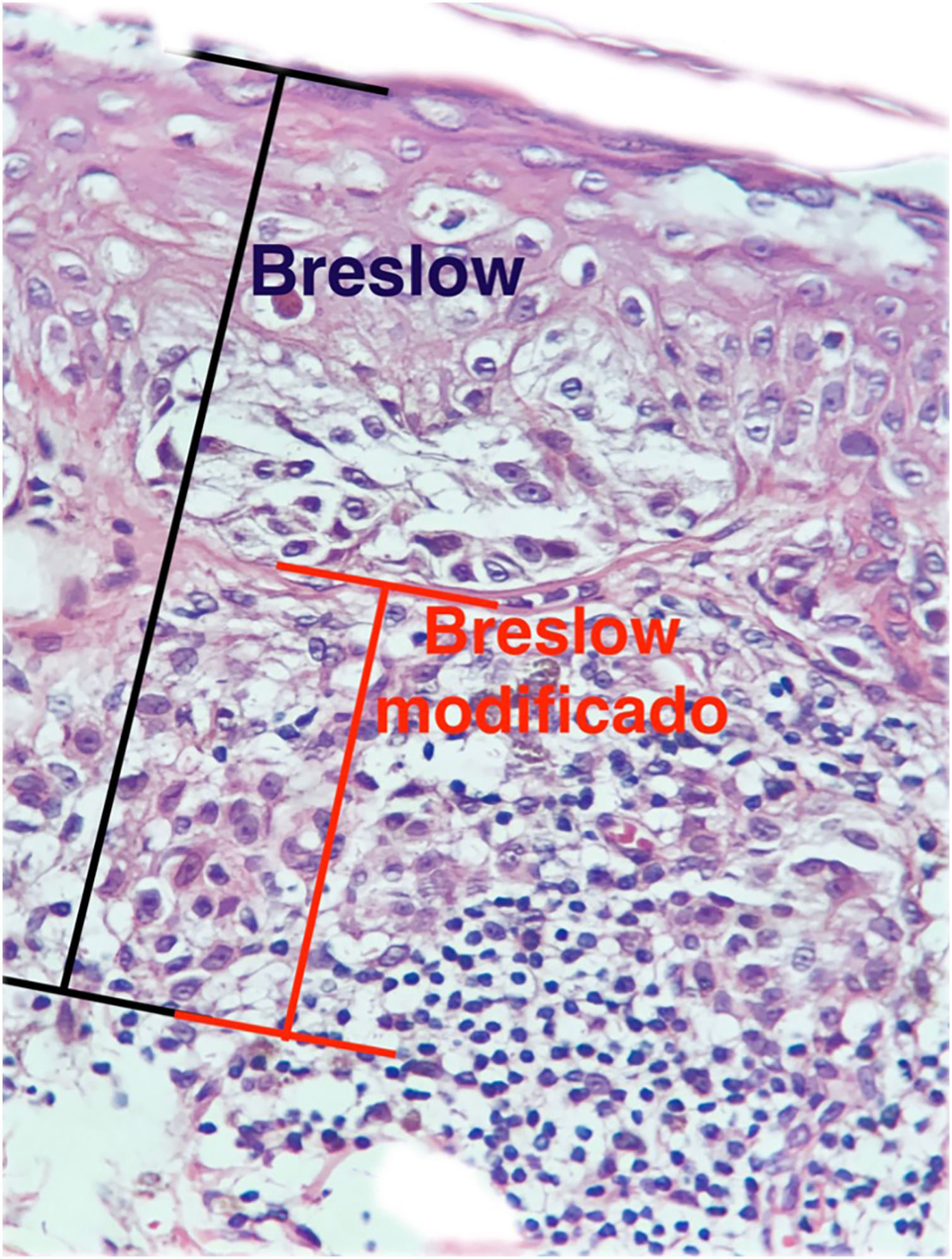
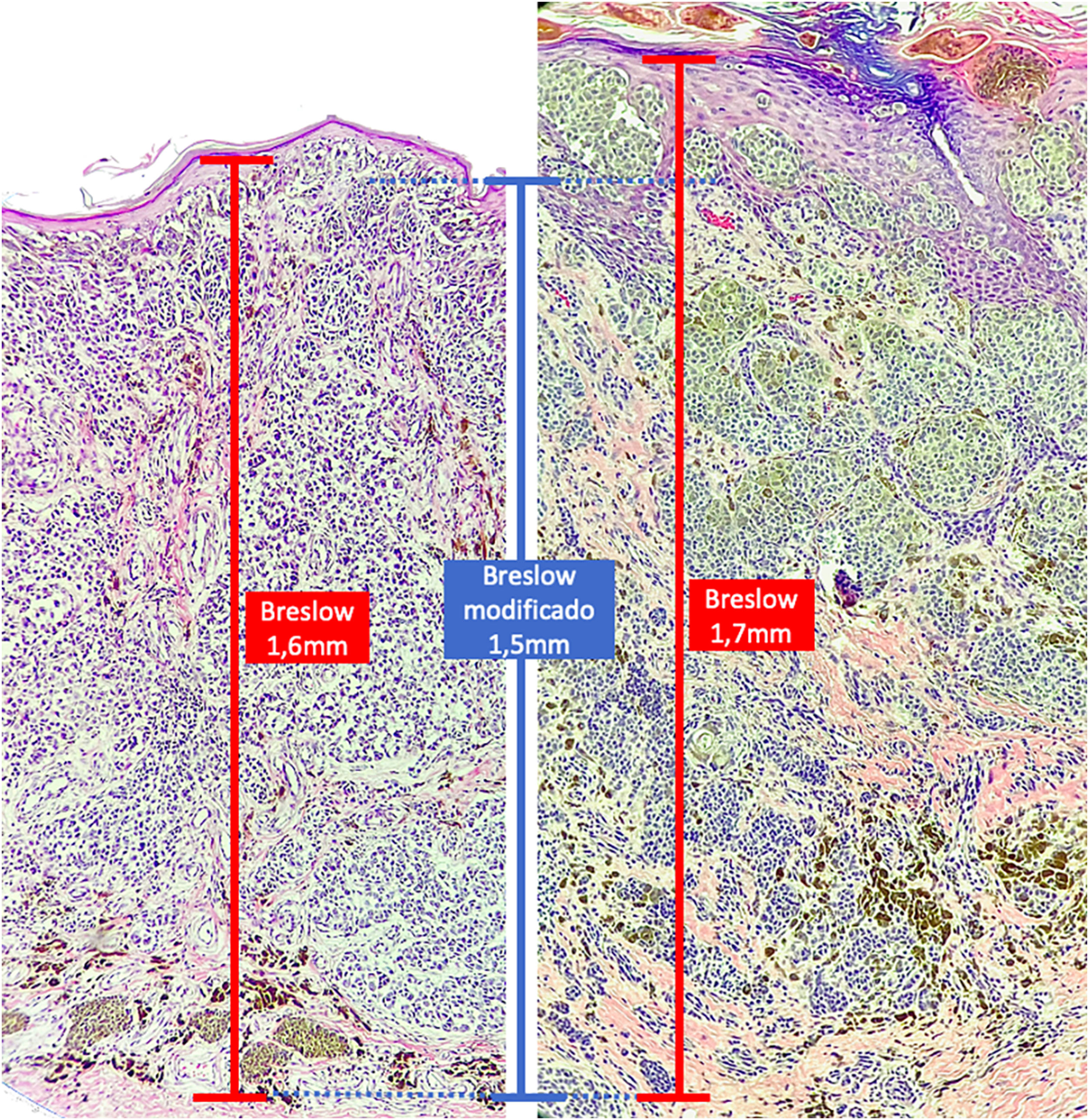
O objetivo deste estudo é avaliar a aplicabilidade da medida de Breslow modificada, mensurada a partir da membrana basal em vez da camada granulosa, na tentativa de predizer o resultado do linfonodo sentinela e da sobrevida dos pacientes com melanoma cutâneo de maneira comparada à medida do Breslow realizada do modo clássico (fig. 1). Adicionalmente, objetiva‐se avaliar a relação entre o status do linfonodo sentinela (positivo ou negativo para metástases), presença de ulceração e o tempo de sobrevida; e as relações entre sítio anatômico e subtipo histológico com a sobrevida e resultado do linfonodo sentinela.
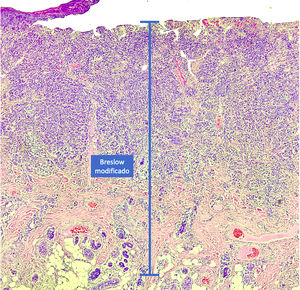
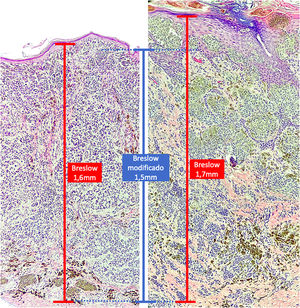
Materiais e métodosEste é um estudo retrospectivo e transversal que analisou lâminas coradas com HE de biopsias de pele fixadas em formalina e emblocadas em parafina, coletados de lesões primárias de melanoma no Hospital Amaral Carvalho de 2008 a 2021. Informações clínicas e histopatológicas (sexo, idade, localização, resultado do linfonodo sentinela, tempo de sobrevida e presença ou ausência de ulceração) foram coletadas dos relatórios patológicos armazenados nos sistemas digitais da instituição participante. Em relação à topografia da lesão, os casos foram divididos em: áreas não expostas ao sol (tórax anterior, tórax posterior, abdome, região genital e porção proximal dos membros), áreas expostas ao sol (cabeça, pescoço e porção distal dos membros, exceto região acral) e região acral (palmas, plantas e dedos). A análise microscópica (tipo histológico; medida de Breslow; medida de Breslow modificada) foi realizada por dois patologistas. A medida de Breslow foi mensurada de modo convencional, desde a camada granulosa até a porção mais profunda da neoplasia, enquanto a medida de Breslow modificada foi mensurada a partir da membrana basal até a porção mais profunda do tumor, desconsiderando‐se o componente in situ. Nos casos ulcerados em que havia epiderme intacta suprajacente à área de invasão mais profunda, não houve influência da ulceração em relação à medida do Breslow. Nos casos com ulceração extensa, ambas as medidas foram realizadas a partir da base da úlcera (fig. 2). Os critérios de exclusão foram: melanomas in situ ou finos (com menos de 1,0mm de espessura), metástases, discordância diagnóstica entre patologistas e aqueles cujos blocos de parafina estavam faltando ou cujos materiais eram escassos.
Com os dados obtidos, inicialmente foi feita análise descritiva com o cálculo de média, desvio padrão, valores mínimo, máximo e mediana para as variáveis quantitativas e frequências e porcentagens para as variáveis categorizadas. Considerando a sobrevida em meses, foram obtidas as curvas de Kaplan‐Meier seguido do teste de log‐rank para as variáveis de interesse. No caso de variáveis com mais de duas categorias, as curvas foram comparadas pelo teste de Sidak. Fatores de risco para a sobrevida considerando variáveis contínuas foram obtidos por meio do ajuste do modelo de Cox. Para o linfonodo como variável resposta, foi ajustado modelo de regressão logística considerando valores de Breslow e Breslow modificado como variáveis explanatórias. Associações entre variáveis categorizadas foram avaliadas pelo teste qui‐quadrado. Em todos os testes foi fixado o nível de significância de 5% ou o p‐valor correspondente. Todas as análises foram feitas pelo programa SAS para Windows, v.9.4.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa (CEP) do Hospital Amaral Carvalho (CAAE 52618721.0.3001.5434).
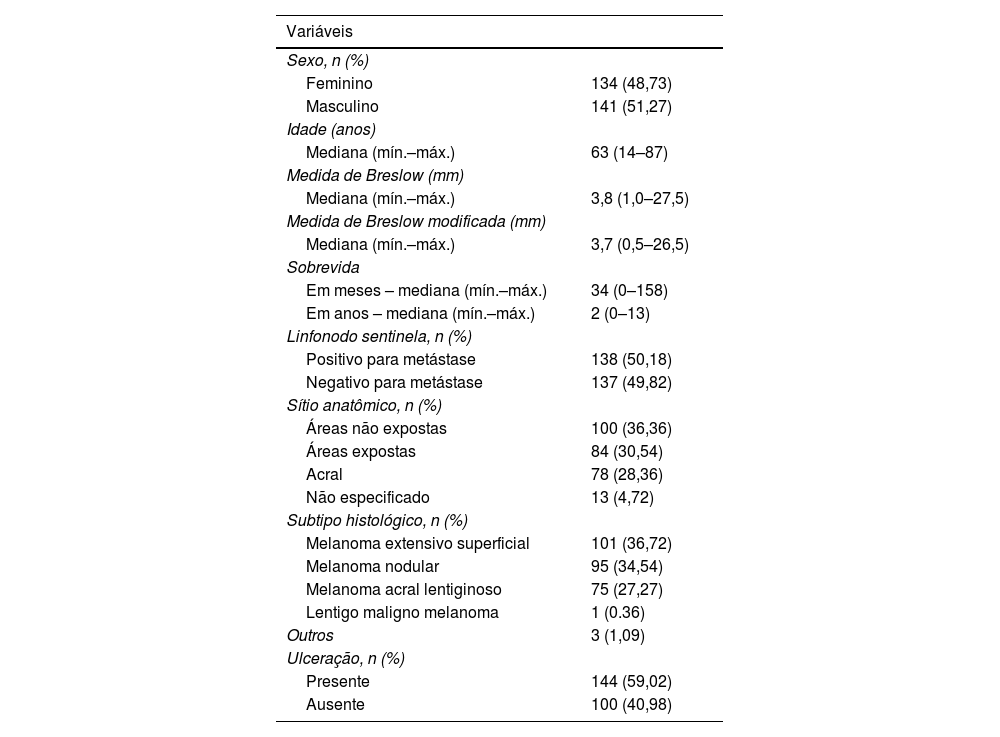
ResultadosUm total de 275 casos de melanoma diagnosticados de 2008 a 2021 e que foram submetidos à biopsia de linfonodo sentinela foram analisados. Desses, 141 (51,27%) eram homens e 134 (48,73%), mulheres. A idade teve mediana de 63 anos (14–97 anos). A medida micrométrica de Breslow teve mediana de 3,8mm (1,0–27,5mm), enquanto a medida de Breslow modificada teve mediana de 3,7mm (0,5–26,5mm). A mediana do tempo de sobrevida foi de dois anos (0 a 13 anos) – tabela 1.
Análise descritiva das características clínico patológicas dos casos
| Variáveis | |
|---|---|
| Sexo, n (%) | |
| Feminino | 134 (48,73) |
| Masculino | 141 (51,27) |
| Idade (anos) | |
| Mediana (mín.–máx.) | 63 (14–87) |
| Medida de Breslow (mm) | |
| Mediana (mín.–máx.) | 3,8 (1,0–27,5) |
| Medida de Breslow modificada (mm) | |
| Mediana (mín.–máx.) | 3,7 (0,5–26,5) |
| Sobrevida | |
| Em meses – mediana (mín.–máx.) | 34 (0–158) |
| Em anos – mediana (mín.–máx.) | 2 (0–13) |
| Linfonodo sentinela, n (%) | |
| Positivo para metástase | 138 (50,18) |
| Negativo para metástase | 137 (49,82) |
| Sítio anatômico, n (%) | |
| Áreas não expostas | 100 (36,36) |
| Áreas expostas | 84 (30,54) |
| Acral | 78 (28,36) |
| Não especificado | 13 (4,72) |
| Subtipo histológico, n (%) | |
| Melanoma extensivo superficial | 101 (36,72) |
| Melanoma nodular | 95 (34,54) |
| Melanoma acral lentiginoso | 75 (27,27) |
| Lentigo maligno melanoma | 1 (0.36) |
| Outros | 3 (1,09) |
| Ulceração, n (%) | |
| Presente | 144 (59,02) |
| Ausente | 100 (40,98) |
Dos 275 casos, 138 (50,18%) apresentaram metástase para linfonodo sentinela. Quanto ao sítio anatômico da lesão, 100 casos (36,36%) localizavam‐se em áreas não expostas ao sol, 84 casos (30,54%) em áreas expostas ao sol, 78 (28,36%) em região acral e 13 (4,72%) em áreas não especificadas. Em relação ao subtipo histológico, 101 casos (36,72%) eram melanomas do tipo extensivo superficial, 95 casos (34,54%) do tipo nodular, 75 casos (27,27%) do tipo acral, um caso (0,36%) do tipo lentigo maligno melanoma e três casos (1,09%) eram de outros subtipos mais raros ou inclassificáveis. Dos 244 casos com informações sobre ulceração, 144 (59,02%) apresentavam ulceração (tabela 1).
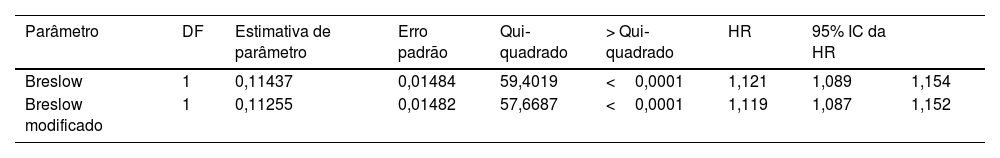
Os resultados da análise do modelo de Cox para avaliar o impacto dos diferentes métodos de mensuração da espessura do melanoma (medida de Breslow e medida de Breslow modificada) na sobrevida revelam que ambos os métodos são estatisticamente significantes. Para a medida de Breslow convencional, obteve‐se valor de qui‐quadrado de 59,40; valor‐p<0,0001; HR de 1,121. Para a medida de Breslow modificada, obteve‐se um qui‐quadrado de 57,66; valor‐p <0,0001; HR de 1,119 (tabela 2). A regressão logística revelou associação significante entre ambas as mensurações (medida de Breslow convencional e modificada) e a presença de metástase em linfonodos sentinelas. A medida de Breslow apresentou odds ratio (OR) de 1,189 (95%IC 1,111–1,271; valor p <0,0001). Do mesmo modo, a medida de Breslow modificada apresentou OR de 1,19 (95%IC 1,112–1,273; valor p <0,0001) – tabela 3.
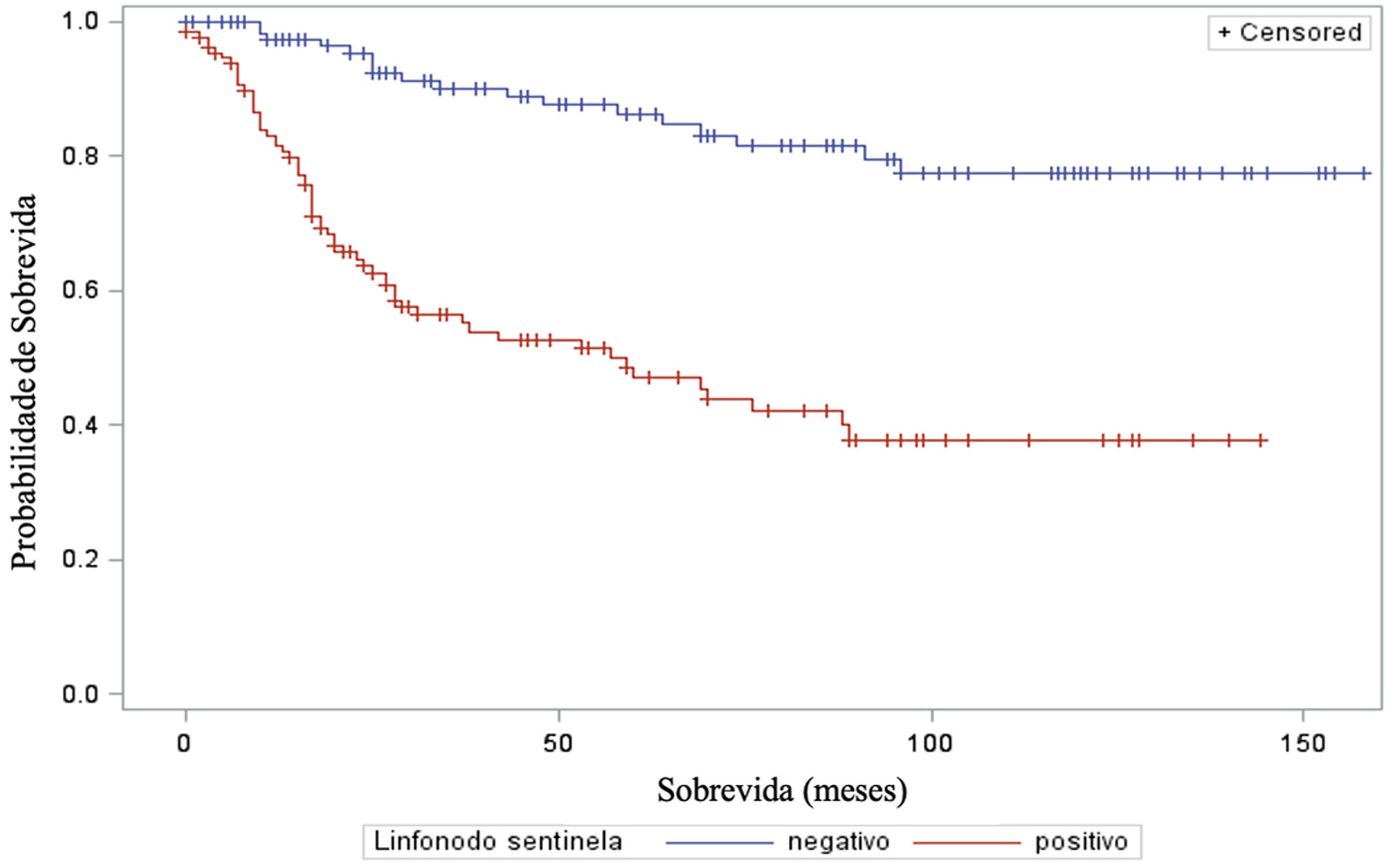
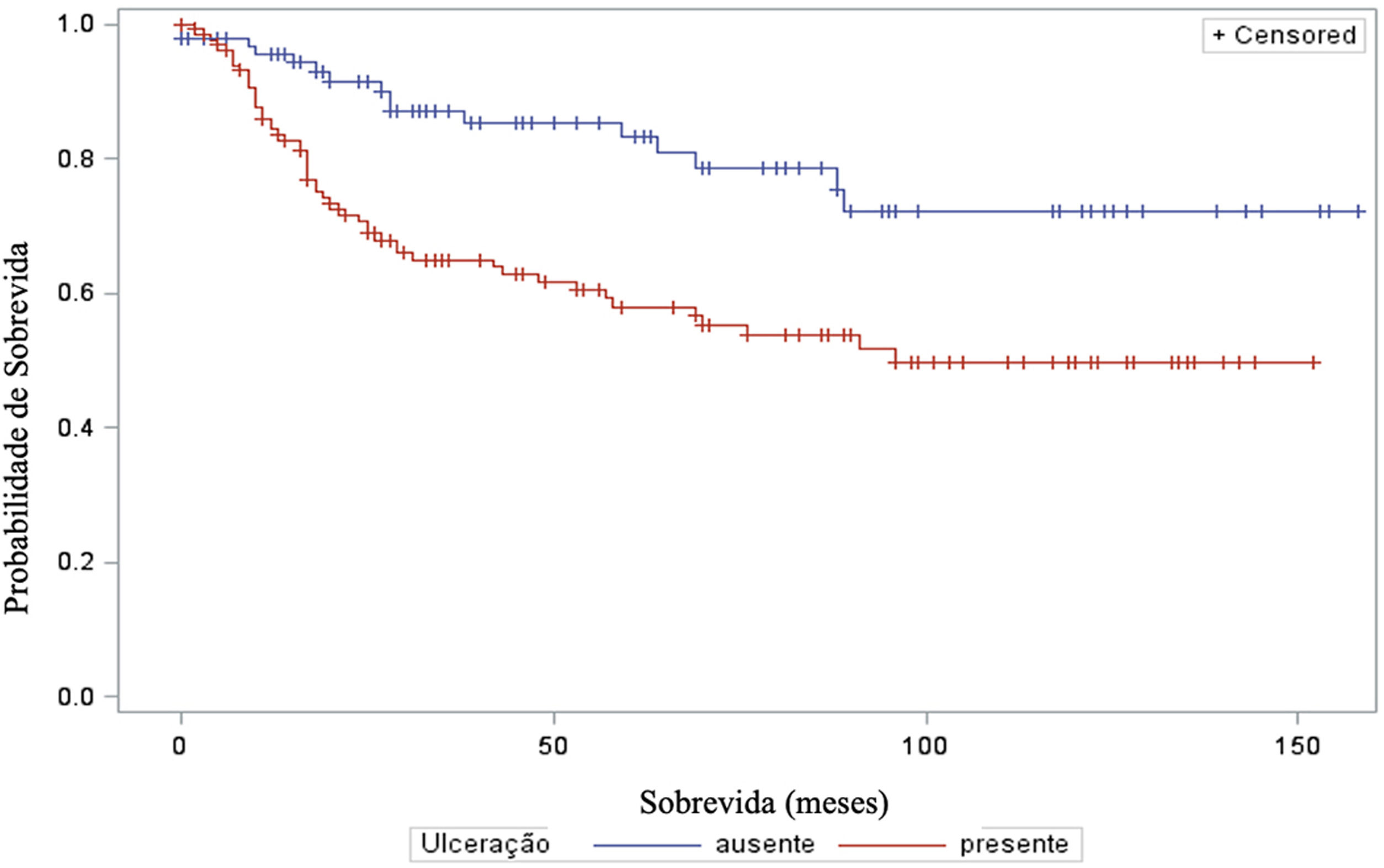
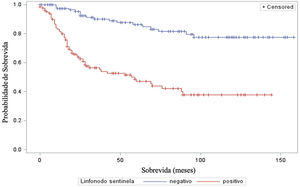
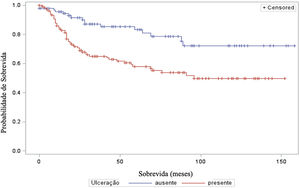
A análise do tempo de sobrevida em relação ao status do linfonodo sentinela (positivo ou negativo para metástase) foi realizada por meio dos testes log‐rank (qui‐quadrado 39,49; DF 1, p <0,0001), Wilcoxon (qui‐quadrado 40,54; DF 1, p <0,0001) e−2Log(LR) (qui‐quadrado 48,24; DF 1, p <0,0001) – figura 3. Da mesma maneira, na análise de sobrevida em relação à presença de ulceração, foram realizados os testes log‐rank (qui‐quadrado 11,56; DF 1, p <0,0007), Wilcoxon (qui‐quadrado 12,61; DF 1, p <0,0004) e−2Log(LR) (qui‐quadrado 12,92; DF 1, p <0,0003) – figura 4. Além disso, a presença de ulceração mostrou associação significante com metástases em linfonodos sentinelas (p=0,0019).
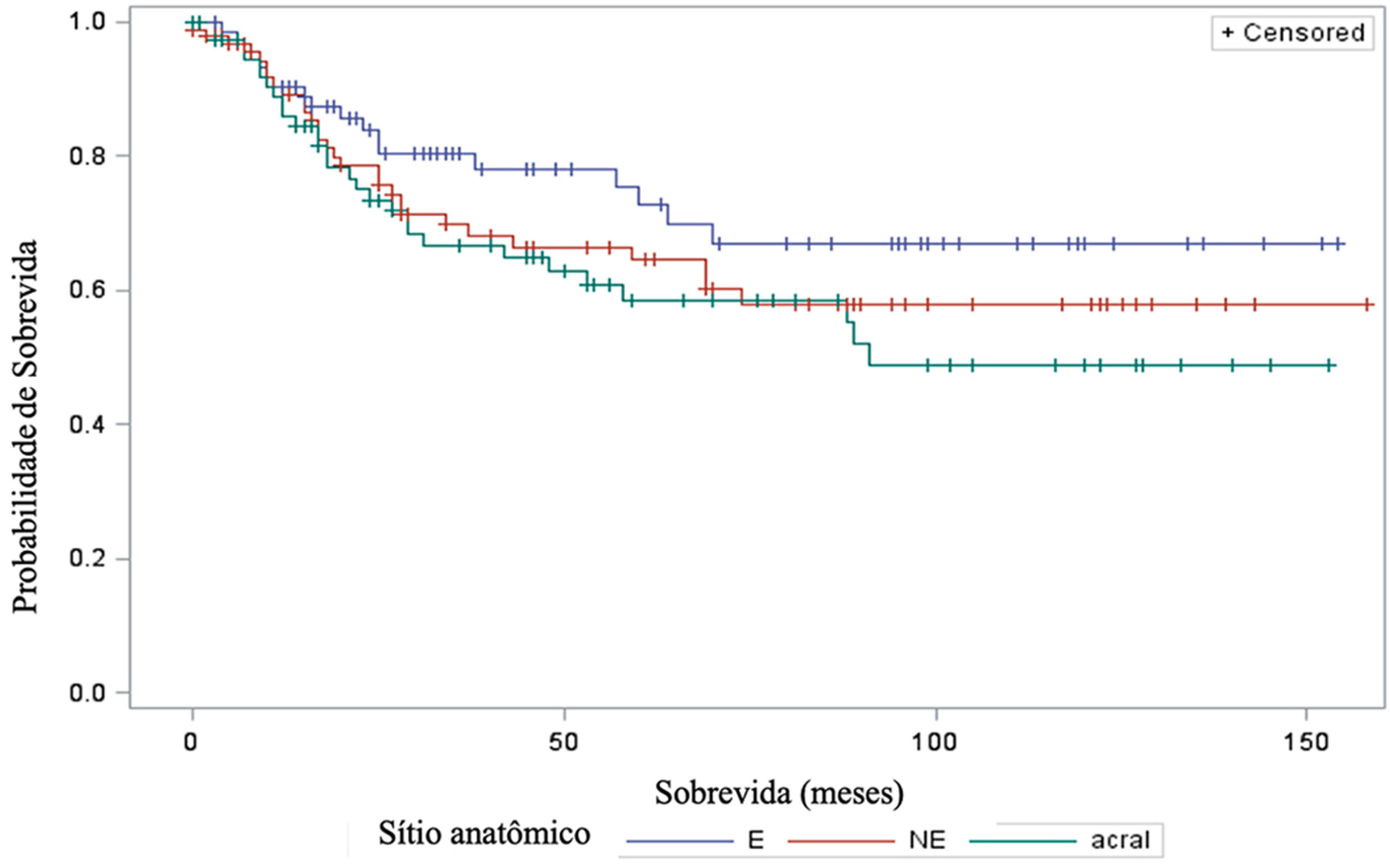
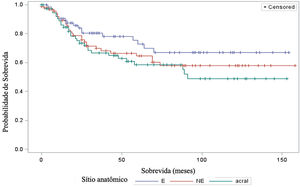
A análise de sobrevida em relação ao sítio anatômico não revelou resultados significantes (fig. 5). O teste log‐rank obteve qui‐quadrado de 2,9495 com DF 2, e valor‐p de 0,2288. No ajuste para múltiplas comparações por meio do teste de Sidak, nenhuma das comparações pareadas entre os sítios anatômicos atingiu significância estatística. A comparação entre sítios expostos ao sol (E) e não expostos (NE) obteve valor‐p de 0,6668 (qui‐quadrado 1,0447). A comparação entre sítios E e acrais resultou em valor‐p de 0,2427 (qui‐quadrado 2,9014). Por fim, a comparação entre sítios NE e acrais produziu valor‐p de 0,9014 (qui‐quadrado 0,3791). Em relação ao sítio anatômico e sua associação com metástases linfonodo sentinela, a análise também não demonstrou diferenças significantes (p=0,1217).
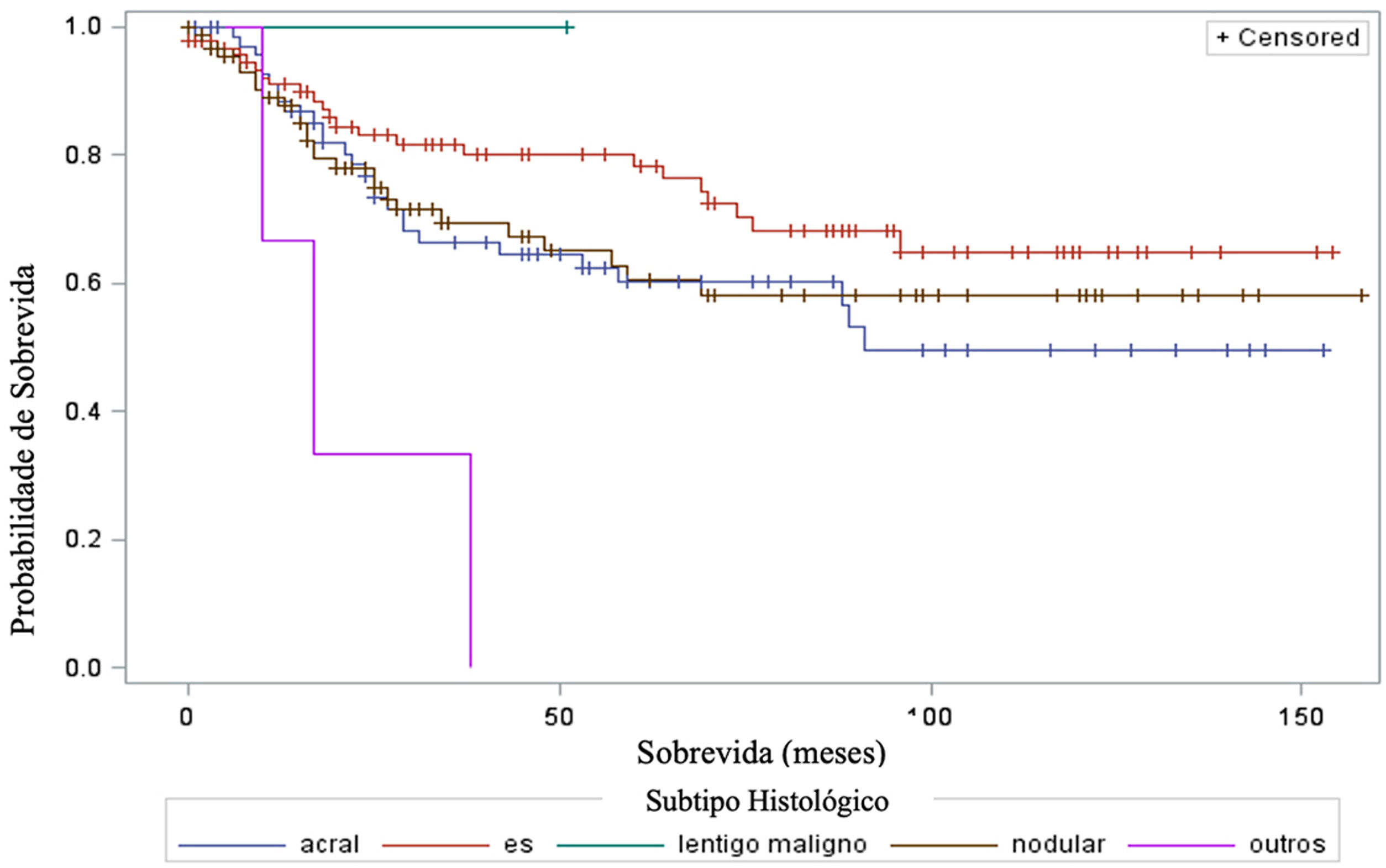
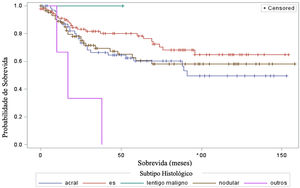
Ao considerar a sobrevida em relação aos subtipos histológicos do melanoma, o teste log‐rank detectou diferenças significantes na taxa de sobrevida entre diferentes subtipos (qui‐quadrado 13,11; DF 4 e valor‐p 0,0107) – figura 6 Em relação a metástases em linfonodo sentinela, não houve associação estatisticamente significante entre o subtipo histológico (p=0,0735) e o status do linfonodo sentinela.
DiscussãoOs resultados deste estudo mostraram que a medida de Breslow modificada (mensurada a partir da membrana basal em vez da camada granulosa) foi capaz de predizer o tempo de sobrevida e o resultado do linfonodo sentinela, assim como a medida de Breslow convencional.
A medida de Breslow apresenta algumas limitações. Quando a lesão é ulcerada, a medida começa desde a base da úlcera. Nesses casos, a espessura poderá estar subestimada, pois não se está levando em conta a quantidade de tumor perdida em virtude da ulceração. Também os parâmetros atuais para estadiamento dos melanomas não levam em consideração a espessura da epiderme para mensuração do Breslow. Sabe‐se que, por exemplo, a pele acral apresenta epiderme mais espessa, enquanto algumas áreas da face, como a pele da região posterior da orelha, têm epiderme mais fina.11,12 Nesse contexto, casos de lentigo maligno melanoma, cuja epiderme é geralmente atrófica, podem apresentar Breslow menores que casos de melanomas acrais (visto que a epiderme da região acral é espessa), ainda que ambos apresentem acometimento de estratos na derme semelhantes (fig. 7). Além disso, a medida de Breslow apenas pode ser avaliada de maneira acurada em cortes perpendiculares à superfície da epiderme. Caso haja extensão perianexial do melanoma e esse represente o único foco de invasão, a melhor metodologia para essa mensuração se torna questionável.13,14 A medida de Breslow modificada, proposta neste estudo, não é afetada pelas variações da espessura da epiderme nos diferentes sítios anatômicos, nem pela presença ou ausência de ulceração (fig. 7). Essa abordagem pode apresentar maior constância, sofrendo menos variações e demonstrando boa reprodutibilidade entre patologistas.
Os resultados também corroboram que o status do linfonodo sentinela tem efeito significante na sobrevida dos pacientes com melanoma; a presença de metástase em linfonodo sentinela está associada à redução do tempo de sobrevida, estando de acordo com outros trabalhos como o de Tejera‐Vaquerizo et al., que analisou 4.249 casos de melanomas finos e encontrou que o status do linfonodo sentinela é o fator prognóstico mais importante para a sobrevida melanoma específica.15 Jafari et al., em um estudo com 1.111 pacientes, mostraram que aqueles que não apresentavam metástases para linfonodo sentinela apresentaram sobrevida livre de doença mais longa do que os que apresentavam metástase. Além disso, nos pacientes com melanoma de espessura intermediária (1,0 a 4,0mm), foi encontrada melhor sobrevida global naqueles com linfonodo sentinela negativo para metástases.16 Outro estudo, entretanto, mostrou que o status do linfonodo sentinela é fator prognóstico independente para sobrevida livre de doença, porém não para sobrevida global em análise multivariada em 309 casos de melanoma.17 Lemos et al., em estudo com 43 pacientes com melanoma espesso (> 4mm) não demonstraram significância estatística do status do linfonodo sentinela na sobrevida global.18
Além disso, a ulceração teve impacto significante na sobrevida dos pacientes, indicando sobrevida menor naqueles com ulceração. Esses resultados estão em concordância com outros estudos, como o de Sarpa et al., com 235 pacientes, que demonstraram correlação significante entre a extensão da ulceração e a sobrevida global, bem como o status do linfonodo sentinela.19 E o trabalho de Hout et al., que mostrou que tanto a presença quanto a extensão da ulceração são preditores independentes da sobrevida.20
Quanto ao sítio anatômico do melanoma, nosso estudo não demonstrou haver impacto significante na sobrevida dos pacientes, tampouco associação com o resultado do linfonodo sentinela. Esses resultados estão em desacordo com outros estudos, como o de Callender et al., com 2.500 pacientes, que demonstrou que o sítio anatômico é preditor independente para o status do linfonodo sentinela bem como para a sobrevida.21 E o de Howard et al., que demonstrou que sítios com exposição solar intermitente ou crônica apresentaram melhores sobrevidas comparada aos sítios raramente expostos ao sol.22
E em relação ao subtipo histológico, houve diferenças estatísticas significantes na taxa de sobrevida entre diferentes subtipos histológicos (Curva de Kaplan‐Meier). Não houve associação estatisticamente significante entre o subtipo histológico e o status do linfonodo sentinela. O estudo de Buja et al. mostrou que o subtipo histológico é fator de risco independente para óbito; o subtipo nodular é o que apresenta pior sobrevida melanoma específica.23 Sharouni et al. mostraram em um estudo com 48.361 pacientes que os subtipos nodular e acral lentiginoso apresentam sobrevida pior do que os subtipos extensivo superficial e lentigo maligno melanoma.24 Já o trabalho de Robsahm et al. não demonstrou o subtipo histológico como preditor independente de sobrevida melanoma específica.25
Uma limitação deste estudo é sua natureza retrospectiva, o número limitado de casos totais, o número de casos ulcerados e a elevada frequência de casos em estádio avançado. Por uma característica do perfil do serviço, foram observados também, comparativamente a outros estudos, muitos casos de melanoma acral e melanoma nodular, e apenas um caso de lentigo maligno melanoma. Apesar disso, é o primeiro trabalho a propor a possibilidade de adaptação na maneira de mensurar o Breslow. O presente estudo demonstrou que a medida de Breslow modificada, ou seja, mensurada a partir da membrana basal em vez da camada granulosa, é capaz de predizer o prognóstico, bem como a medida de Breslow convencional. Entretanto, mais estudos são necessários para validar este método.
Suporte financeiroFundação de Amparo à Pesquisa do Estado de São Paulo (processo n° 2021/09431‐0).
Contribuição dos autoresMarcel Arakaki Asato: Levantamento dos dados; análise estatística; redação do artigo; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Francisco Alves Moares Neto: Revisão crítica do conteúdo intelectual importante.
Marcelo Padovani de Toledo Moraes: Revisão crítica do conteúdo intelectual importante.
Juliana Polizel Ocanha‐Xavier: Revisão crítica do conteúdo intelectual importante.
Luiz Carlos Takita: Revisão crítica do conteúdo intelectual importante.
Mariangela Esther Alencar Marques: Revisão crítica do conteúdo intelectual importante.
José Cândido Caldeira Xavier‐Júnior: Concepção e desenho do estudo; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do conteúdo intelectual importante; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos à FAPESP pelo suporte financeiro público (número do processo: 2021/09431‐0) e ao Professor José Eduardo Corrente pela análise estatística.
Como citar este artigo: Asato MA, Moares Neto FA, Moraes MPT, Ocanha‐Xavier JP, Takita LC, Marques MEA, Xavier‐Júnior JCC. Proposal for the applicability of modified Breslow (measured from the basal membrane) as a predictor of survival and sentinel lymph node outcome in patients with cutaneous melanoma. An Bras Dermatol. 2024;99:398–406.
Trabalho realizado no Hospital Amaral Carvalho, Jaú, SP, Brasil e Universidade Estadual Paulista, Botucatu, SP, Brasil.