A micose fungoide é a forma mais frequente de linfoma cutâneo de células T. Caracteriza‐se por curso crônico, lento e progressivo da doença e está associada a taxas de mortalidade que dependem de diversos fatores, como o estadiamento clínico. Uma sobrevida mediana de até 13 meses é encontrada em pacientes nas fases avançadas que necessitam de tratamentos mais agressivos, com maior toxicidade e custos mais elevados. Na América Latina, há poucos estudos disponíveis sobre o prognóstico da doença.
ObjetivoDeterminar a taxa de progressão das fases iniciais (IA, IB, IIA) para as mais avançadas (> IIB) em pacientes maiores de 18 anos com micose fungoide tratados em dois centros médicos na Colômbia entre 1° de janeiro de 2010 e 31 de dezembro de 2019.
MétodosEstudo de coorte retrospectivo com desenho longitudinal.
Resultadosforam incluídos 112 pacientes com diagnóstico micose fungoide na fase inicial, sendo 56,2% deles do gênero masculino (n=63), com mediana de idade de 53 anos (IIQ 43‐67). A variante clínica mais frequente foi a clássica (67,9%; n=76), seguida da foliculotrópica (16%; n=18) e da hipopigmentada (10,7%; n=12). O tratamento de primeira linha mais comum foi a fototerapia NB‐UVB (27,7%; n=31), seguida de fototerapia PUVA (25,8%; n=29) e dos corticosteroides tópicos (25%; n=28). A taxa global de progressão da doença foi de 8% (n=9), com uma mortalidade global de 12,5% (n=14).
Limitações do estudoSeu desenho retrospectivo e a falta de estudos moleculares para caracterização dos casos.
ConclusõesA micose fungoide na fase inicial é doença com bom prognóstico na maioria dos pacientes, com taxa de progressão de 8% (n=9).
A micose fungoide (MF) é o tipo mais comum de linfoma cutâneo de células T e é responsável por quase 50% de todos os linfomas primários na pele1 e 4% de todos os linfomas não Hodgkin.2 A MF caracteriza‐se por curso crônico, lento e progressivo da doença nas fases iniciais. Essa doença tem sido associada a impacto negativo na qualidade de vida3 e taxa de mortalidade que depende de vários fatores, particularmente do estadiamento clínico.4
Pacientes com MF na fase inicial (estádios<IIA) geralmente apresentam bom prognóstico, mas foi descrito que aproximadamente 25% desses pacientes podem evoluir para formas avançadas da doença (estádios>IIB),5 apresentando tumores, eritrodermia e envolvimento linfonodal, leucêmico e/ou visceral.4 Nesses casos, a sobrevida média é inferior a quatro anos e apenas 13 meses em pacientes com envolvimento de linfonodos,4,5 o que significa que são necessários tratamentos mais agressivos, mais tóxicos e mais caros.6
Poucos estudos incluindo grande número de casos e relatando a taxa de progressão e os fatores clínicos que afetam a sobrevida foram publicados na América Latina. A identificação oportuna de pacientes com MF com possibilidade de progressão é importante para oferecer tratamentos mais eficazes e individualizados que permitam melhor controle da doença em longo prazo.
MétodosEstudo de coorte retrospectivo, multicêntrico, com abordagem analítica, que teve como objetivo avaliar a taxa de progressão em pacientes com micose fungoide nas fases iniciais (IA, IB e IIA) para as mais avançadas (IIB em diante), tratados no Hospital San José e em centro privado de dermatologia oncológica em Bogotá D.C. ao longo de 10 anos, de 1° de janeiro de 2010 a 31 de dezembro de 2019.
Foi obtida aprovação dos comitês de ética e pesquisa das instituições e foram considerados os seguintes critérios de inclusão e exclusão:
Critérios de inclusão:
- •
Pacientes com diagnóstico de micose fungoide confirmado por histopatologia da pele, avaliados no consultório dermatológico do Hospital San José e em consultório particular de dermato‐oncologia.
- •
Pacientes com micose fungoide estádios IA, IB e IIA, conforme classificação proposta pela International Society for Cutaneous Lymphomas e European Organization of Research and Treatment of Cancer (ISCL/EORTC) no momento da avaliação inicial.
- •
Pacientes maiores de 18 anos.
Critério de exclusão:
- •
Falta de dados relevantes nos registros clínicos.
A classificação TNMB proposta pela International Society of Cutaneous Lymphomas (ISCL) e pela European Organization for Research and Treatment of Cancer (EORTC), endossada pela National Comprehensive Cancer Network (NCCN), foi utilizada para o estadiamento dos pacientes. Com esse sistema, a gravidade da MF é classificada em nove estádios (IA, IB, IIA, IIB, IIIA, IIIB, IVA1‐2 e IVB).3–5
Simultaneamente, foi realizada a caracterização sociodemográfica e clínica da população, tendo sido identificados possíveis fatores de mau prognóstico associados descritos na literatura, especificamente, idade avançada, envolvimento linfonodal, foliculotropismo, ausência de imunomarcação com CD7 e expressão de CD30 nas células neoplásicas, transformação em grandes células, aumento da LDH (lactato desidrogenase), eosinofilia no hemograma, fenótipo TCRγδ, entre outros.3,5 A resposta às diferentes linhas de tratamento oferecidas, como definido pela EORTC e pelo United States Cutaneous Lymphoma Consortium (USCLC), também foi avaliado da seguinte maneira:
- ‐
Completa: resposta de 100% (desaparecimento de todas as lesões)
- ‐
Parcial: resposta entre 50-99%
- ‐
Nula: resposta<50%
Isso foi realizado por meio da coleta de variáveis qualitativas e quantitativas dos registros médicos de cada paciente. As análises de frequência absoluta e relativa por meio de tabelas e gráficos foram utilizadas para variáveis qualitativas, enquanto medidas de tendência central (média, mediana), medidas de dispersão (desvio padrão, intervalo interquartil) e medidas de ordem (percentis) foram utilizadas para variáveis quantitativas.
ResultadosDe 1° de janeiro de 2010 a 31 de dezembro de 2019, foram avaliados 214 pacientes com suspeita de micose fungoide, 137 (64%) no Hospital San Jose e o restante em centro dermato‐oncológico privado. Desses, 112 casos (52%) tiveram diagnóstico confirmado de micose fungoide e atenderam a todos os demais critérios de inclusão.
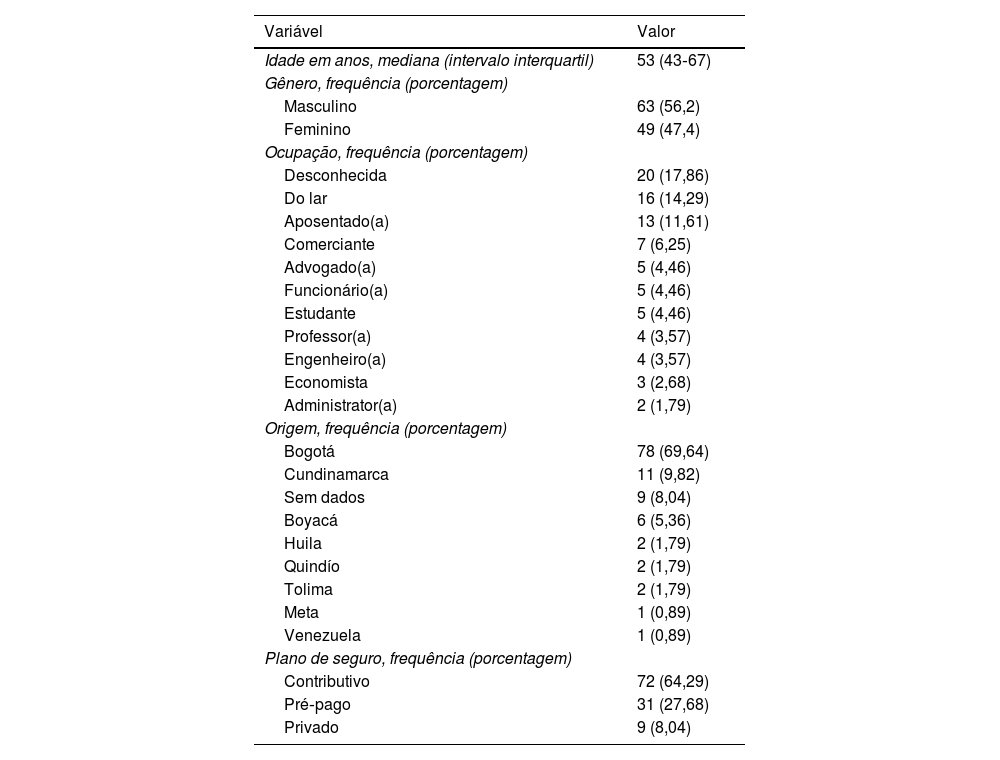
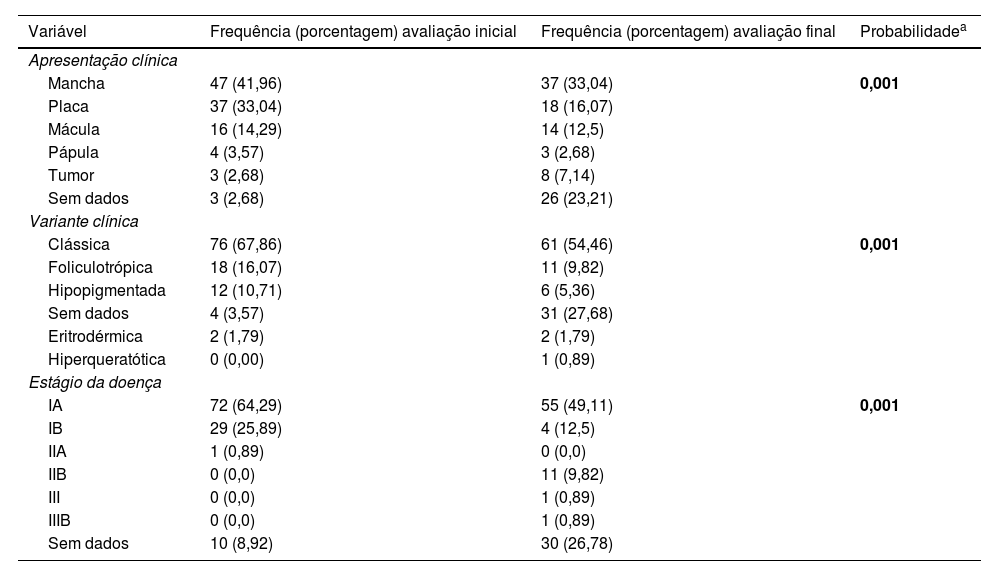
Em termos gerais, 56,2% eram masculinos (n=63) e a mediana da idade era de 53 anos (IIQ 43‐67; tabela 1). O fototipo mais comum identificado foi o fototipo 3. A mediana do tempo de progressão da doença foi de 62 meses (IIQ 24‐120; tabela 2). Na avaliação inicial, as lesões semiológicas foram classificadas como mancha em 42% (n=47), placa em 33% (n=37) e mácula em 14,3% (n=16) dos casos. A variante clássica foi a mais comum, com 67,9% (n=76) dos casos, seguida pela foliculotrópica com 16% (n=18) e hipopigmentada com 10,7% (n=12). Em relação à fase evolutiva, IA foi a mais frequente, com 64,3% (n=72), seguido de IB com 25,9% (n=29; tabela 3).
Características sociodemográficas
| Variável | Valor |
|---|---|
| Idade em anos, mediana (intervalo interquartil) | 53 (43‐67) |
| Gênero, frequência (porcentagem) | |
| Masculino | 63 (56,2) |
| Feminino | 49 (47,4) |
| Ocupação, frequência (porcentagem) | |
| Desconhecida | 20 (17,86) |
| Do lar | 16 (14,29) |
| Aposentado(a) | 13 (11,61) |
| Comerciante | 7 (6,25) |
| Advogado(a) | 5 (4,46) |
| Funcionário(a) | 5 (4,46) |
| Estudante | 5 (4,46) |
| Professor(a) | 4 (3,57) |
| Engenheiro(a) | 4 (3,57) |
| Economista | 3 (2,68) |
| Administrator(a) | 2 (1,79) |
| Origem, frequência (porcentagem) | |
| Bogotá | 78 (69,64) |
| Cundinamarca | 11 (9,82) |
| Sem dados | 9 (8,04) |
| Boyacá | 6 (5,36) |
| Huila | 2 (1,79) |
| Quindío | 2 (1,79) |
| Tolima | 2 (1,79) |
| Meta | 1 (0,89) |
| Venezuela | 1 (0,89) |
| Plano de seguro, frequência (porcentagem) | |
| Contributivo | 72 (64,29) |
| Pré‐pago | 31 (27,68) |
| Privado | 9 (8,04) |
Nota: Dados coletados pelo autor em 2021.
Fototipo, tempo de progressão da doença e atraso no diagnóstico
| Variável | Valor |
|---|---|
| Fototipo de pele de Fitzpatrick, frequência (porcentagem) | |
| Sem dados | 82 (73,21) |
| 3 | 24 (21,43) |
| 4 | 4 (3,57) |
| 2 | 1 (0,89) |
| 6 | 1 (0,89) |
| Tempo de progressão até a primeira avaliação em meses, frequência (porcentagem) | 62 (24‐120) |
| Ano de confirmação do diagnóstico, frequência (porcentagem) | |
| 2015 | 11 (9,82) |
| 2016 | 19 (16,96) |
| 2017 | 13 (11,61) |
| 2018 | 8 (7,14) |
| Tempo até o diagnóstico em meses, mediana (IIQ) | 60 (24‐96) |
Nota: Dados coletados pelo autor em 2021.
Características clínicas na avaliação inicial vs. final
| Variável | Frequência (porcentagem) avaliação inicial | Frequência (porcentagem) avaliação final | Probabilidadea |
|---|---|---|---|
| Apresentação clínica | |||
| Mancha | 47 (41,96) | 37 (33,04) | 0,001 |
| Placa | 37 (33,04) | 18 (16,07) | |
| Mácula | 16 (14,29) | 14 (12,5) | |
| Pápula | 4 (3,57) | 3 (2,68) | |
| Tumor | 3 (2,68) | 8 (7,14) | |
| Sem dados | 3 (2,68) | 26 (23,21) | |
| Variante clínica | |||
| Clássica | 76 (67,86) | 61 (54,46) | 0,001 |
| Foliculotrópica | 18 (16,07) | 11 (9,82) | |
| Hipopigmentada | 12 (10,71) | 6 (5,36) | |
| Sem dados | 4 (3,57) | 31 (27,68) | |
| Eritrodérmica | 2 (1,79) | 2 (1,79) | |
| Hiperqueratótica | 0 (0,00) | 1 (0,89) | |
| Estágio da doença | |||
| IA | 72 (64,29) | 55 (49,11) | 0,001 |
| IB | 29 (25,89) | 4 (12,5) | |
| IIA | 1 (0,89) | 0 (0,0) | |
| IIB | 0 (0,0) | 11 (9,82) | |
| III | 0 (0,0) | 1 (0,89) | |
| IIIB | 0 (0,0) | 1 (0,89) | |
| Sem dados | 10 (8,92) | 30 (26,78) | |
Nota: dados coletados pelo autor em 2021.
Na última consulta de seguimento, as variáveis clínicas apresentaram algumas diferenças. Tumores foram relatados em 8,9% dos casos (n=10), 6,2% dos pacientes foram classificados como IIB (n=8) e a fase final não foi documentado em 26,7% dos casos (n=30).
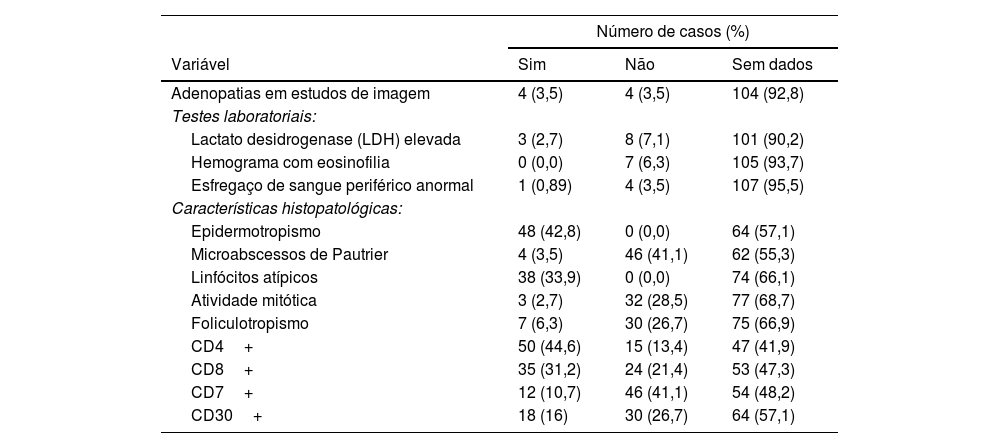
Durante o período do estudo, 7,14% (8 de 75 casos) apresentaram linfadenopatia ao exame físico, confirmada por exames de imagem em quatro pacientes, e 3,5% (n=4) apresentaram outros linfomas concomitantes. Além disso, a taxa de mortalidade geral foi de 12,5% (n=14), com 10 pacientes morrendo por linfoma, um por COVID‐19 e três por causas não relacionadas à doença. O envolvimento hematológico confirmado por citometria de fluxo foi documentado em um paciente.
As características histopatológicas mais frequentemente observadas no momento do diagnóstico foram epidermotropismo em 100% dos pacientes com registros (n=48), microabscessos de Pautrier (cinco de 43 casos), linfócitos atípicos (cinco de 43 casos) e foliculotropismo em 6,25% (sete de 37 casos). A micose fungoide era CD4+em 50 casos (44,6%) e CD8+em 35 casos (31,2%); entretanto, em 27 casos não havia nenhuma informação do perfil imuno‐histoquímico (IHQ) das células T; 18 casos (16,0%) apresentaram o marcador CD30+(tabela 4).
Estudos complementares e características histopatológicas
| Número de casos (%) | |||
|---|---|---|---|
| Variável | Sim | Não | Sem dados |
| Adenopatias em estudos de imagem | 4 (3,5) | 4 (3,5) | 104 (92,8) |
| Testes laboratoriais: | |||
| Lactato desidrogenase (LDH) elevada | 3 (2,7) | 8 (7,1) | 101 (90,2) |
| Hemograma com eosinofilia | 0 (0,0) | 7 (6,3) | 105 (93,7) |
| Esfregaço de sangue periférico anormal | 1 (0,89) | 4 (3,5) | 107 (95,5) |
| Características histopatológicas: | |||
| Epidermotropismo | 48 (42,8) | 0 (0,0) | 64 (57,1) |
| Microabscessos de Pautrier | 4 (3,5) | 46 (41,1) | 62 (55,3) |
| Linfócitos atípicos | 38 (33,9) | 0 (0,0) | 74 (66,1) |
| Atividade mitótica | 3 (2,7) | 32 (28,5) | 77 (68,7) |
| Foliculotropismo | 7 (6,3) | 30 (26,7) | 75 (66,9) |
| CD4+ | 50 (44,6) | 15 (13,4) | 47 (41,9) |
| CD8+ | 35 (31,2) | 24 (21,4) | 53 (47,3) |
| CD7+ | 12 (10,7) | 46 (41,1) | 54 (48,2) |
| CD30+ | 18 (16) | 30 (26,7) | 64 (57,1) |
Nota: dados coletados pelo autor em 2021.
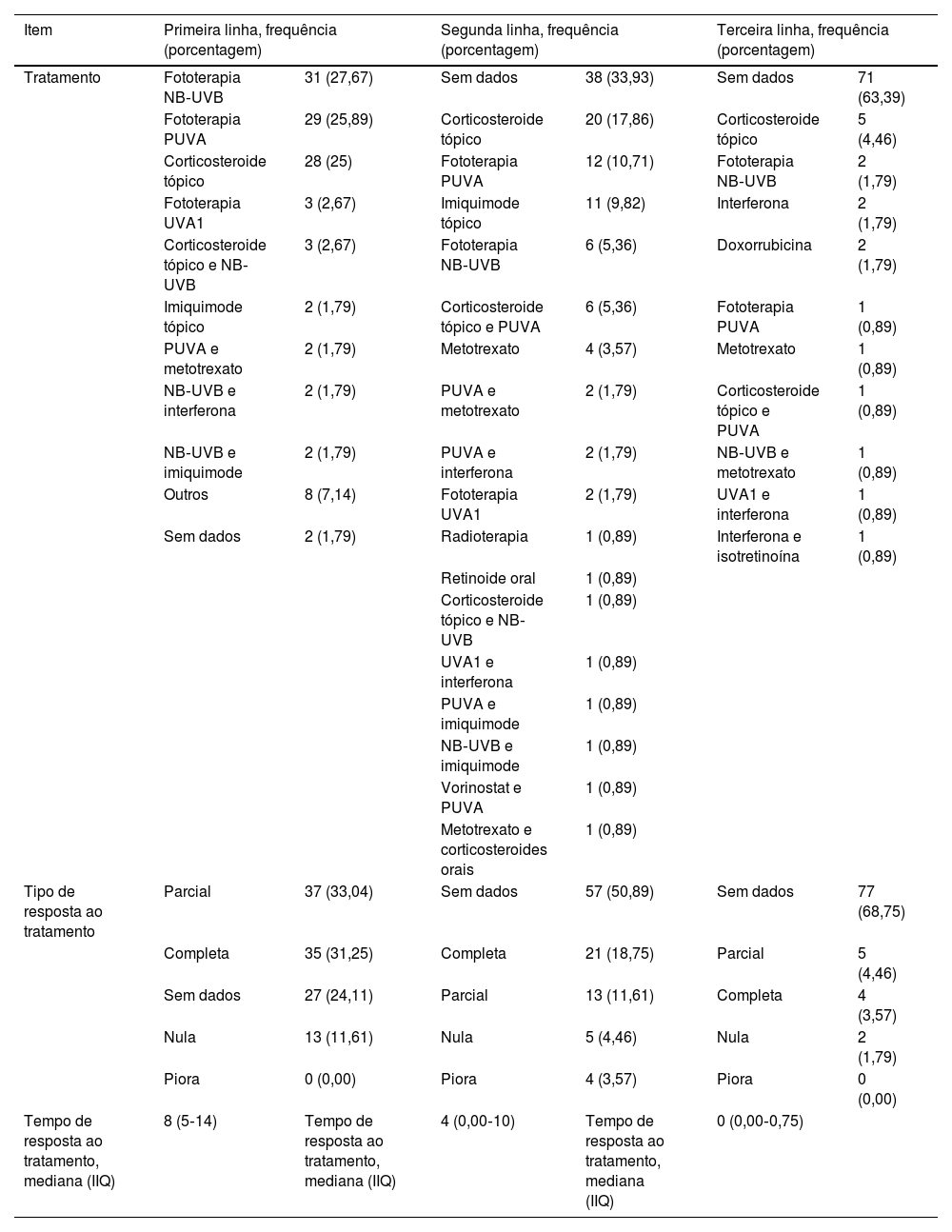
A fototerapia UVB de banda estreita (NB‐UVB) foi o tratamento de primeira linha mais comum com 27,7% (n=31), seguida pela fototerapia PUVA (psoraleno+radiação ultravioleta A) com 25,8% (n=29) e corticosteroides tópicos com 25% (n=28). Também foram utilizadas fototerapia UVA‐1, imiquimode tópico e combinações de fototerapia NB‐UVB com corticosteroides tópicos, interferona ou imiquimode, bem como PUVA com metotrexato. O tempo médio de resposta ao tratamento foi de oito meses (IIQ 5‐14), com 31,25% (n=35) obtendo resposta completa, 33,04% (n=37) obtendo resposta parcial e 11,61% (n=13) não obtendo resposta. Nenhuma informação sobre resposta clínica foi relatada em 24,1% (n=27) dos casos. A tabela 5 contém informações sobre terapias de segunda e terceira linhas.
Linhas de tratamento implementadas, tipo de tratamento e tempo de resposta
| Item | Primeira linha, frequência (porcentagem) | Segunda linha, frequência (porcentagem) | Terceira linha, frequência (porcentagem) | |||
|---|---|---|---|---|---|---|
| Tratamento | Fototerapia NB‐UVB | 31 (27,67) | Sem dados | 38 (33,93) | Sem dados | 71 (63,39) |
| Fototerapia PUVA | 29 (25,89) | Corticosteroide tópico | 20 (17,86) | Corticosteroide tópico | 5 (4,46) | |
| Corticosteroide tópico | 28 (25) | Fototerapia PUVA | 12 (10,71) | Fototerapia NB‐UVB | 2 (1,79) | |
| Fototerapia UVA1 | 3 (2,67) | Imiquimode tópico | 11 (9,82) | Interferona | 2 (1,79) | |
| Corticosteroide tópico e NB‐UVB | 3 (2,67) | Fototerapia NB‐UVB | 6 (5,36) | Doxorrubicina | 2 (1,79) | |
| Imiquimode tópico | 2 (1,79) | Corticosteroide tópico e PUVA | 6 (5,36) | Fototerapia PUVA | 1 (0,89) | |
| PUVA e metotrexato | 2 (1,79) | Metotrexato | 4 (3,57) | Metotrexato | 1 (0,89) | |
| NB‐UVB e interferona | 2 (1,79) | PUVA e metotrexato | 2 (1,79) | Corticosteroide tópico e PUVA | 1 (0,89) | |
| NB‐UVB e imiquimode | 2 (1,79) | PUVA e interferona | 2 (1,79) | NB‐UVB e metotrexato | 1 (0,89) | |
| Outros | 8 (7,14) | Fototerapia UVA1 | 2 (1,79) | UVA1 e interferona | 1 (0,89) | |
| Sem dados | 2 (1,79) | Radioterapia | 1 (0,89) | Interferona e isotretinoína | 1 (0,89) | |
| Retinoide oral | 1 (0,89) | |||||
| Corticosteroide tópico e NB‐UVB | 1 (0,89) | |||||
| UVA1 e interferona | 1 (0,89) | |||||
| PUVA e imiquimode | 1 (0,89) | |||||
| NB‐UVB e imiquimode | 1 (0,89) | |||||
| Vorinostat e PUVA | 1 (0,89) | |||||
| Metotrexato e corticosteroides orais | 1 (0,89) | |||||
| Tipo de resposta ao tratamento | Parcial | 37 (33,04) | Sem dados | 57 (50,89) | Sem dados | 77 (68,75) |
| Completa | 35 (31,25) | Completa | 21 (18,75) | Parcial | 5 (4,46) | |
| Sem dados | 27 (24,11) | Parcial | 13 (11,61) | Completa | 4 (3,57) | |
| Nula | 13 (11,61) | Nula | 5 (4,46) | Nula | 2 (1,79) | |
| Piora | 0 (0,00) | Piora | 4 (3,57) | Piora | 0 (0,00) | |
| Tempo de resposta ao tratamento, mediana (IIQ) | 8 (5‐14) | Tempo de resposta ao tratamento, mediana (IIQ) | 4 (0,00‐10) | Tempo de resposta ao tratamento, mediana (IIQ) | 0 (0,00‐0,75) | |
Nota: dados coletados pelo autor em 2021.
A progressão para uma fase avançada (> IIB) ocorreu em nove dos 82 casos em que o estadiamento inicial e final puderam ser determinados durante o seguimento, representando 8,04% da população total do estudo. Em seis dos 82 casos, a mediana do tempo de progressão foi de 46 meses. No subgrupo de pacientes que progrediram, 55,5% eram homens (cinco de nove casos), com mediana de idade de 59 anos para ambos os gêneros (IIQ 43‐96). Além disso, a variante foliculotrópica foi observada em 44,4% (quatro de nove casos), associação com outros linfomas em 22,2% (dois de nove casos), imunomarcação CD30+em 44,4% (quatro de nove casos), envolvimento hematológico em um caso (11,1%) e adenomegalia em um paciente (11,1%). Dos nove pacientes que progrediram, cinco evoluíram a óbito, quatro pela doença e um por causa não relacionada.
DiscussãoApós análise das características sociodemográficas identificadas no presente estudo, a mediana da idade foi de 53 anos, o que está de acordo com a literatura, que geralmente indica que essa condição é mais comum na sexta década de vida.4 Além disso, o gênero masculino é mais comumente afetado (56%), com proporções homem:mulher de até 2,1:1,4,7 o que é consistente com o estudo de coorte PROCLIPI (PROspective International Cutaneous Lymphoma Prognostic Index), que mostra proporção homem:mulher de 1,7:1.4
No presente estudo, o tempo decorrido entre o início da lesão e o diagnóstico foi de 60 meses (IIQ 24‐96). Esse achado é maior do que os períodos relatados em uma coorte global, que mostrou atraso de 36 meses,4 e em um estudo brasileiro, que encontrou um atraso de 51,08 meses,8 número mais próximo da presente população latino‐americana e sob condições sociodemográficas semelhantes. Isso pode ser decorrente da falta de conhecimento sobre a doença entre os profissionais envolvidos com os cuidados primários, do acesso limitado aos serviços de saúde e do polimorfismo clínico da doença.
Além disso, neste estudo, a variante clínica mais comum foi a clássica (67,9%; n=76), seguida da foliculotrópica (16%; n=18). Esse número é comparável aos 17,8% encontrados no estudo PROCLIPI nas fases iniciais de MF,4 mas é superior aos 10% de variante foliculotrópica encontrada em uma coorte holandesa de 306 pacientes.9
No presente estudo, a variante hipopigmentada foi encontrada em 10,71% (n=12) dos participantes, com mediana de idade de 53 anos (IIQ 26,5‐46), semelhante ao estudo brasileiro realizado por Amorim et al. No entanto, sua coorte incluiu pacientes pediátricos, nos quais esse subtipo da doença é mais comum, diferentemente do presente estudo, em que essa faixa etária não foi incluída.8 O presente estudo identificou pacientes na sétima década de vida com essa variante, indicando possível apresentação tardia dessa variante na população sul‐americana. Além disso, foram incluídos pacientes com diversos fototipos, o que é diferente do relatado no estudo PROCLIPI4 e em outros estudos, incluindo coortes asiáticas, que mostram maior prevalência de MF hipopigmentada em fototipos altos.10
O tratamento de primeira linha mais utilizado no presente estudo foi a fototerapia NB‐UVB, seguida de fototerapia PUVA e corticoides tópicos. Isso é diferente do que foi encontrado na análise do tratamento para MF em fase inicial no estudo PROCLIPI,11 no qual as terapias mais utilizadas foram esteroides tópicos (39,2%), seguidos de PUVA (18,5%) e UVB (18,4%), com taxas de resposta globais de 68%, 83% e 74%, respectivamente.
A fototerapia NB‐UVB apresentou taxa de resposta completa de 35,5% (11 de 31 casos), taxa de resposta parcial de 22,6% (sete de 31 casos) e taxa de resposta nula de 6,5% (dois de 31 casos), com mediana de tempo para observar a melhor resposta de 10,5 meses (IIQ 4,5‐15). Por sua vez, a fototerapia PUVA levou a uma taxa de resposta completa e parcial de 37,9% (11 de 29 casos) e a uma taxa de resposta nula de 6,89% (dois de 29 casos), com mediana de tempo de resposta global de oito meses (IIQ 5‐13).
Os corticosteroides tópicos mostraram taxa de resposta completa da doença de 25% (sete de 28 casos), taxa de resposta parcial da doença de 25% (sete de 28 casos) e taxa de resposta nula de 17,9% (cinco de 28 casos), com mediana de tempo para observar a melhor resposta de sete meses (IIQ 4‐10). Essas taxas são inferiores às relatadas no estudo PROCLIPI sobre tratamento na fase inicial.11 Outros estudos relataram, com o uso da terapia NB‐UVB, taxa de remissão completa de 54,2% a 81%, com intervalo médio de recaída de dois a 66 meses, e taxas de resposta de 50% a 88% no estágio IA com NB‐UVB. Com a fototerapia PUVA, as taxas de resposta oscilaram entre 50% e 60% no estágio IB.12,13
Em relação ao prognóstico e à taxa global de progressão da doença dos pacientes incluídos nesse estudo, constatou‐se que 8,04% (n=9) progrediram da fase inicial (IA‐IIA) para as mais avançadas (> IIB) em um seguimento de 10 anos, período de seguimento inferior ao relatado por Quaglino et al., que descrevem uma taxa de progressão de 29,7% em um período de seguimento de 14,5 anos.14 Da mesma maneira, um estudo retrospectivo realizado no Brasil por Amorim et al. estimou uma taxa de progressão de 29,4% com seguimento de 7,85 anos.8 O menor percentual de progressão encontrado no presente estudo poderia ser explicado pela representação de pacientes nas fases muito iniciais da doença (64% em estádio IA), juntamente com um subgrupo de pacientes com a variante hipopigmentada (10,7%) que apresentam prognóstico muito favorável em geral.
Ao caracterizar os pacientes do presente estudo que apresentaram progressão, constatou‐se que a idade (mediana 59 anos, IIQ 43‐96) atuou como fator prognóstico adverso para progressão (p=0,026), como mencionado por Scarisbrick et al.5 Outros potenciais fatores prognósticos mencionados na literatura e encontrados nesse subgrupo foram: a variante foliculotrópica, observada em 44,4% dos pacientes que apresentaram progressão, categorizada na literatura como de mau prognóstico em virtude do maior risco de progredir para fases avançadas9 e menor taxa de sobrevida global. Estudo colombiano de Pérez et al. relatou sobrevida global de cinco anos de 62% em pacientes com MF foliculotrópica e 40% em pacientes com a mesma variante, mas com doença avançada.15
A presença de imunorreatividade com CD30, encontrada em 44,4% dos pacientes que progrediram, é achado significante, pois foi relatada em vários estudos como importante característica imunopatológica associada a maior risco de progressão da doença e aumento das taxas de mortalidade.7
Linfadenopatia foi observada em 11,1% dos pacientes, confirmando sua maior associação com fases avançadas da doença e pacientes com síndrome de Sézary, em comparação com aqueles em fases iniciais.16
A presença de linfomas concomitantes ao diagnóstico foi observada em 22,2% dos casos e tem sido relatada na literatura como fator de risco para evolução estável da doença ou progressão para fases avançadas. Além disso, ter o diagnóstico de micose fungoide é fator de risco para o desenvolvimento de outros tipos de linfomas cutâneos, como explicado no estudo conduzido nos Estados Unidos por Jawed et al.17
Ao comparar os dados do presente estudo com o estudo de coorte retrospectivo conduzido por Miyashiro et al., envolvendo 727 pacientes, constatou‐se que o diagnóstico de síndrome de Sézary, idade ≥ 60 anos, variante foliculotrópica, variante eritrodérmica, fase clínica avançada, níveis elevados de lactato desidrogenase e a presença de transformação em grandes células foram associadas a pior prognóstico da doença.18
Por fim, no presente estudo, a mortalidade geral foi de 12,5% (n=14), com 10 pacientes evoluindo a óbito por linfoma, um por COVID‐19 e três por causas não relacionadas à doença. Esses achados são consistentes com a literatura, que afirma que a MF na fase inicial tem mediana de sobrevida de cinco anos de mais de 80%, em comparação com a doença avançada, que tem taxa de sobrevida prevista de cinco anos de cerca de 50%.11 Metanálise recente encontrou taxa de sobrevida de cinco anos de 85,8% para o estágio IB, 62,2% para o estágio IIB, 59,7% para o estágio IIIA, 54% para o estágio IIIB, 52,5% para o estágio IVA1, 34% para o estágio IVA2 e 23,3% para estágio IVB.19
ConclusãoA MF na fase inicial é doença com bom prognóstico na maioria dos pacientes, com taxa de progressão de 8% (n=9).
Suporte financeiroNenhum.
Contribuição dos autoresSantiago Andrés Ariza Gómez: Concepção e planejamento do estudo; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação da versão final do manuscrito.
Paula Alejandra Dubeibe Abril: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Oscar Enrique Niebles Sincelejo: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Henry Santiago Leal Reina: Concepção e planejamento do estudo; obtenção dos dados ou análise e interpretação dos dados; análise estatística; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ariza Gómez SA, Dubeibe Abril PA, Niebles Sincelejo OE, Reina HSL. Risk of progression of early‐stage mycosis fungoides, 10‐year experience. An Bras Dermatol. 2024;99:407–13.
Trabalho realizado no San José Hospital e Private Dermatology Oncology Center, Bogotá, Colômbia.