A imunoterapia representa avanço importante na terapia de neoplasias malignas, tendo sido o melanoma sua primeira liberação, ganhando com o passar do tempo outras indicações. Seu princípio terapêutico é a ativação de linfócitos‐T, retirando sua inibição com anticorpos monoclonais voltados a proteínas ou receptores com efeito inibidor.1 O Nobel de Medicina de 2018 foi agraciado aos descobridores dessa possibilidade de liberar células‐T no tratamento oncológico, iniciando uma nova era.
Em 2011, ipilimumabe (um anticorpo anti‐CTLA‐4) foi aprovado para o tratamento de melanoma metastático, seguido pela aprovação de nivolumabe e pembrolizumabe em 2014 (ambos anti PD‐1), todos para melanoma.1 Posteriormente, houve liberação para outras neoplasias, bem como da terapia combinada de dois anticorpos, com efeito somatório, como ipilimumabe + nivolumabe para melanoma em 2015.1
Seus efeitos adversos ocorrem da agressão de tecidos não neoplásicos pelas células T ativadas, sendo mais comum tireoidite (em 10% dos pacientes recebendo anti‐PD‐1 e até 20% na terapia combinada de ipilimumabe + nivolumabe), hipofisite (5% a 10% dos pacientes, mais comum com ipilimumabe) e insuficiência adrenal.2 Colite, manifestações reumatológicas (lembrando artrite reumatoide, polimialgia reumática, polimiosite e síndrome de Sjögren), neurológicas e cardíacas (miocardite apresenta alta mortalidade nesses pacientes) também são descritas.
A pele também pode ser envolvida, com manifestações variando desde prurido a exantemas, psoríase, líquen plano, penfigoide bolhoso e até reações graves no espectro Stevens‐Johnson/Lyell.2,3 Vitiligo é mais comum em pacientes tratados de melanoma, sugerindo imunidade contra melanócitos neoplásicos e epidérmicos.2
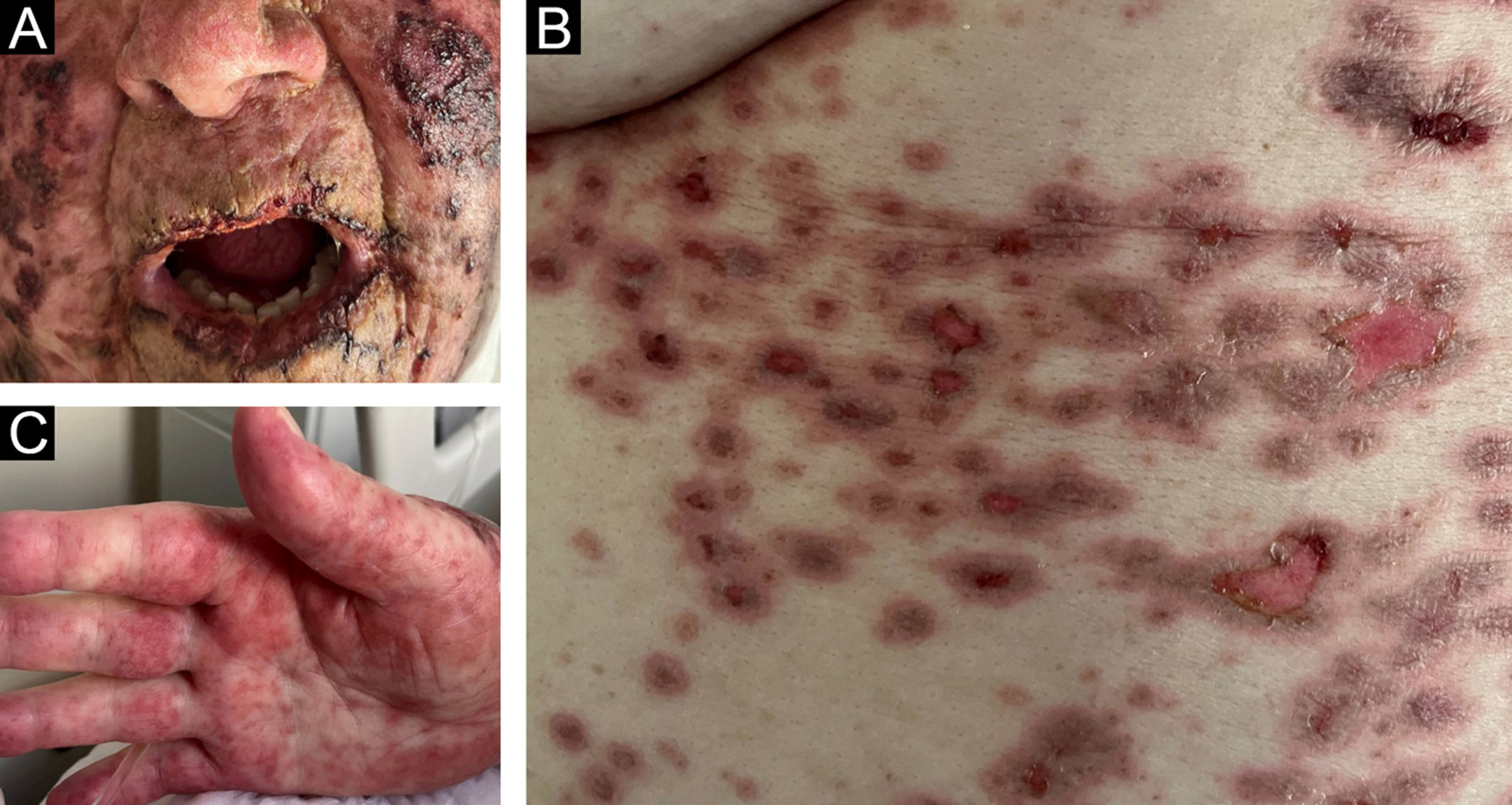
Descrevemos uma paciente de 83 anos, do sexo feminino, previamente hipertensa, com histórico de excisão de timoma em 2022. Dois anos após, apresentou lesão vegetante no calcanhar direito, cujo exame histológico demonstrou neoplasia maligna indiferenciada, estendendo‐se ao derma reticular; o exame imuno‐histoquímico (IHQ) foi positivo para marcadores melanocíticos, confirmando melanoma. Dada a dificuldade da abordagem cirúrgica, foi indicada terapia com pembrolizumabe pela oncologia. Dez dias após o início do tratamento, a paciente apresentou dor na cavidade oral com surgimento de crostas (fig. 1A). Havia também lesões palmares (fig. 1B) e, com a disseminação do quadro, surgiram lesões em alvo, com erosão central (fig. 1C).
Em função desse quadro, a paciente foi internada recebendo terapia com corticoide sistêmico. Apesar da terapêutica e do uso de antibióticos sistêmicos, a paciente evoluiu para sepse e êxito letal.
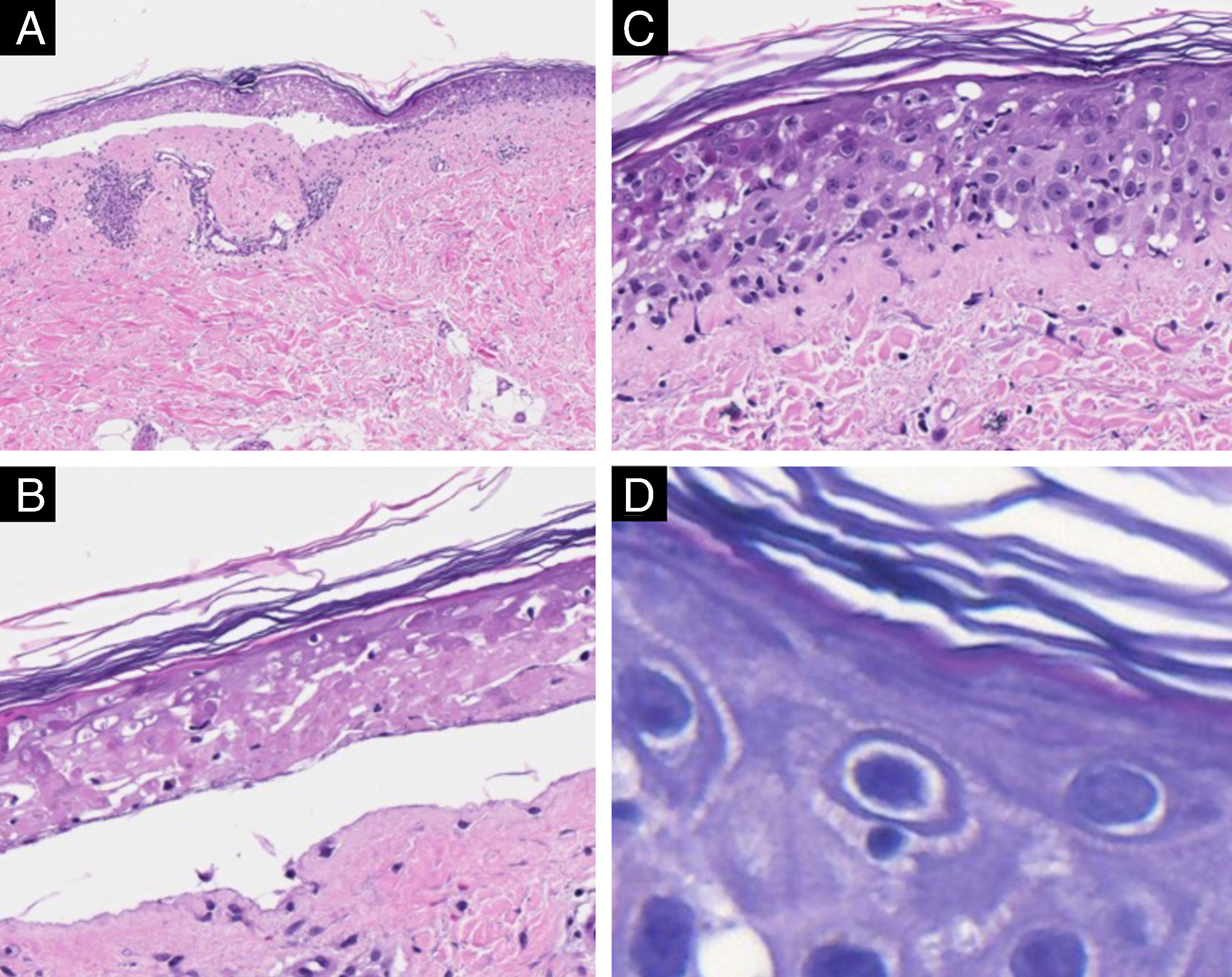
Foi realizada biopsia de lesão cutânea, na qual se observou necrose proeminente da epiderme com seu descolamento (fig. 2A). Em exame detalhado, identificou‐se necrose epidérmica na área da bolha (fig. 2B). Na transição para a área não afetada, havia necrose de queratinócitos e presença de inúmeros linfócitos na epiderme (fig. 2C), e em grandes aumentos várias figuras de satelitose foram vistas nessa mesma área (fig. 2D). A derme exibiu escasso infiltrado inflamatório perivascular linfocitário.
Microscopia óptica com Hematoxilina & eosina. (A) Descolamento epidérmico e discreto processo inflamatório na derme (×100). (B) Detalhe da necrose epidérmica no centro da lesão (×200). (C) Detalhe da borda da lesão com necrose isolada de queratinócitos e exocitose linfocitária (×200). (D) Satelitose linfocitária na borda da lesão (×400).
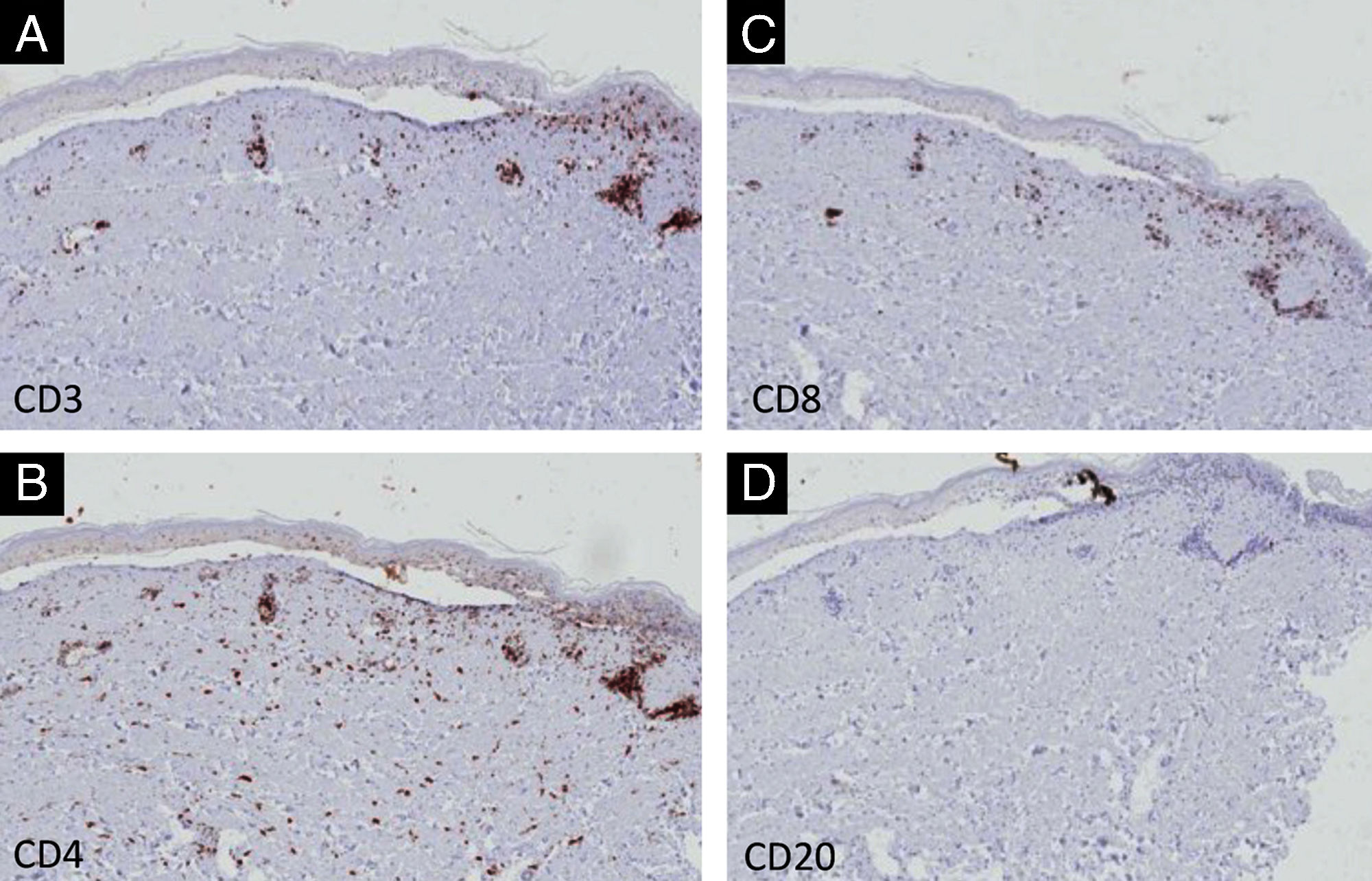
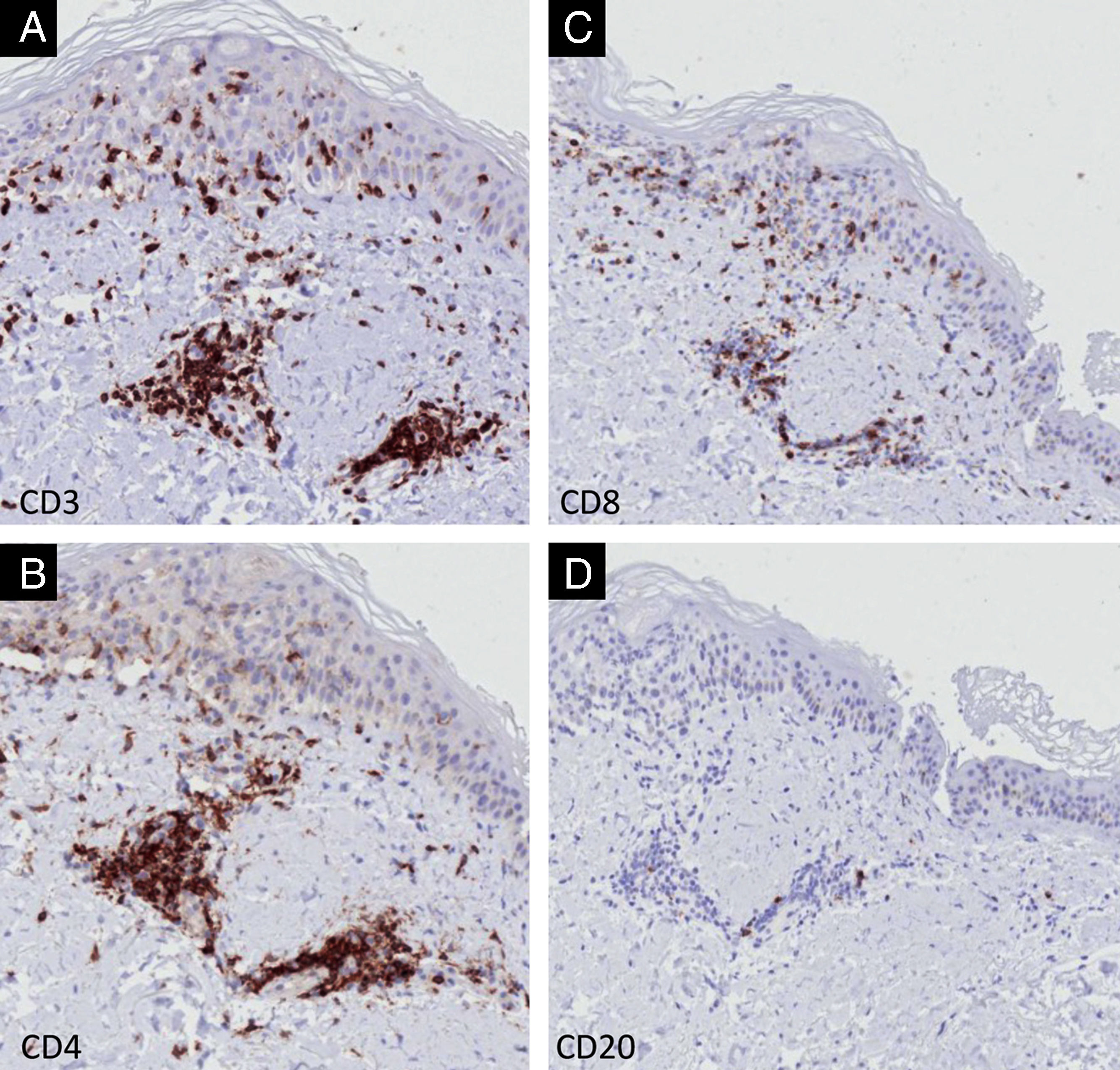
À IHQ com anticorpos anti‐CD3, CD4, CD8 e CD20, com intuito de identificar os subtipos de linfócitos envolvidos, observou‐se com pequenos aumentos discreto infiltrado dérmico com a expressão de células CD3, CD4 e CD8 positivas, sendo negativas com o anticorpo CD20 (fig. 3). O exame detalhado demonstra que o infiltrado na derme é intenso com células CD3 e CD4 positivas e menos intenso com células CD8 (fig. 4). Na epiderme, o infiltrado é mais intenso por células CD3 positivas seguido por células CD8 positivas (fig. 4). Os resultados com o marcador de linfócitos B, anti‐CD20, foram negativos.
Dada a possibilidade clínica de pênfigo paraneoplásico, foram realizadas imunofluorescências indiretas em bexiga de rato e pele normal, as quais foram negativas.
Há inúmeros relatos de síndrome de Stevens‐Johnson associada ao uso de pembrolizumabe e de maneira semelhante à paciente relatada, alguns com somente uma dose da imunoterapia;4–7 porém, há relatos inclusive após a nona dose.8 Também há relatos com outros anticorpos monoclonais utilizados em imunoterapia.
Nossos achados histológicos são semelhantes aos descritos, com necrose epidérmica e pouco infiltrado dérmico.9 Há somente um relato de IHQ, demonstrando predomínio de células CD8, em leve discordância com nossos achados de predominância epidérmica de células CD3 juntamente com CD8 positivas; a proteína CD3 participa da ativação das células CD8 positivas, podendo haver sua coexpressão.9 É necessário exame de mais casos com IHQ para melhor compreensão desses achados.
A satelitose encontrada neste caso é característica de afecções mediadas por células‐T, como na doença enxerto‐hospedeiro, e demonstra histologicamente a ativação das células T pela imunoterapia.10
Os achados de IHQ confirmam a agressão epidérmica por células de linhagem T.
Os relatos da literatura de síndrome de Stevens‐Johnson por pembrolizumabe têm neoplasias de base, desfechos e intensidades variadas, inclusive com associação com outras enfermidades autoimunes,7,8 as quais podem contribuir para a gravidade dos casos, devendo dermatologistas estar atentos a essas possibilidades.
Suporte financeiroNenhum.
Contribuição dos autoresHiram Larangeira de Almeida Jr: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Debora Sarzi Sartori: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Aline Paganelli: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Karen Francisca Borges Sias: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Luísa Coelho Capuá: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Darlan Cleerson Farezin: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: de Almeida Jr HL, Sartori DS, Paganelli A, Sias KFB, Capuá LC, Farezin DC. Pembrolizumab‐induced Stevens‐Johnson syndrome. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.08.011.
Trabalho realizado na Universidade Federal de Pelotas, Pelotas, RS, Brasil.