O diagnóstico de micose fungoide é desafiador pela inespecificidade dos achados clínicos e histopatológicos. A literatura indica um atraso médio de 4 a 6 anos para um diagnóstico conclusivo. O refinamento dos critérios histopatológicos para o diagnóstico de pacientes em estágios iniciais da doença é considerado de interesse.
ObjetivosEstudar os aspectos histopatológicos da micose fungoide precoce e a aplicabilidade, em forma retrospectiva, do algoritmo diagnóstico proposto por Pimpinelli et al.
MétodosEstudo observacional, retrospectivo, transversal, baseado na revisão de exames histopatológicos de pacientes com suspeita de micose fungoide. Os prontuários médicos foram revisados e análise imuno‐histoquímica complementar foi feita.
ResultadosForam incluídos 67 pacientes. As características histopatológicas mais frequentes foram infiltrado linfoide perivascular superficial (71,6%), epidermotropismo (68,7%), atipia linfocitária (63,8%), hiperceratose (62,7%) e acantose (62,7%). Quarenta e três pacientes alcançaram 4 pontos no algoritmo por avaliação clínica e histológica. A imuno‐histoquímica foi feita em 23 dos 24 pacientes com menos de 4 pontos. Desses 23, 22 pontuaram 1 ponto, permitindo um total de 61 pacientes (91%) com o diagnóstico de micose fungoide precoce.
Limitações do estudoSeu caráter retrospectivo, tamanho reduzido da amostra e aplicação incompleta do algoritmo.
ConclusõesA aplicação do algoritmo Pimpinelli et al., mesmo que de forma incompleta, aumentou o percentual de casos diagnosticados como micose fungoide. A aplicação rotineira do algoritmo pode contribuir para o manejo precoce específico e, consequentemente, melhores resultados evolutivos nesse grupo de pacientes.
O diagnóstico de micose fungoide (MF) é desafiador.1 A literatura indica um atraso médio de 4‐6 anos para que seja estabelecido2‐4 e a correlação clínico‐patológica é fundamental.5 Pimpinelli et al. propuseram um algoritmo para o diagnóstico de MF6 em estágio inicial que fornece pontuação baseada em achados clínicos, histopatológicos e imuno‐histoquímicos, bem como a investigação do rearranjo gênico dos receptores de células‐T clonais (TCR). A aplicação do algoritmo foi endossada pela Sociedade Internacional de Linfoma Cutâneo (SILC) e foi considerada em artigos de revisão recentemente publicados.1,5
Com o objetivo de estudar os aspectos histopatológicos dos estágios iniciais da MF e confirmar a aplicabilidade do algoritmo proposto por Pimpinelli et al., revisamos os primeiros exames histopatológicos feitos em pacientes com MF que haviam sido acompanhados e tratados no ambulatório de Fotodermatologia do Hospital Universitário da Universidade Federal do Rio de Janeiro.
MétodosEstudo observacional transversal, com base na revisão dos primeiros exames histopatológicos feitos em pacientes adultos (18 anos ou mais) com MF, diagnosticados, tratados e acompanhados (mínimo de 5 anos) no ambulatório de Fotodermatologia do Hospital Universitario de janeiro de 2000 a dezembro de 2015.
Todos os pacientes incluídos no estudo tiveram diagnóstico final de MF, foi estabelecido durante o período de acompanhamento pelos seguintes critérios:
- •
Evolução clínica típica (progressão de lesões maculares as placas e daí a tumores, em alguns casos), de acordo com a chamada forma clássica de Alibert‐Bazin.5,7
- •
Achados típicos em exames histopatológicos subsequentes (epidermotropismo de linfócitos atípicos e microabscessos de Pautrier).8
Os pacientes foram classificados como em estágio inicial de acordo com as proposições da SILC e da Organização Europeia de Pesquisa e Tratamento de Câncer (OEPTC/EORTC). Apresentavam doença no estágio IA (T1N0M0), IB (T2N0M0) ou IIA (T1 ou 2N1 ou 2M0) de acordo com TNMB.9
Foram incluídos apenas os casos com blocos de parafina disponíveis para análise imuno‐histoquímica.
Dois dermatopatologistas experientes, sem conhecimento do relato original, revisaram ao mesmo tempo o exame histopatológico inicial de cada paciente e concordaram na análise dos parâmetros histológicos específicos estabelecidos. Todas as amostras correspondiam a biópsias por punch de 4‐5 mm. Os pacientes com mais de uma amostra foram avaliados considerando‐se a análise global conjunta das amostras para concluir no sentido de um diagnóstico de compatibilidade para MF ou não. Foram avaliados apenas os cortes corados pela hematoxilina & eosina e blocos de parafina foram selecionados para subsequente estudo imuno‐histoquímico.
Dados clínicos foram coletados com o objetivo de caracterizar a população estudada e explorar os critérios clínicos propostos por Pimpinelli et al.6 O estadiamento foi analisado em modo ordinal qualitativo, de acordo com o protocolo TNMB vigente.9
A técnica de imuno‐histoquímica (Serviço de Patologia, Instituto Nacional de Infectologia Evandro Chagas/Fiocruz) foi aplicada quando critérios clínicos e histopatológicos não alcançaram os 4 pontos necessários para o diagnóstico.6 Cortes histológicos reagiram com CD3 (polyclonal de coelho, 1/100, Cell MarqueTM), CD2 (MRQ‐11, monoclonal de camundongo, 1/50, Cell MarqueTM), CD5 (SP19, monoclonal do coelho, 1/100, marcaTMda pilha) e CD7 (EP132, monoclonal de camundongo, 1/100, Cell MarqueTM) como anticorpos primários. Para caracterizar a discordância dermoepidérmica, foram consideradas somente as amostras com linfócitos CD3+ na epiderme, a fim assegurar a presença das células nessa localização. A investigação do rearranjo de gênico de Receptores de Células‐T clonais (TCR) não está disponível em nosso laboratório no momento.
As variáveis histopatológicas, clínicas e imuno‐histoquímicas estudadas são apresentadas na forma de tabela, como conteúdo suplementar online. Os dados foram tabulados em planilhas do Excel 2011 (Microsoft® Excel® for Mac 2011/Version: 14.2.0) e analisados de forma descritiva.
O estudo obedece a Resolução 466/12 do Conselho Nacional de Saúde, foi registrado na plataforma Brasil e foi aprovado pelo Comitê de Ética em Pesquisa do HUCFF/UFRJ (CAAE 59235916.9.0000.5257).
ResultadosDe 102 pacientes com MF inicial primeiramente selecionados, 67 tinham exames histopatológicos com blocos de parafinas disponíveis para estudo imuno‐histoquímico. Todos esses 67 foram incluídos, uma vez que o seguimento confirmou diagnóstico de MF segundo critérios de inclusão do estudo.
Homens e mulheres foram quase igualmente afetados. A idade média encontrada de 53,27 anos. A maioria dos pacientes apresentava múltiplas lesões de tamanhos variáveis (98,5%), afetavam áreas foto‐rotegidas (98,5%), com evolução crônica e progressiva (o tempo médio entre o início dos sintomas e o diagnóstico final foi de 51,31 meses, variou de 2 a 360 meses). A maioria dos pacientes apresentava lesões em placas (64,2%). Poiquilodermia foi encontrada apenas em 14,8% dos casos. A fase IB representou 52,2% da amostra. O tempo médio de seguimento foi de 8,25 anos.
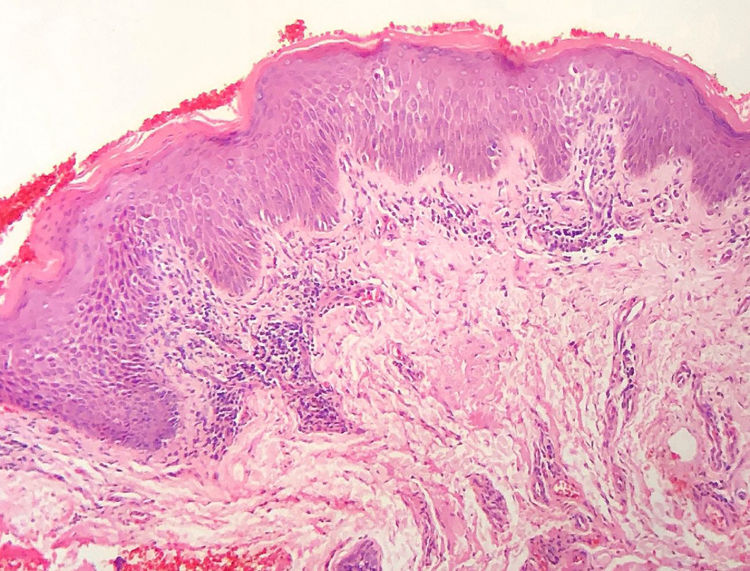
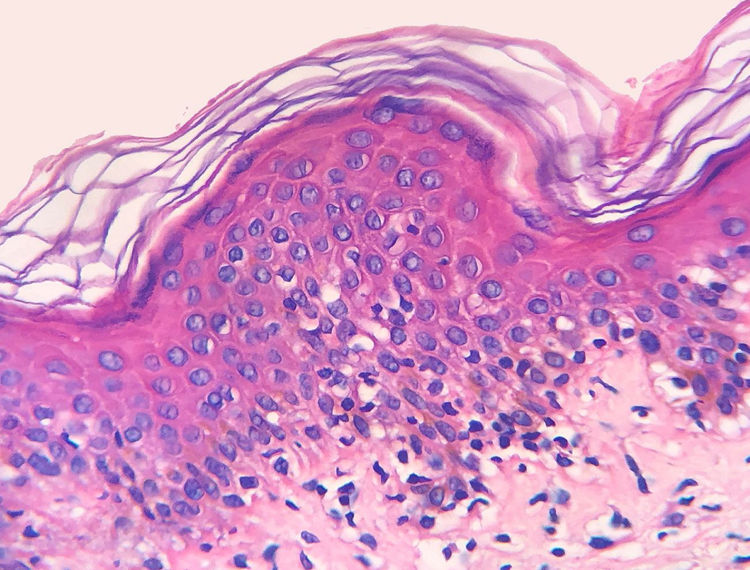
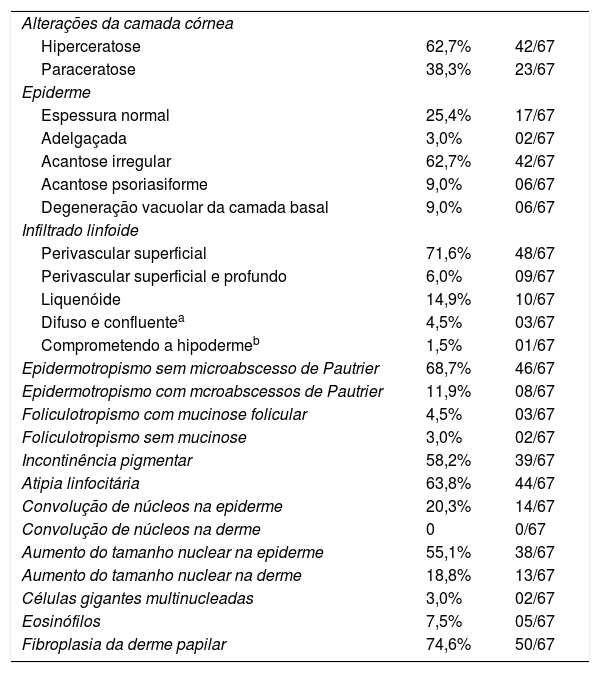
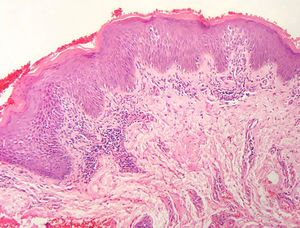
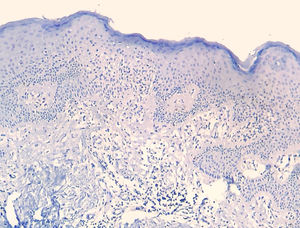
A frequência das variáveis histopatológicas analisadas para a avaliação de biópsias com suspeita de MF é apresentada na tabela 1. Infiltrado linfoide perivascular superficial, epidermotropismo sem microabscessos de Pautrier, atipia linfocitária, especialmente representada pelo aumento do tamanho nuclear de linfócitos localizados na epiderme, hiperceratose e acantose foram os achados histopatológicos predominantes (figs. 1 e 2).
Caracterização histopatológica da amostra
| Alterações da camada córnea | ||
| Hiperceratose | 62,7% | 42/67 |
| Paraceratose | 38,3% | 23/67 |
| Epiderme | ||
| Espessura normal | 25,4% | 17/67 |
| Adelgaçada | 3,0% | 02/67 |
| Acantose irregular | 62,7% | 42/67 |
| Acantose psoriasiforme | 9,0% | 06/67 |
| Degeneração vacuolar da camada basal | 9,0% | 06/67 |
| Infiltrado linfoide | ||
| Perivascular superficial | 71,6% | 48/67 |
| Perivascular superficial e profundo | 6,0% | 09/67 |
| Liquenóide | 14,9% | 10/67 |
| Difuso e confluentea | 4,5% | 03/67 |
| Comprometendo a hipodermeb | 1,5% | 01/67 |
| Epidermotropismo sem microabscesso de Pautrier | 68,7% | 46/67 |
| Epidermotropismo com mcroabscessos de Pautrier | 11,9% | 08/67 |
| Foliculotropismo com mucinose folicular | 4,5% | 03/67 |
| Foliculotropismo sem mucinose | 3,0% | 02/67 |
| Incontinência pigmentar | 58,2% | 39/67 |
| Atipia linfocitária | 63,8% | 44/67 |
| Convolução de núcleos na epiderme | 20,3% | 14/67 |
| Convolução de núcleos na derme | 0 | 0/67 |
| Aumento do tamanho nuclear na epiderme | 55,1% | 38/67 |
| Aumento do tamanho nuclear na derme | 18,8% | 13/67 |
| Células gigantes multinucleadas | 3,0% | 02/67 |
| Eosinófilos | 7,5% | 05/67 |
| Fibroplasia da derme papilar | 74,6% | 50/67 |
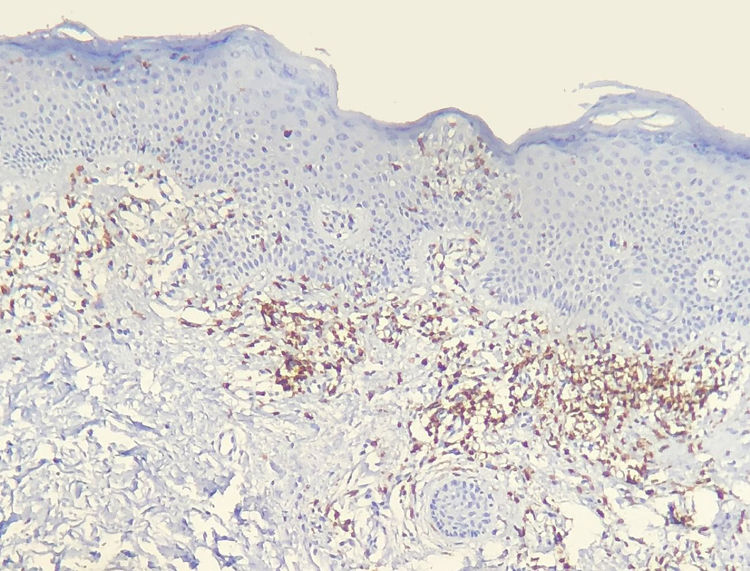
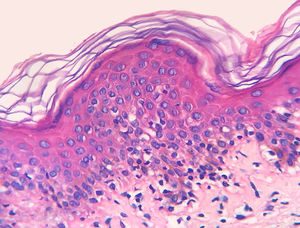
Os resultados do estudo imuno‐histoquímico feito em 23 das 24 amostras elegíveis são mostrados nas tabelas sob a forma de conteúdo suplementar online. Um dos blocos de parafina selecionados não forneceu tecido suficiente para completar as reações. Diminuição na expressão de marcadores de células‐T e discordância dermoepidérmica (figs. 3 e 4) foram observados na maioria dos casos.
A impressão diagnóstica com base na revisão dos achados histopatológicos em conjunto com os dados referentes à aplicação do algoritmo modificado de Pimpinelli et al. é mostrada na tabela 2.
Análise comparativa entre o diagnóstico através da revisão histopatológica e os critérios do algoritmo adaptado de Pimpinelli et al.6
| Pacientes | Critérios | (%) | n |
|---|---|---|---|
| Impressão diagnóstica compatível com MF | Revisão histopatológica isolada | 64,2% | 43/67 |
| 4 pontos no algoritmo | Clínica+Histopatologia | 64,2% | 43/67 |
| Clínica+Histopatologia+Imuno‐histoquímica | 91,0% | 61/67 | |
| <4 pontos no algortimo | Necessitariam de complementação com pesquisa de clonalidade | 9,0% | 06/67 |
Fez‐se um estudo observacional de delineamento transversal, baseado na revisão de exames histopatológicos de pacientes com suspeita diagnóstica de MF, que durante o período de seguimento tiveram o diagnóstico de MF confirmado. Os exames histopatológicos foram complementados com o perfil imuno‐histoquímico com o objetivo de aplicar o algoritmo diagnóstico proposto por Pimpinelli et al. endossado por artigos recentes de revisão,1,5,6 sem a pesquisa de clonalidade dos receptores de células‐T.
Do ponto de vista clínico, a apresentação de MF seguiu o que é descrito na literatura, mais comumente com múltiplas máculas e/ou placas de tamanhos variados, afetavam áreas fotoprotegidas, com evolução crônica e progressiva (período médio de evolução: 51,31 meses).1,5–7,10 Esse perfil está de acordo com o que é proposto por Pimpinelli et al. em seu algoritmo de identificação para MF em estágio inicial; de modo que apenas um paciente (1,5%) marcou 1 ponto, enquanto o restante cumpriu o máximo de 2 pontos. Isso demonstra a boa correlação entre o que identificamos clinicamente com o que é proposto pelo algoritmo.6
A revisão histopatológica identificou alterações da camada córnea, com hiperceratose e paraceratose, que são alterações comuns nos estágios iniciais de MF, especialmente quando se considera a queixa de prurido e a presença de descamação em lesões tipo placa.2,7,8
O padrão de reação tecidual predominante foram o infiltrado linfoide perivascular superficial com incontinência pigmentar e a fibroplasia da derme papilar, enquanto padrão liquenoide perivascular superficial e profundo e o padrão difuso e confluente foram infrequentes. Maiores percentagens de infiltrado em distribuição liquenoide foram descritas nos estudos de Nagaraghi et al. e Massone et al.11,12 Entretanto, nossos resultados sustentam que somente pacientes com estágios iniciais de MF, com baixa carga tumoral, foram incluídos.2,13
Epidermotropismo estava presente em 68,7% dos pacientes analisados, indicado pelo alinhamento de linfócitos com halo ao logo da junção dermoepidérmica ou situados em posição suprabasal, desacompanhados de espongiose. O alinhamento dos linfócitos ao longo dos queratinócitos basais é achado na avaliação histopatológica dos exames de MF em estágios precoces14 e foi descrito por Sanchez & Ackermann, em 1979, como critério para o seu diagnóstico.11,15 Ao contrário, foliculotropismo e microabscessos de Pautrier foram raros, como proposto na literatura.2,13,14 No entanto, um grande estudo conduzido por Massone et al., com avaliação de 427 pacientes com MF em fase inicial, demonstrou maiores percentagens de microabscessos de Pautrier (19%), semelhantes aos achados de Nagaraghi et al. (presentes em até 66% dos pacientes com placa como lesão clínica elementar).11,12
A atipia de linfócitos, baseada no aumento de tamanho e/ou contorno cerebriforme dos núcleos, foi identificada em 63,8% dos pacientes. A valorização de critérios citológicos, tais como a hiperconvolução ou aumento do tamanho nuclear, para células situadas na epiderme ou na derme é disputada na literatura e parece ser considerada em publicações mais recentes.16–18 Nossos resultados mostraram que atipia linfocitária foi quase tão frequente quanto epidermotropismo, estava de acordo com a análise de autores anteriormente mencionados. Por outro lado, Massone et al. identificaram linfócitos atípicos em apenas 9% dos pacientes e propuseram que critérios arquiteturais, que envolvam o padrão de distribuição do infiltrado associado ao achado de epidermotropismo, seriam ser mais relevantes na fase inicial de MF.7
A revisão histopatológica considerou os achados compatíveis com o diagnóstico de MF em 64,2% dos casos. Portanto, em 35,8% (24 de 67) dos casos, o exame histopatológico por si só não permitiu diagnosticar MF. De fato, as taxas de falsos negativos em um primeiro exame atingem 40%.19 Entretanto, ao lado de um quadro histopatológico inespecífico, deve‐se enfatizar o valor da ausência de critérios para se estabelecer outro diagnóstico específico, como eczemas ou psoríase. Assim, em 24 pacientes em que o diagnóstico de MF não pode ser feito, esse também não poderia ser excluído.
Ainda em relação a esses 24 casos, o principal aspecto desafiador para o diagnóstico de MF foi a escassez de infiltrado, compatível com estágios iniciais da doença, e em correlação com lesões clinicamente não infiltradas.2,13,16 Além disso, os achados histopatológicos podem ser mascarados pelo uso de medicamentos, tais como corticosteroides tópicos, que minimizam o infiltrado linfocitário e atenuam a presença dessas células na junção dermoepidérmica. Considerando que esses medicamentos são de fácil acesso, adquiridos sem prescrição, observamos frequentemente em nossa prática clínica que os pacientes fazem uso inadvertido desse grupo de substâncias. Pacientes com suspeita clínica de MF devem idealmente interromper a aplicação de esteroides tópicos, bem como o uso de imunossupressores sistêmicos (se for o caso), de 2 a 4 semanas antes de fazer biópsia, com o objetivo de não prejudicar a análise histopatológica, pode‐se manter o uso de emolientes.6 O delineamento retrospectivo do estudo dificulta a determinação do uso de medicamentos no momento da primeira biópsia, representa, portanto, uma limitação a ser considerada.
A diminuição da expressão de marcadores de células T, tais como CD2, CD3, CD5 e CD7, em pacientes com MF tem por base a ideia de que, à medida que a doença progride, é identificado um fenótipo anormal predominante.6,13 Redução de CD2, CD3 e/ou CD5 em pelo menos 50% das células linfoides é um critério importante para a identificação de linfomas de células‐T.20 A perda de positividade parece ocorrer inicialmente nos linfócitos que permeiam a epiderme e mais tarde naqueles presentes na derme.6,20 Entre CD2, CD3, CD5 e CD7, aparentemente o critério mais específico seria a redução da expressão de CD7 para menos de 10% das células linfoides.6,21
Aplicando a análise imunofenotípica em 23 casos que não atenderam aos critérios de diagnóstico, 22 pontuaram no algoritmo. O critério mais prevalente foi a redução da positividade para menos de 50% do infiltrado para CD2 e/ou CD5, é, portanto, nesta análise, o critério mais sensível, semelhante ao proposto na literatura.6,20 Finalmente, 13 casos apresentaram o critério supostamente mais específico, com redução de CD7 para menos de 10%.6,21
Em 2015, Vandergriff et al. publicaram um estudo para validar o algoritmo de Pimpinelli et al. Os autores encontraram 87,5% de sensibilidade e 60% de especificidade para o diagnóstico e concluíram que o algoritmo é um método estatisticamente válido.22
Ainda que com reconhecida melhoria no diagnóstico de MF inicial, a pesquisa de rearranjo genético de TCR é complexa, não está amplamente disponível e apresenta diferenças entre taxas de detecção segundo as técnicas empregadas, número de amostras e a fase de MF (placa ou tumor).23–25 Mesmo sem incluir esse teste diagnóstico complementar, encontramos um aumento no percentual de diagnóstico de MF, de 64,2%, quando avaliada histopatologia de maneira isolada, para 91% quando aplicados os critérios diagnósticos disponíveis do algoritmo. Destacamos ainda que o desempenho do algoritmo poderia ter sido ainda melhor, uma vez que os 6/67 pacientes que não obtiveram pontuação suficiente poderiam tê‐la atingido caso fosse pesquisado rearranjo de TCR e, logicamente, esse tivesse sido positivo.
ConclusãoEmbora a correlação clínico‐patológica permaneça como padrão‐ouro, a aplicação dos critérios clínicos, histopatológicos e imuno‐histoquímicos do algoritmo de Pimpinelli et al. foi útil no diagnóstico de MF precoce e pode contribuir para uma melhoria de resultados para o paciente, propiciar tratamento específico mais precoce. Nossos resultados motivaram a adoção dos critérios do algoritmo na rotina prática em nosso departamento.
Como limitações do presente estudo destacamos seu caráter retrospectivo, o tamanho reduzido da amostra e a falta da pesquisa de clonalidade do rearranjo do TCR.
Suporte financeiroNenhum.
Contribuição dos autoresGustavo Moreira Amorim: Análise estatística; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Daniele Carvalho Quintella: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
João Paulo Niemeyer‐Corbellini: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Luiz Claudio Ferreira: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Marcia Ramos e Silva: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Tullia Cuzzi: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Amorim GM, Quintella DC, Niemeyer‐Corbellini JP, Ferreira LC, Ramos‐e‐Silva M, Cuzzi T. Validation of an algorithm based on clinical, histopathological and immunohistochemical data for the diagnosis of early‐stage mycosis fungoides. An Bras Dermatol. 2020;95:326–31.
Trabalho realizado nos Departamentos de Dermatologia e Anatomia Patológica, Hospital Universitário, Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.