Cromoblastomicose é infecção cutânea causada por fungos demáceos que assumem a forma de células muriformes no tecido. Manifesta‐se principalmente por placas verrucosas nos membros inferiores de trabalhadores rurais de países tropicais.
ObjetivosO objetivo primário desta revisão foi avaliar a acurácia de métodos diagnósticos para identificação de cromoblastomicose, considerando o exame histopatológico como o teste de referência.
MétodosAs bases de dados MEDLINE, LILACS e SciELO foram consultadas através dos termos “chromoblastomycosis” AND “diagnosis”. Os critérios de elegibilidade foram: estudos que avaliaram acurácia de testes para o diagnóstico de cromoblastomicose. Foram selecionados 11 estudos. A análise estatística incluiu o cálculo de sensibilidade e especificidade dos métodos diagnósticos.
ResultadosConsiderando o exame histopatológico como o teste de referência, a cultura apresentou sensibilidade (S) de 37,5% ‐ 90,9% e especificidade (E) de 100%, enquanto o exame micológico direto, S = 50% ‐ 91,6% e E = 100%. Considerando a cultura como teste de referência, a sorologia (técnicas de precipitação) apresentou S = 36% ‐ 99%; e E = 80% ‐ 100%, e o teste intradérmico, S = 83,3% ‐ 100% e E = 99,4% ‐ 100%.
Limitações do estudoPequeno número de estudos e resultados de sensibilidade muito discrepantes entre eles, impossibilitando o cálculo de medidas de resumo através de metanálise.
ConclusõesExame micológico direto, cultura, teste intradérmico e sorologia apresentaram valores de sensibilidade e especificidade para o diagnóstico de cromoblastomicose sem diferença significativa entre os estudos.
Cromoblastomicose é infecção crônica da pele e subcutâneo adquirida por inoculação de fungos demáceos da família Herpotrichiellaceae por meio de pequenos traumas. As espécies mais comuns implicadas na etiologia da doença são Fonsecaea pedrosoi, Fonsecaea monophora e Cladophialophora carrionii. Agentes menos encontrados são: Phialophora verrucosa, Rhinocladiella aquaspersa, Exophiala spp., além de outras espécies de Fonsecaea. Ocorre predominantemente em países tropicais e subtropicais.1
O termo cromoblastomicose foi empregado pela primeira vez em 1922 para definir doença cutânea causada por fungos demáceos que se apresentam no tecido sob a forma de estruturas marrons arredondadas, chamadas de células muriformes. A doença recebeu diferentes nomes em relatos de casos, como formigueiro, blastomicose negra, dermatite verrucosa comomicósica e dermatite verrucosa blastomicótica, doença de Fonseca, doença de Pedroso e doença de Carrion. Desde 1983, o termo cromoblastomicose tem sido utilizado para diferenciar essa entidade de infecções provocadas por fungos demácios que não se apresentam como células muriformes no hospedeiro, chamadas de feo‐hifomicose, as quais podem ser superficiais, cutâneas, subcutâneas e sistêmicas. Naquele mesmo ano, ficou estabelecido que o termo cromomicose não deve ser utilizado, pois em alguns períodos da história foi usado para definir a cromoblastomicose e evitar a confusão de células muriformes com leveduras, mas posteriormente adquiriu conceito mais amplo por alguns autores, incluindo casos de feo‐hifomicose.1,2
A população mais acometida é constituída por indivíduos que trabalham com solo ou plantas, como agricultores, jardineiros e lenhadores, entre 30 e 50 anos, do sexo masculino, e a maioria das lesões surge nos membros inferiores. Desse modo, a falta de luvas, calçados e vestimentas durante o trabalho é considerada fator de risco. Possível predisposição genética tem sido considerada.3
No ambiente, o fungo apresenta‐se como hifa, adquirindo forma muriforme no hospedeiro, considerada elemento de resistência aos mecanismos de defesa do sistema imune.1
A lesão surge como mácula ou pápula eritematosa, e evolui para diferentes formas clínicas, a depender da resposta imune celular: nodular, tumoral, em placa, verrucosa ou cicatricial. Torna‐se pruriginosa, e, em casos avançados, dolorosa. A disseminação ocorre por autoinoculação (facilitada pela coçadura) e por via linfática. A doença pode sofrer complicações: infecção bacteriana secundária, linfedema, anquilose e desenvolvimento de carcinoma espinocelular em feridas crônicas.4
O diagnóstico de cromoblastomicose é confirmado pela demonstração do fungo no exame micológico direto, no anatomopatológico ou na cultura.1
O exame direto com hidróxido de potássio (KOH 10‐40%) de escarificação da lesão permite identificar elementos fúngicos marrons redondos ou em forma de castanha, atravessados por septos longitudinais e transversos, denominados células muriformes.1 Os pontos pretos na superfície da lesão contêm fungos que sofreram eliminação transepidérmica e podem guiar a coleta da amostra.5
O crescimento do fungo em meios de cultura ocorre em quatro semanas. A colônia é escura e filamentosa. O cultivo em lâmina propicia a diferenciação entre os gêneros Fonsecaea, Phialophora, Cladophialophora e Rhinocladiella.1
O histopatológico da cromoblastomicose caracteriza‐se por hiperplasia pseudoepiteliomatosa, hiperceratose e acantose irregular, alternando com áreas de atrofia e abscessos; na derme, há reação inflamatória granulomatosa e supurativa com células gigantes. Os fungos aparecem como estruturas ovoides ou esféricas de parede grossa marrom‐escura, lembrando “moedas de cobre”, bem visíveis, isoladas ou agrupadas, dentro das células gigantes ou livres no tecido.6
O diagnóstico pode ser feito, ainda, por sequenciamento do material genético do fungo, técnica que possibilita identificar a espécie. Séries e relatos de casos têm empregado a reação em cadeia da polimerase (polymerase chain reaction – PCR) e outras técnicas moleculares para identificação de fungos demáceos em pacientes com cromoblastomicose.7–9Foram publicados estudos avaliando a sensibilidade e a especificidade de diferentes técnicas de sorologia em pacientes com cromoblastomicose causada por F. pedrosoi e C. carrionii, comparando com controles saudáveis ou com outras infecções fúngicas, como esporotricose e paracoccidioidomicose.10,11
Testes intradérmicos obtidos de cultura de F. pedrosoi e de outros agentes foram empregados comparando os resultados em pacientes com cromoblastomicose e em controles saudáveis ou com outras infecções, mas não estão disponíveis comercialmente.12–14Recentemente, as imagens dermatoscópicas de lesões de cromoblastomicose foram descritas e correlacionadas aos achados histopatológicos. À dermatoscopia, os autores encontraram pontos vermelho‐enegrecidos, crostas, escamas, estruturas ovoides amarelo‐alaranjadas sobre fundo róseo‐esbranquiçado e polimorfismo vascular.15–18O aspecto das células muriformes à microscopia eletrônica já foi descrito, caracterizando os melanossomos presentes na célula fúngica – organelas que armazenam melanina, e seu papel na patogenicidade do agente.19–22 Entretanto, não há estudos avaliando a sensibilidade ou a especificidade desse método para o diagnóstico de cromoblastomicose, o qual está restrito a centros de pesquisa.
Não há, até o momento, revisão sistemática avaliando a acurácia de testes diagnósticos em cromoblastomicose. Além disso, os estudos individuais avaliando a acurácia de métodos diagnósticos em cromoblastomicose consideram padrão‐ouro diferentes testes: cultura, exame histológico e exame micológico direto. Por fim, o papel do teste intradérmico e da sorologia, restritos a cenários de pesquisa, precisa ser definido.
O objetivo desta revisão foi avaliar a acurácia de exame micológico direto e cultura para identificação de cromoblastomicose em pacientes com suspeita da doença, considerando padrão‐ouro o exame histopatológico. Objetivos secundários foram a avaliação da acurácia do teste intradérmico e da sorologia para o diagnóstico de cromoblastomicose, tendo a cultura como teste de referência, e também a acurácia do exame histopatológico, em relação ao exame micológico direto.
MétodosO número de registro do protocolo desta revisão no PROSPERO é CRD42020166336.
A diretriz Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (PRISMA) adaptada para estudos de acurácia diagnóstica foi utilizada como guia para a metodologia desta revisão.23
Os critérios de elegibilidade foram: estudos de caso‐controle ou seccional/coorte avaliando acurácia de exames complementares (teste intradérmico, sorologia, cultura, exame micológico direto, anatomopatológico) para o diagnóstico de cromoblastomicose, em pacientes humanos, com graus variados de gravidade, de todas as idades, de ambos os sexos, de diferentes etnias e regiões geográficas, considerando testes de referência o anatomopatológico, a cultura ou o exame direto. Estudos em animais foram excluídos, bem como relatos ou séries de casos, revisões, guidelines e estudos com dados insuficientes para o cálculo de sensibilidade e especificidade dos métodos descritos – para a análise estatística, os estudos deviam apresentar valores verdadeiros positivos, falsos positivos, verdadeiros negativos e falsos negativos. Assim, deviam apresentar dados dos resultados dos métodos avaliados em pacientes com cromoblastomicose confirmada e também em pacientes que receberam outros diagnósticos ou que foram considerados controles saudáveis.
As bases de dados MEDLINE e LILACS foram consultadas por seis pesquisadores independentes em duplas, em janeiro de 2020, usando os MESH termos “chromoblastomycosis” e “diagnosis”, com o operador boleano AND; e a base SciELO foi utilizada pesquisando o descritor “cromoblastomicose”. Não houve restrições na data da publicação ou idioma. As plataformas utilizadas contam com efeito de explosão automática, e termos correlatos como “cromoblastomicose” e “cromoblastomicosis” também são incluídos com esse tipo de busca. Na base de dados SciELO, a adição do termo “diagnóstico” não resultou em nenhum artigo encontrado. A avaliação de títulos e resumos foi feita por dois pesquisadores independentes, e as discordâncias foram sanadas por um terceiro revisor. A leitura de textos completos para aplicação dos critérios de elegibilidade também foi feita por dois pesquisadores independentes, e, nessa fase, não houve divergência entre os revisores.
A extração dos dados foi realizada por dois revisores independentes, por meio de ficha clínica padronizada. Foram extraídos dados do estudo (testes índices avaliados, teste de referência utilizado, total de pacientes no estudo e o total de pacientes concluídos nas análises) e critérios de inclusão. Critérios metodológicos também foram registrados: teste de referência apropriado, critérios de seleção da amostra (aleatória, consecutiva ou por conveniência), seguimento dos pacientes (completo ou com exclusões inapropriadas), descrição da amostra (adequada ou incompleta), desenho do estudo (prospectivo ou retrospectivo), cegamento na realização dos testes, limiar de positividade utilizado e definição da condição alvo (cromoblastomicose) no teste de referência. Foram também extraídos os números de verdadeiros positivos, verdadeiros negativos, falsos positivos e falsos negativos, para cálculo de sensibilidade e especificidade dos testes avaliados. A avaliação da qualidade metodológica, o risco de viés e a aplicabilidade foram analisados pela ferramenta QUADAS‐2, por meio de ficha padronizada, por dois revisores independentes. Quatro domínios foram avaliados: a seleção de pacientes, a condução e interpretação do teste índice e do teste de referência, e o fluxo de pacientes (intervalo entre os testes, inclusão de toda a amostra nas análises, aplicação do mesmo teste padrão a todos os participantes).24
A análise estatística foi realizada com o pacote MADA do aplicativo R que utiliza análise bivariada com efeitos randômicos. Os estudos foram agrupados de acordo com o teste índice avaliado e o teste de referência utilizado para diagnosticar a doença nos participantes. Foram calculados a sensibilidade e a especificidade de cada método empregado, bem como o intervalo de confiança. O teste do qui quadrado foi aplicado para analisar a homogeneidade entre os valores de sensibilidade e especificidade da mesma técnica diagnóstica empregada em diferentes estudos.
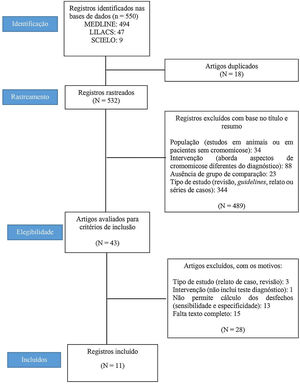
ResultadosSeleção dos estudosForam localizados 550 registros (ver fluxograma na fig. 1): 494 na base de dados MEDLINE, 47 na LILACS e nove na SciELO. Foram removidos 18 artigos duplicados, restando 532 artigos, cujos títulos e resumos foram rastreados. Nessa etapa, 489 dos 532 estudos foram excluídos. Os critérios de elegibilidade foram aplicados a 43 estudos. Onze estudos preencheram os critérios de elegibilidade e foram incluídos na revisão.12–14,25–32 A figura 1 apresenta um fluxograma do método de seleção dos estudos.
No total, os 11 trabalhos incluíram 764 pacientes, dos quais 152 com cromoblastomicose e 612 sem a doença (pacientes saudáveis ou com outras micoses, como esporotricose, paracoccidioidomicose ou micetoma).12–14,25–32 Dois trabalhos envolveram a mesma amostra de pacientes, testando diferentes métodos sorológicos em cada um deles.31,32 Os pacientes estudados eram provenientes da Índia, China, Japão, Brasil e Costa Rica. As características dos participantes estão sintetizadas na tabela 1, e as características metodológicas dos estudos estão apresentadas na tabela 2.
Características dos participantes dos estudos incluídos na revisão
| 1° autor, ano de publicação | Procedência | Tamanho da amostra (n) | Relação homem:mulher | Média de idade em anos |
|---|---|---|---|---|
| Bhat, 201625 | Índia (sul) | 25 | 16:9 | 49 (14‐74) |
| Bordoloi, 201514 | Índia (Assam) | 46 | NI | NI |
| Raj, 201526 | Índia (leste) | 20 | NI | NI |
| Miranda, 200527 | Brasil (PA) | 23 | 17:2a | 56 (34‐75)a |
| Shao, 202028 | China | 93 | NI | NI |
| Iwatsu, 197912 | Japão | 130 | 1:3b | 52 (32‐73) |
| Iwatsu, 198213 | Japão | 20 | NI | NI |
| Buckley, 196630 | Brasil e Costa Rica | 35 | NI | NI |
| Marques, 200829 | Brasil (MA) | 194 | 57:40 | 44 (17‐71) |
| Vidal, 200331 | Brasil (SP) | 178c | NI | NI |
| Vidal, 200432 | Brasil (SP) | 178c | NI | NI |
MA, Maranhão; NI, não informado; PA, Pará; SP, São Paulo.
Características dos estudos incluídos na revisão
| 1° autor, ano de publicação | Período | Desenho | Seleção consecutiva amostra | Seguimento completo dos pacientes | Teste de referência e limiar de positividade | Proporção de pacientes submetidos ao teste de referência (%) | Teste índice | Cegamento na realização do teste |
|---|---|---|---|---|---|---|---|---|
| Bhat, 201625 | 2005‐2013 | Prospetivo | Consecutiva | Sim | Histopatológico – identificação de células muriformes | 100 | Exame direto | NI |
| Cultura | ||||||||
| Bordoloi, 201514 | 2013‐2014 | Prospetivo | Consecutiva | Sim | Histopatológico e exame direto – identificação de células muriformes | 100 | Cultura | Sim |
| Raj, 201526 | 24 mesesa | Prospetivo | Consecutiva | Nãod | Histopatológico e exame direto – identificação de células muriformes | 100 | Cultura | Sim |
| Miranda, 200527 | 2000‐2004 | Prospetivo | Consecutiva | Simb | Exame direto – identificação de células muriformes | 100 | Exame direto com fita adesiva | Não |
| Histopatológico | ||||||||
| Cultura | ||||||||
| Shao, 202028 | 2010‐2018 | Retrospectivo | Consecutiva | Nãoe | Histopatológico – identificação de células muriformes | 100 | Quitinase marcada com fluoresceína | Não |
| Iwatsu, 197912 | NI | Prospetivo | NI | Sim | Cultura – crescimento de fungo demáceo | 100 | Teste intradérmico | Incerto |
| Sorologia | ||||||||
| Iwatsu, 198213 | NI | Prospetivo | NI | Sim | Cultura – crescimento de fungo demáceo | 100 | Teste intradérmico | Incerto |
| Buckley, 196630 | NI | Prospetivo | Conveniência | Sim | Cultura – crescimento de F. pedrosoi | 100 | Sorologia | Não |
| Marques, 200829 | 2002‐2003 | Prospetivo | Consecutiva | Sim | Histopatológico, exame direto e cultura – micromorfologia | 100c | Teste intradérmico | Não |
| Vidal, 200331 | NI | Prospetivo | Conveniência | Sim | Histopatológico, exame direto – células muriformes; cultura – crescimento de F. pedrosoi | 100c | Sorologia | Não |
| Vidal, 200432 | NI | Prospetivo | Conveniência | Sim | 100c | Sorologia | Não |
NI, não informado.
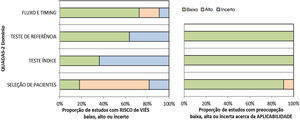
Os resultados da avaliação do risco de viés e de preocupações quanto à aplicabilidade dos estudos estão sintetizados na tabela 3. A proporção de estudos com risco de viés baixo, alto ou incerto está apresentada na figura 2.
Resultado da avaliação do risco de viés nos estudos incluídos, por meio da ferramenta QUADAS‐2
| Estudo | Risco de viés | Preocupações quanto à aplicabilidade | |||||
|---|---|---|---|---|---|---|---|
| Seleção de pacientes | Teste índice | Padrão | Fluxo e timing | Seleção de pacientes | Teste índice | Padrão | |
| Bhat, 2016 | |||||||
| Bordoloi, 2015 | |||||||
| Raj, 2015 | |||||||
| Miranda, 2005 | |||||||
| Shao, 2020 | |||||||
| Iwatsu, 1979 | |||||||
| Iwatsu, 1982 | |||||||
| Buckley, 1966 | |||||||
| Marques, 2008 | |||||||
| Vidal, 2003 | |||||||
| Vidal, 2004 | |||||||
Os artigos de Bhat et al. (2016), Bordoloi et al. (2015) e Miranda e Silva (2005) apresentaram baixo risco de viés.14,25,27 No estudo de Raj et al. (2015), houve risco de viés na seleção e no fluxo de pacientes em virtude da perda de seguimento de três participantes, os quais não foram incluídos na análise.26 O risco de viés no estudo de Shao et al. (2020) ocorreu porque a amostra utilizada para o anatomopatológico incluiu tecidos diferentes da pele e subcutâneo, como amostras de biopsia pulmonar; além disso, não há informações sobre o cegamento dos testes.28 Os trabalhos de Iwatsu et al. (1979,1982) apresentaram risco de viés incerto porque não informaram o critério de seleção da amostra, nem se houve cegamento na realização dos testes.12,13 No estudo de Buckley e Murray (1966), o risco de viés na seleção de pacientes foi alto porque a amostra foi selecionada por conveniência, e o risco de viés no teste índice foi incerto porque não há informações se o teste intradérmico foi interpretado sem o conhecimento do teste de referência (cultura).30 No estudo de Marques et al. (2008), houve seleção de controles saudáveis, sem informações sobre cegamento na realização dos testes e sem informações se todos os pacientes foram submetidos ao mesmo teste de referência (o estudo informa que foram realizados exame micológico direto, anatomopatológico e cultura, mas não há dados individuais dos pacientes).29 Nos estudos de Vidal (2003 e 2004), houve grupo de controles saudáveis na amostra e não há informações sobre cegamento na realização dos testes.31,32
Resultados individuaisOs desfechos avaliados (sensibilidade e especificidade de testes para o diagnóstico de cromoblastomicose) estão apresentados na tabela 4.
Resultados individuais dos estudos incluídos na revisão
| 1° autor, ano de publicação | Padrão | Teste índice | VP | FP | VN | FN | S | E |
|---|---|---|---|---|---|---|---|---|
| Bhat, 201625 | AP | Exame direto | 8 | 0 | 9 | 8 | 0,50 | 1,00 |
| Cultura | 6 | 0 | 9 | 10 | 0,375 | 1,00 | ||
| Bordoloi, 201514 | AP e EMD | Cultura | 5 | 0 | 40 | 1 | 0,83 | 1,00 |
| Raj, 201526 | AP e EMD | Cultura | 3 | 0 | 12 | 2 | 0,60 | 1,00 |
| Miranda, 200527 | EMD | VAT | 11 | 0 | 11 | 1 | 0,916 | 1,00 |
| AP | 6 | 0 | 6 | 0 | 1,00 | 1,00 | ||
| Cultura | 10 | 0 | 2 | 1 | 0,909 | 1,00 | ||
| Shao, 202028 | AP | FLC | 1 | 0 | 87 | 5 | 0,167 | 1,00 |
| Iwatsu, 197912 | Cultura | Intradérmico | 8 | 0 | 42 | 0 | 1,00 | 1,00 |
| Sorologia | 8 | 0 | 108 | 14 | 1,00 | 0,885 | ||
| Iwatsu, 198213 | Cultura | Intradérmico | 5 | 0 | 14 | 1 | 0,833 | 1,00 |
| Buckley, 196630 | Cultura | Sorologia | 12 | 0 | 22 | 1 | 0,923 | 1,00 |
| Marques, 200829 | Cultura, EMD e AP | Intradérmico | 18 | 1 | 173 | 2 | 0,90 | 0,994 |
| Vidal, 200331 | Cultura, EMD e AP | Sorologia IDD | 32 | 28 | 112 | 6 | 0,53 | 0,96 |
| Sorologia CIE | 41 | 19 | 106 | 12 | 0,68 | 0,905 | ||
| Sorologia ELISA | 45 | 15 | 97 | 21 | 0,78 | 0,83 | ||
| Vidal, 200432 | Cultura, EMD e AP | Sorologia IE | 34 | 26 | 118 | 0 | 0,54 | 1,00 |
| Sorologia IB 54 kDa | 58 | 2 | 118 | 0 | 0,967 | 1,00 | ||
| Sorologia IB 66 kDa | 43 | 17 | 100 | 18 | 0,717 | 0,847 |
54 kDa, fração antigênica (de Fonsecaea pedrosoi) de 54 quilodaltons; 66 kDa, fração antigênica (de Fonsecaea pedrosoi) de 66 quilodaltons; AP, anatomopatológico; CIE, contraimunoeletroforese; E, especificidade; ELISA, ensaio imunoenzimático; EMD, exame micológico direto; FLC, quitinase marcada com fluoresceína; FN, falso negativo; FP, falso positivo; IB, immunoblotting; IDD, imunodifusão dupla; IE, imunoeletroforese; S, sensibilidade; VAT, exame direto com fita adesiva; VN, verdadeiro negativo; VP, verdadeiro positivo.
Nos trabalhos incluídos nesta revisão, a sensibilidade da cultura variou de 37,5 a 90,9%, e a especificidade foi de 100%; a sensibilidade do exame micológico direto variou de 50 a 91,6%, e a especificidade foi de 100%; a sensibilidade do teste intradérmico variou de 83,3 a 100%, e a especificidade de 99,4 a 100%; a sensibilidade da sorologia variou de 36 a 99%, e a especificidade de 80 a 100%. De acordo com a técnica empregada, a sensibilidade do anatomopatológico variou de 91 a 97%, e a especificidade, de 92 a 100%.
Alguns métodos diagnósticos foram estudados somente em uma publicação: algumas técnicas de sorologia (ensaio imunoenzimático, imunoblotting, imunoeletroforese), quitinase marcada com fluoresceína e exame direto com fita adesiva, e seus resultados estão apresentados na tabela 4. Estudos que avaliaram o mesmo teste índice e o mesmo teste de referência nos pacientes foram agrupados e analisados em conjunto a seguir.
Três estudos avaliaram a cultura e o exame micológico direto como testes índices; o histopatológico foi considerado teste de referência.14,25,26 Os valores de sensibilidade e especificidade encontrados estão apresentados nas figuras 3 e 4.
Três estudos avaliaram técnicas de precipitação sorológicas como teste índice; a cultura foi considerada teste de referência.12,30,31 Em um dos estudos, os pacientes foram submetidos a duas técnicas de precipitação: imunodifusão dupla e contraimunoeletroforese.31 Os valores de sensibilidade e especificidade encontrados estão apresentados na figura 5.
Três estudos avaliaram o teste intradérmico como índice; a cultura foi considerada teste de referência.12,13,29 Os valores de sensibilidade e especificidade encontrados estão apresentados na figura 6.
Cinco estudos permitiram avaliar o histopatológico como índice, considerando o exame micológico direto o teste de referência.14,25–28 Os valores de sensibilidade e especificidade encontrados estão apresentados na figura 7.
Em virtude do pequeno número de estudos e dos valores p nos testes de homogeneidade, não é possível informar um valor estimado de sensibilidade e especificidade agrupados.
DiscussãoO número de estudos encontrado foi pequeno. Para a maioria das técnicas diagnósticas estudadas, há somente três estudos publicados avaliando sensibilidade e especificidade. Além disso, em muitos desses estudos houve alto risco de viés na seleção dos pacientes em virtude da escolha de amostra por conveniência, em vez de consecutiva ou aleatória. Os resultados de sensibilidade e especificidade encontrados em publicações que avaliaram o mesmo teste também se mostraram muito heterogêneos, ou divergentes, e não foi possível calcular uma medida de resumo (sensibilidade e especificidade agrupadas) com significância estatística.
A sensibilidade e a especificidade da sorologia para o diagnóstico de cromoblastomicose dependem da técnica empregada. As técnicas de precipitação apresentaram sensibilidade e especificidade acima de 80%, mas esses testes não estão disponíveis comercialmente, e falta padronização da técnica. Além disso, os estudos que avaliaram a acurácia diagnóstica da sorologia utilizaram controles com diagnóstico previamente conhecido (pacientes saudáveis ou com outras micoses), o que representa risco de viés de seleção.1,12,13,30–32O teste intradérmico apresenta sensibilidade e especificidade acima de 90%, mas é espécie‐específico e não está disponível para uso na prática diária.3,12,29
A cultura apresenta sensibilidade de 37,5 a 83% e especificidade de 100% nos estudos avaliados, e é empregada rotineiramente na prática clínica.14,25,26 Embora testes moleculares sejam necessários para a identificação da espécie, o estudo da micromorfologia no cultivo em lâmina pode sugerir o gênero e ter implicação no prognóstico, aumentando a importância da realização desse exame na prática clínica.1
O exame micológico direto, menos utilizado no dia a dia, apresenta sensibilidade de 50 a 100%, e especificidade de 100% nos estudos incluídos nesta revisão.14,26,27 Na pesquisa que comparou diferentes métodos de obtenção da amostra, a coleta com fita adesiva mostrou sensibilidade de 91,6% e especificidade de 100%, ao passo que a técnica convencional apresentou sensibilidade e especificidade de 100%.27
Estudos sugerem fazer a coleta de material para microscopia e cultura a partir de pontos pretos presentes na lesão.1,4 A dermatoscopia facilita a visualização desses pontos. A ausência deles em algumas formas da doença, como as cicatriciais, pode explicar a diferença de sensibilidade e especificidade desse método entre diferentes populações avaliadas, mas são necessários mais estudos para analisar essa possibilidade.15,16
O exame histopatológico foi utilizado como teste padrão em grande parte dos estudos selecionados. Nos estudos incluídos nesta revisão, a sensibilidade desse método, quando comparado ao exame micológico direto, variou de 92 a 97%, e a especificidade, de 93 a 99%.14,25–28 Esse método tem sido empregado na prática diária, pois permite diagnóstico diferencial com doenças não infecciosas, como líquen simples crônico e lúpus cutâneo, bem como com outras infecções, como tuberculose, leishmaniose tegumentar, hanseníase, histoplasmose, paracoccidioidomicose e esporotricose. Além disso, em casos crônicos, permite diagnosticar uma das complicações mais graves da doença, que é o desenvolvimento de carcinoma espinocelular.1,25,29
Na prática diária, o dermatologista utiliza anatomopatológico e cultura para fungos de material obtido por biopsia de lesão da pele para o diagnóstico de cromoblastomicose. Os resultados dessa revisão mostram que o exame micológico direto, opção amplamente disponível e de baixo custo, apresenta sensibilidade e especificidade adequadas para o emprego rotineiro diante de casos suspeitos de cromoblastomicose. O uso da sorologia deveria ser encorajado, assim como do teste intradérmico, mas eles não estão disponíveis comercialmente; a sensibilidade e a especificidade dessas técnicas variam de acordo com o agente causal, como mostraram os estudos incluídos nesta revisão. Assim, exigem o conhecimento prévio dos agentes mais prevalentes em cada região, ressaltando a importância da cultura, que identifica o gênero de acordo com a morfologia, ou das técnicas moleculares, como PCR, que determinam a espécie de fungo identificada no material examinado.
São limitações desta revisão: pequeno número de estudos, falta de informações sobre cegamento na realização dos testes índices, alguns trabalhos com amostra selecionada por conveniência ou critérios de seleção não estabelecidos. Além disso, faltam dados sobre sexo e idade dos participantes em muitos estudos, o que limita a validade externa dos resultados.
ConclusãoO exame histopatológico torna possível a identificação de células muriformes características da doença e é considerado teste de referência na maioria dos estudos sobre cromoblastomicose. O exame micológico direto, técnica de baixo custo, é teste com sensibilidade acima de 50% e especificidade acima de 90% nos estudos avaliados para o diagnóstico de cromoblastomicose, e recomendamos seu uso na rotina clínica, coletando amostra a partir de pontos pretos presentes na superfície lesão. A cultura fornece informações sobre a morfologia do agente, cujas implicações sobre o prognóstico deveriam ser avaliadas em estudos futuros. Sugerimos, também, pesquisas sobre a acurácia de testes moleculares e do teste intradérmico, em relação ao exame histológico, para o diagnóstico de cromoblastomicose, bem como novas pesquisas com exames sorológicos feitos com seleção de amostra consecutiva ou aleatória em pacientes com a suspeita da doença, a fim de avaliar a aplicabilidade desses métodos na prática diária.
Suporte financeiroNenhum.
Contribuição dos autoresJules Rimet Borges: Revisão crítica de literatura; obtenção, análise e interpretação dos dados; análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Bárbara Álvares Salum Ximenes: Revisão crítica de literatura; obtenção, análise e interpretação dos dados.
Flávia Tandaya Grandi Miranda: Obtenção, análise e interpretação dos dados; revisão crítica de literatura.
Giordana Bruna Moreira Peres: Obtenção, análise e interpretação dos dados; revisão crítica de literatura.
Isabella Toscano Hayasaki: Obtenção, análise e interpretação dos dados; revisão crítica de literatura.
luiz césar de camargo ferro: obtenção, análise e interpretação dos dados; revisão crítica de literatura.
Mayra Ianhez: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Marco Tulio Antonio Garcia‐Zapata: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Borges JR, Ximenes BAS, Miranda FTG, Peres GBM, Hayasaki IT, Ferro LCC, Ianhez M, Garcia‐Zapata MTA. Accuracy of direct examination and culture as compared to the anatomopathological examination for the diagnosis of chromoblastomycosis: a systematic review. An Bras Dermatol. 2022;97:424–34.
Trabalho realizado no Departamento de Medicina Tropical e Dermatologia, Instituto de Patologia Tropical e Saúde Pública, Universidade Federal de Goiás, Goiânia, GO, Brasil.