Ceratoses actínicas (CA) são a quarta dermatose mais diagnosticada nos consultórios dermatológicos brasileiros e o diagnóstico mais frequente em pacientes acima de 65 anos de idade.1 O risco de malignização de uma única CA é baixo; porém, múltiplas CAs em um mesmo paciente multiplicam o risco individual, o que, somado à impossibilidade de determinar qual lesão malignizará, torna primordial o tratamento e o seguimento clínico de todas as CAs.2
A presença de mais de uma CA em uma mesma área caracteriza clinicamente um campo de cancerização cutâneo (CCC) em atividade.3 Recentemente, estratégias de estabilização do CCC são estudadas, com o objetivo de prevenir a incidência de tumores cutâneos, sua recorrência ou a evolução de lesões já existentes.
O 5‐fluorouracil (5FU) é um quimioterápico tópico de excelente resposta terapêutica, com redução de até 80% da contagem de CAs e estabilização do CCC. Entretanto, os efeitos colaterais decorrentes do uso diário podem levar a má adesão e prejuízo no resultado.4 Apesar da descrição de inúmeros regimes terapêuticos, seu uso para a estabilização do CCC sob forma intermitente ainda não foi testado adequadamente.
A nicotinamida é uma vitamina do complexo B que atua no reparo do DNA, reduzindo os efeitos da imunossupressão cutânea causados pela radiação ultravioleta (RUV), modulando a produção de citocinas inflamatórias e restaurando os níveis de energia celular pós‐exposição à RUV. Ademais, a nicotinamida oral parece apresentar efeito fotoprotetor em humanos, reduzindo a contagem de CAs e a incidência de neoplasias cutâneas em pacientes de alto risco.5
Conduziu‐se um ensaio clínico aberto, randomizado, comparativo, fatorial, autocontrolado, duplo cego (para nicotinamida) no qual 36 pacientes, cujos antebraços apresentavam de três a dez CAs cada, foram randomizados em dois grupos. Um grupo recebeu nicotinamida oral 500mg a cada 12 horas durante 120 dias, e o outro grupo recebeu placebo na mesma posologia. Seus antebraços foram, subsequentemente, randomizados para receber 5FU tópico, à noite, três vezes na semana, ou filtro solar com fator de proteção solar 30 (FPS), três vezes ao dia. Em uma área padronizada dos antebraços, os pacientes foram avaliados clinicamente quanto à contagem de CAs e à Escala de Fotoenvelhecimento dos Antebraços (EFA), que avalia os antebraços quanto a aspectos do fotoenvelhecimento, como rugas, melanoses, púrpura visível, elastose e cicatrizes estelares, associados à presença de CAs.6
Além disso, os pacientes foram biopsiados na região central do antebraço, em pele sem CA clinicamente evidente, para avaliação de displasia epitelial a partir do KIN (Keratinocyte Intraepithelial Neoplasia) e imuno‐histoquímica dos marcadores p53 e Ki67, na inclusão e após 120 dias. O desfecho primário foi o clearance completo de CAs, e os secundários foram clearance parcial (> 50%) e redução da EFA, do KIN e da expressão de p53 e Ki67.
A unidade de análise deste estudo foi cada antebraço. Os resultados foram analisados por intenção de tratamento, e os dropouts foram imputados pelo modelo misto. As variáveis foram comparadas de acordo com o tempo e com os grupos pelo modelo (multinível) linear de efeitos mistos com matriz de covariância robusta. A análise post hoc foi realizada pelo procedimento sequencial de Sidak. Considerou‐se significativo p <0,05.
Os dados demográficos dos pacientes encontram‐se na tabela 1. Dos 36 pacientes analisados, houve três dropouts: um por óbito (não relacionado às intervenções do estudo), um por melhora das lesões e uma desistência por efeito adverso do 5FU.
Dados demográficos e clínicos dos participantes do estudo
| Variáveis | Valores |
|---|---|
| Idade (anos), média (DP) | 71,6 (8,6) |
| Sexo, n (%) | |
| Masculino | 14 (39) |
| Feminino | 22 (61) |
| Fototipo de Fitzpatrick, n (%) | |
| I | 13 (36) |
| II | 21 (58) |
| III | 2 (6) |
| Exposição crônica ao sol, n (%) | 34 (94) |
| Contagem de CAs, mediana (p25–p75) em cada antebraço | 6 (5–8) |
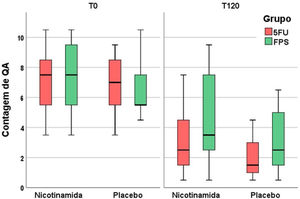
A tabela 2 apresenta os principais resultados clínicos e histopatológicos do estudo. A melhora na contagem de CA e na escala de fotoenvelhecimento foi maior com 5FU em comparação ao filtro solar, sem diferença entre os grupos quanto ao clearance total de CAs (fig. 1). Embora a nicotinamida não tenha promovido melhorias clínicas adicionais em comparação ao uso de 5FU ou filtro solar, houve redução significativa da expressão de Ki67 no grupo nicotinamida em comparação aos outros grupos. Não houve diferença entre nicotinamida e 5FU na redução da expressão de p53 ou na melhora do escore KIN. A tabela 3 apresenta os eventos adversos relatados. Apenas um participante apresentou eritema grave secundário ao 5FU, com consequente interrupção do uso.
Principais desfechos clínicos e histopatológicos
| Nicotinamida | Placebo | |||
|---|---|---|---|---|
| 5FU (n=18) | FPS (n=18) | 5FU (n=18) | FPS (n=18) | |
| T0 | ||||
| EFA | 99 (90–104) | 100 (86–103) | 99 (81–99) | 97 (81–103) |
| Contagem de CAd | 7 (5–8) | 7 (5–9) | 6,5 (5–8) | 5 (5–7) |
| p53d | 4,3 (1,2–9,5) | 10,5 (3,2–12,7) | 4,4 (2,4–5,3) | 4,8 (2,6–7,6) |
| Ki67d | 7,1 (4,0–8,1) | 7,75 (4,9–10,3) | 6,76 (4,5–8,5) | 5,9 (5,0–9,0) |
| KINe | ||||
| 0 | 0 (0,0) | 2 (11,1) | 0 (0,0) | 2 (11,1) |
| I | 9 (50,0) | 6 (33,3) | 7 (38,9) | 7 (38,9) |
| II | 9 (50,0) | 10 (55,6) | 11 (61,1) | 9 (50,0) |
| T120 | ||||
| EFAd | 90 (74–100)a,b | 94 (75–97)a | 78 (63–95)a,b | 89 (74–95)a |
| Contagem de CAd | 2 (1–4)a,b | 3,5 (2–7)a | 1,5 (1–3)a,b | 2 (1–6)a |
| p53d | 4,7 (3,8–14,4) | 4,8 (3,8–9,6) | 6,5 (4,5–9,0) | 5,4 (3,8–8,0) |
| Ki67d | 4,3 (3,5–6,7)a,c | 4,4 (3,1–7,1)a,c | 6,7 (5,1–7,6)a | 6,5 (4,5–7,5)a |
| KINe | ||||
| 0 | 7 (38,9)a | 6 (33,3)a | 6 (33,3)a | 4 (22,2)a |
| I | 9 (50,0) | 7 (38,9) | 8 (44,4) | 8 (44,4) |
| II | 2 (11,1) | 5 (27,8) | 4 (22,2) | 6 (33,3) |
| Clearance total de CAse | 4 (23,5) | 2 (11,8) | 4 (26,7) | 3 (20) |
| Clearance parcial de CAse | 15 (83,3)b | 10 (55,5) | 13 (72,2)b | 11 (61,1) |
Estudos prévios com 5FU tópico demonstraram maior redução na contagem de CAs nos grupos que utilizaram esquemas de uso diário, porém, com maior irritação e efeitos adversos em comparação ao uso intermitente. Em tempo, o 5FU foi o único tratamento de CCC que demonstrou redução na incidência de neoplasias malignas.7 O uso intermitente, duas vezes por dia, semanalmente, levou à redução de 66% na contagem de CA após 12 semanas, mostrando que pode melhorar a aderência e a tolerabilidade, promovendo menos efeitos adversos locais.8
Houve eventos adversos previsíveis e controláveis no grupo 5FU de intensidade leve ou moderada, que não causaram a descontinuação do tratamento. Apenas um paciente desenvolveu erupção generalizada após o uso local de 5FU, levando à suspensão do tratamento e destacando a significativa variabilidade individual na suscetibilidade ao 5FU, cuja toxicidade foi relatada em casos de deficiência de di‐hidropirimidina desidrogenase ou com baixos níveis de timidilato sintase.9
Estudos prévios que empregaram nicotinamida oral demonstraram redução na contagem de CA em pacientes de alto risco. Neste estudo, não foi identificada melhora clínica em comparação ao placebo, tampouco efeito aditivo ao uso de 5FU. É mister, entretanto, salientar que o uso de nicotinamida no presente estudo teve a duração de 120 dias, enquanto o maior estudo prévio usou o medicamento, em média, por cerca de 12 meses.5 Contudo, apesar da diferença no tempo de tratamento e do maior número de participantes (n=386), a redução na contagem de CA foi de apenas 13% após 12 meses de tratamento.5
Variabilidade no fototipo, dieta pobre em vitamina B3, menor taxa de metabolismo hepático e menor idade podem estar associados a diferentes respostas clínicas à nicotinamida oral. A topografia estudada (p. ex., face, membros superiores ou couro cabeludo) e diferentes graus de CA também podem justificar a variabilidade na resposta aos tratamentos do CCC.
Houve uma melhora na expressão de Ki67 para ambos os tratamentos, com diferença significativa no grupo nicotinamida. Assim, apesar de não haver resposta clínica adicional da nicotinamida aos tratamentos instituídos neste estudo, há evidências de efeito na redução da proliferação do CCC.10 Regimes mais longos de nicotinamida podem levar a resultados clínicos mais robustos.
O presente estudo apresenta algumas limitações: é monocêntrico, com acompanhamento limitado e apresenta participantes idosos de instituição pública, o que minimiza a generalização dos resultados. Além disso, uma posologia do 5FU tópico diferente do habitual foi utilizada, o que também pode dificultar a comparação dos resultados com outros estudos anteriores.
Evidenciamos a eficácia do tratamento do CCC com 5FU tópico, em regime intermitente, por 120 dias. Nossos resultados devem estimular ensaios clínicos com 5FU tópico em regime intermitente a fim de explorar seu papel na estabilização do CCC, reduzindo a incidência de CAs e neoplasias cutâneas.
Suporte financeiroNenhum.
Contribuição dos autoresEliane Roio Ferreira: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Anna Carolina Miola: Obtenção, análise e interpretação dos dados; revisão crítica da literatura; elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Thania Rios Rossi Lima: Obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Juliano Vilaverde Schmitt: Concepção e planejamento do estudo; revisão crítica da literaturar; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Luciana Patricia Fernandes Abbade: Concepção e planejamento do estudo; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Hélio Amante Miot: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; análise estatística; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ferreira ER, Miola AC, Lima TRR, Schmitt JV, Abbade LPF, Miot HA. Efficacy of intermittent topical 5‐fluorouracil 5% and oral nicotinamide in the skin field cancerization: a randomized clinical trial. An Bras Dermatol. 2021;96:784–7.
Trabalho realizado no Ambulatório de Dermatologia, Faculdade de Medicina, Universidade Estadual Paulista, São Paulo, SP, Brasil.