O vitiligo é uma enfermidade cutaneomucosa, autoimune, localizada ou disseminada, que se manifesta por máculas hipocrômicas ou acrômicas com perda na qualidade de vida dos pacientes. A prevalência do vitiligo no Brasil foi determinada em 0,54%. Não existe medicação desenvolvida para seu tratamento. Até o presente momento, não havia sido feito um consenso brasileiro sobre tratamento do vitiligo.
ObjetivoObter um consenso de tratamento clínico e cirúrgico do vitiligo, a partir de artigos com melhores evidências científicas, feito por dermatologistas brasileiros com experiência no tratamento dessa enfermidade.
MétodosForam convidados sete dermatologistas e cada especialista recebeu duas modalidades de tratamento para revisar. Cada tratamento (tópico, sistêmico e fototerapia) foi revisado por três especialistas; dois especialistas revisaram a modalidade cirúrgica. Depois disso, o coordenador integrou as versões e elaborou um texto sobre cada tipo de tratamento. A nova versão foi retornada para todos os especialistas, que expressaram suas opiniões e deram sugestões para maior clareza. O texto final foi escrito pelo coordenador e enviado a todos os participantes para elaboração do consenso final.
Resultados/conclusãoOs experts definiram como tratamento padrão do vitiligo o uso de corticosteroides e inibidores da calcineurina tópicos para casos instáveis e localizados e minipulso de corticoide para vitiligo generalizado em progressão; a fototerapia com UVB de banda estreita é o tratamento de escolha para formas extensas da doença. As modalidades cirúrgicas devem ser indicadas para vitiligo segmentar e generalizado estável. Existem medicamentos tópicos e sistêmicos da classe anti‐JAK sendo testados, com resultados promissores.
Vitiligo é uma enfermidade cutaneomucosa, desencadeada por autoimunidade contra os melanócitos, que se manifesta por máculas e manchas hipocrômicas ou acrômicas. As lesões podem ser localizadas ou disseminadas e afetam muito negativamente a qualidade de vida dos pacientes. A doença pode surgir com uma ou poucas máculas agrupadas em modo não segmentar (vitiligo focal) ou até atingir todo o tegumento (vitiligo universal).
O vitiligo é classificado em dois grupos: o não segmentar (VNS), que compreende as formas focal, mucosal, acrofacial, comum e universal; e o grupo segmentar (VS), que tem apenas o tipo clínico segmentar. Esse tipo afeta geralmente apenas um hemicorpo e tem, na maioria das vezes, resposta mais lenta ao tratamento não cirúrgico do que os que têm o tipo VNS. Na forma segmentar também está presente a autoimunidade contra os melanócitos, mas se acredita que ocorra um ataque autoimune apenas contra uma determinada área de mosaico cutâneo.1 O vitiligo também pode ser induzido quimicamente, principalmente por derivados fenólicos.2
A prevalência do vitiligo no Brasil é de 0,54% e a idade média de início da doença em pacientes brasileiros para os tipos segmentar e comum é de 13 e 22 anos, respectivamente.3,4
A influência genética no surgimento do vitiligo já foi bem determinada. Um estudo genético recente identificou carga poligênica aumentada de alelos de risco identificada por GWAS (estudos de associação genômica ampla) em pacientes de famílias com casos multiplex (com história familiar), comparado a pacientes simplex (sem história familiar).5 As lesões são causadas por linfócitos T CD8+autorreativos efetores na fase inicial e na fase estável são determinadas por linfócitos T CD8+recirculantes de memória, ambos responsáveis por destruir os melanócitos por meio da ação citotóxica das granzimas e perfurinas liberadas.6
De acordo com a definição do Vitiligo Global Consensus, a análise da estabilidade ou instabilidade do vitiligo deve incluir uma combinação de história, série de fotografias e escores clínicos, como VASI ou VETF. O vitiligo é considerado estável se não surgirem novas lesões ou ampliação de máculas antigas, fenômeno de Köebner e despigmentação perifolicular (em confete).7,8
O vitiligo é uma doença órfã de tratamentos específicos, considerando que não existe medicação desenvolvida e aprovada especificamente para seu tratamento, por exemplo, pela Food and Drug Administration (FDA). A intenção deste artigo foi determinar um consenso de tratamento clínico e cirúrgico do vitiligo feito por sete médicos dermatologistas brasileiros, a partir da revisão da literatura com as melhores evidências científicas disponíveis até o momento.
MétodosForam convidados sete dermatologistas; cada especialista recebeu duas modalidades de tratamento para revisar. Três especialistas individualmente revisaram a literatura e escreveram as diretrizes de tratamento tópico, sistêmico e fototerápico. Dois especialistas revisaram a modalidade cirúrgica. Depois disso, o coordenador integrou as diferentes versões e elaborou um texto sobre cada modalidade de tratamento. A nova versão foi retornada a todos os especialistas, que expressaram suas opiniões e deram sugestões para maior clareza. O texto final foi elaborado pelo coordenador e enviado a todos os participantes para elaboração do consenso final.
Terapias tópicasO objetivo do tratamento do vitiligo é interromper a progressão da doença, estimular a pigmentação e, por fim, manter a repigmentação, contornar, assim, o impacto psicossocial causado por essa dermatose inestética.
O tratamento tópico é a escolha para pequenas áreas ou quando não há opções disponíveis. O tratamento tópico combinado com fototerapia é indicado na falha terapêutica ou quando há mais de 5%−10% de superfície corporal acometida.9
Embora outros tratamentos clínicos e cirúrgicos estejam disponíveis, o tratamento tópico com corticoides e inibidores de calcineurina tem papel de destaque no arsenal terapêutico do vitiligo.
Corticoides tópicosOs corticoides tópicos em monoterapia são a primeira linha na terapia do vitiligo instável localizado, podem ainda ser usados em combinação com fototerapia nas lesões generalizadas. As lesões recentes e da face são as que apresentam melhor resposta.10
O mecanismo de ação dos corticoides em vitiligo ainda não foi completamente elucidado, mas em um estudo imuno‐histoquímico com mometasona em vitiligo induzido por fenômeno de Köbner houve significativa diminuição no infiltrado de linfócitos T CD4+e CD8+.11
Uma metanálise feita em 1988 concluiu que o uso de corticoides de classe III e IV resultou em mais de 75% de repigmentação ao serem comparados com placebo.12 Outros estudos demonstraram que o propionato de clobetasol a 0,05% é especialmente eficaz na face e no pescoço.13,14
Um estudo prospectivo e randomizado foi conduzido para estimar a dose segura dos corticosteroides de alta potência no vitiligo. Os autores demonstraram que o uso semanal de 50g (ou menos) de creme de propionato de clobetasol a 0,05% por 12 semanas é seguro, sem evidências de insuficiência suprarrenal, embora efeitos locais possam ocorrer.15 Para minimizar o risco de efeitos colaterais, os corticoides tópicos devem ser limitados a pequenas áreas, evita‐se o uso prolongado na face e nas flexuras.
Recomenda‐se que, após oito semanas de aplicação contínua de corticoide tópico, seja introduzida alguma outra terapêutica tópica livre (terapia rotacional).12,16 Na prática, esses esquemas parecem minimizar efeitos colaterais, embora ainda faltem estudos baseados em evidências que confirmem essa informação.9 Se nenhuma repigmentação ocorrer após três meses de aplicação, esse tratamento deve ser interrompido. Seis dos nossos pareceristas votaram pelo uso ser mais seguro quando quantificado em gramas; um foi a favor de que o produto seja usado em menos de 10% da superfície corporal.
Inibidores de calcineurinaOs inibidores de calcineurina mostraram‐se eficazes e seguros no tratamento do vitiligo tanto em crianças quanto em adultos, embora seu uso seja considerado off‐label pela Agência Nacional de Vigilância Sanitária (Anvisa). Metanálise recente que comparou o uso de inibidores da calcineurina versus corticoides tópicos de média ou alta potência mostrou que os inibidores de calcineurina não são inferiores aos corticoides tópicos para tratamento de vitiligo, principalmente em crianças.17
Tacrolimus e pimecrolimus são os principais agentes inibidores da calcineurina. O tacrolimus é um macrolídeo produto da bactéria Streptomyces tsukubaensis, que tem propriedades imunomoduladoras e ação por inibição seletiva da proteína intracelular calcineurina. Não se sabe exatamente qual é o mecanismo de ação do tacrolimus no vitiligo, mas em um estudo imuno‐histoquímico com tacrolimus 0,1% em vitiligo induzido por fenômeno de Köbner houve significativa diminuição no infiltrado de linfócitos T CD4+e CD8+.11
A eficácia dos inibidores da calcineurina no vitiligo foi verificada por séries de publicações desde 2002.18,19 Os melhores resultados são observados na face e em áreas fotoexpostas.20,21 O tacrolimus foi comparado, em termos de eficácia, ao clobetasol a 0,05%, corticoide de alta potência.22 Embora o pimecrolimus tenha cosmética mais aceitável (em creme), a grande maioria dos trabalhos é com o uso do tacrolimus.23
Em um estudo prospectivo, controlado, a pomada de tacrolimus a 0,1% usada 2×/dia por um ano levou à repigmentação das lesões de face em 81% dos pacientes, enquanto nas extremidades a repigmentação foi mínima. Sua vantagem é ser bem tolerado por crianças e adultos, pode ser usado por longo prazo sem os efeitos indesejáveis da corticoterapia, como atrofia e telangectasias.24
Os inibidores de calcineurina podem ser prescritos 2×/semana como terapia de manutenção, após a repigmentação das lesões tratadas com fototerapia.25
Há duas apresentações de tacrolimus: a 0,03% (pomada aprovada para uso em crianças entre 2 e 15 anos) e a 0,1%. Em 2013, um consenso europeu propôs que os inibidores de calcineurina aplicados 2×/dia fossem a primeira escolha para tratar lesões na cabeça e no pescoço.26
Os inibidores de calcineurina tópicos são seguros para uso contínuo, por tempo curto ou prolongado ou de maneira intermitente.16 Queimação, irritação, ardência e prurido são efeitos colaterais que tendem a ceder com o passar do tempo.
A FDA incluiu uma ressalva na caixa do medicamento americano (black‐box warning), como medida preventiva, baseada no risco teórico de linfoma e câncer cutâneo não melanoma, a partir de estudos em modelos animais e do uso de inibidor de calcineurina sistêmico.16 Uma análise de dados com mais de 20.000 ensaios clínicos verificou que até o momento não há evidências que sugiram risco aumentado de linfoma ou câncer cutâneo não melanoma em crianças ou adultos.16,27,28
Há preocupação na combinação do uso tópico dos inibidores de calcineurina com a fototerapia em relação à indução do câncer cutâneo. Entretanto, Tran et al. mostraram que tacrolimus a 0,1% e pimecrolimus a 1% podem evitar o fotodano ao DNA em camundongos, por reduzir a produção dos dímeros de timina desencadeada pela radiação UVB.29 Entre nossos autores não houve consenso sobre o tempo de manutenção do uso de tacrolimus tópico. Do mesmo modo, não houve consenso sobre área máxima corporal, por falta de dados suficientes na literatura.
Outros tópicosCalcipotriol, psedocatalase e kelina foram citados por alguns de nossos autores, mas sem consenso sobre a indicação de seu uso.
Não houve consenso entre os integrantes sobre a indicação de despigmentação com monobenzil éter de hidroquinona em vitiligo muito extenso, pelos seguintes motivos: não é um tratamento para vitiligo, mas sim para a pele normal; não é vendido ou aprovado no Brasil; potencial de não reversibilidade da cor da pele após o uso. De maneira unânime, os especialistas também desaconselharam o uso de lasers ou peeling de fenol para despigmentação definitiva, que são procedimentos controversos, pela possível irreversibilidade do quadro clínico frente ao avanço de novas substâncias que estão para serem lançadas.
Três novas medicações tópicas da classe das medicações inibidores da Janus quinase (anti‐JAK) estão em teste: o ruxolotinibe tópico em fase III e dois medicamentos sistêmicos inibidores das vias JAK3/TEC e TYK2/JAK1, que estão em fase II.
https://clinicaltrials.gov/ct2/show/NCT04057573?cond=vitiligo&draw=3&rank=18;https://clinicaltrials.gov/ct2/show/NCT04052425?cond=vitiligo&draw=3&rank=19;https://clinicaltrials.gov/ct2/show/NCT04103060?cond=vitiligo&draw=4&rank=22.
Terapias sistêmicasCorticoidesOs corticoides orais têm amplo espectro imunossupressor e têm por objetivo conter a progressão das lesões em pacientes com a doença em atividade. O objetivo primário é, portanto, interromper o surgimento de novas lesões e, secundariamente, induzir a repigmentação. O modo de ação dos corticosteroides no vitiligo ainda não foi elucidado. Um único artigo demonstrou a diminuição de ICAM1 no soro após uso de minipulso oral de corticosteroides (MPO) para vitiligo.30 Seu uso sistêmico, geralmente prescrito com minipulsos, foi avaliado em alguns estudos, a maioria deles abertos.31
A forma mais usada de corticoterapia sistêmica é a administração de minipulso oral de corticoides em doses suprafarmacológicas, geralmente de betametasona ou dexametasona, de maneira intermitente, para reduzir os efeitos colaterais associados à administração diária. As doses variam de 2,5 a 10mg de dexametasona por dois dias consecutivos/semana por 3−6 meses. A betametasona é usualmente prescrita nesse mesmo esquema posológico, nas doses entre 5 a 7,5mg. Em tese, qualquer corticoide via oral poderia ser usado, desde que se respeite a equivalência. O número de pacientes com parada da progressão do vitiligo varia pouco entre os estudos, de 88% a 91,8%. Em três estudos, o aparecimento de algum grau de repigmentação ocorreu entre 28% a 100% dos pacientes.32–34 Estudos que compararam o tratamento com MPO ao uso diário de corticoide demonstram menor incidência de efeitos adversos sistêmicos e cutâneos no primeiro.16 O esquema de MPO pode ser combinado à fototerapia nos pacientes com vitiligo progressivo, embora ainda sejam necessários estudos controlados e com acompanhamento em longo prazo.35,36
Os efeitos colaterais do uso de MPO são em geral leves (descritos em 69% dos pacientes do estudo de Radakovic‐Fijan et al.). São citados: ganho de peso, insônia, acne, aumento do apetite, agitação, hipertricose, cefaleia e letargia. Entretanto, a despeito da ocorrência frequente dos efeitos adversos, eles não costumam comprometer a adesão ao tratamento e não suprimem a produção de cortisol endógeno.32,33
Os autores chegaram a um consenso pela preconização do uso de minipulso de corticoides orais. Os mais usados são dexametasona e betametasona; o uso diário de corticoide oral não foi contraindicado pelo grupo. A razão mais citada pela não preferência do uso contínuo foi em razão do menor número de estudos em comparação com o minipulso, principalmente por não existir um padrão do tempo total de uso e esquema de redução das doses.
MetotrexatoÉ indicado para interromper a progressão do vitiligo sempre que os corticosteroides orais estiverem contraindicados ou para evitar seus riscos em longo prazo. Os estudos mostram resultados em relação à interrupção da progressão da doença. Ainda não se sabe o modo de ação do metotrexato no vitiligo.
Em estudo comparativo randomizado, o metotrexato 10mg/semana foi comparado ao minipulso de corticoide 2,5mg dexametasona/dia em dois dias consecutivos na semana, em pacientes com vitiligo em progressão (n=52 pacientes), durante 24 semanas. Em ambos os grupos houve o mesmo percentual de redução da atividade da doença e de pacientes não responsivos (6/25 pacientes no grupo do MTX e 7/25 no grupo do minipulso de dexametasona). A maioria dos trabalhos sugere doses baixas, em torno de 10−15mg/semana.37,38
Os autores não chegaram a um consenso para o uso de metotrexato e não o recomendam, principalmente por falta de dose adequada definida e pela falta de estudos com populações maiores. Alguns dos especialistas sugerem que o uso metotrexato tem algum embasamento científico e é poupador do uso de corticoides orais.
AzatioprinaUm único estudo randomizado comparou o efeito da azatioprina 50mg, 2×/dia versus minipulso de 5mg de betametasona oral em dois dias consecutivos. No segundo mês de tratamento, houve estabilização do vitiligo em 19 de 23 pacientes com MPO e 4 de 22 com azatioprina.39 Nenhum dos autores indicou o uso dessa medicação.
Antioxidantes oraisO estresse oxidativo e os radicais livres desempenham papel importante na patogênese do vitiligo.40
Uma revisão sistemática com tentativa de metanálise identificou que os trials com antioxidantes apresentaram número pequeno de pacientes e uma variedade grande de compostos e protocolos, o que dificultou a comparação entre as publicações. Desse modo, a eficácia dos antioxidantes, isoladamente, não pôde ser confirmada. As melhores evidências foram demonstradas em três estudos com ginkgo biloba como monoterapia, demonstraram benefícios clínicos ou diminuição da inflamação.40
A ação de antioxidantes associados à fototerapia foi analisada por uma revisão sistemática e metanálise, quatro estudos (psoralenos orais e tópicos [PUVA]: um estudo; radiação ultravioleta B de faixa estreita [RUVB‐FE]: três estudos) envolveram 91 pacientes que atenderam aos critérios de inclusão. Em dois estudos foram usados polypodium leucotomos e em outro, foi usado ginkgo biloba. A associação demonstrou maior eficácia do que a fototerapia isoladamente (risco relativo=1,87; 95% intervalo de confiança 1,10−3,17). Análises de sensibilidade revelaram que o resultado foi substancial e não dependente de estudo individual.41
Nosso painel de autores destacou várias evidências do uso de antioxidantes no vitiligo, principalmente associado à fototerapia, mas não houve consenso para o uso dessas medicações, principalmente pela falta de estudos prospectivos com populações maiores.
Modalidades de fototerapia e laserA exposição ao sol, associada à ingestão ou aplicação tópica de extratos vegetais, tem sido usada como agente terapêutico para o vitiligo há mais de 3.000 anos. No decorrer das décadas, a fototerapia foi consolidada por meio dos estudos científicos, da medicina baseada em evidência e do esclarecimento dos mecanismos de ação da radiação ultravioleta (RUV) sobre os seres humanos.42
A fototerapia promove a repigmentação da pele por meio de vários mecanismos, entre eles a diferenciação e migração de melanócitos do folículo piloso, a formação e transferência dos melanossomas para os queratinócitos, além do seu efeito imunossupressor.43
Os efeitos imunossupressores da RUVB‐FE já são bem caracterizados: apoptose de células T, regulação das citocinas inflamatórias (downregulation), aumento de interleucina 10 (IL10; upregulation) e depleção de células de Langerhans, com redução da apresentação de antígenos. Há, ainda, o estímulo da tirosinase com aumento da síntese de melanina.42
As formas mais usadas de fototerapia para o vitiligo incluem: RUVB‐FE, Excimer Laser (ExLs), Excimer Luz (ExLz) e UV‐A com administração de PUVA. Muitas dessas modalidades têm mostrado melhores resultados quando associadas a tratamentos sistêmicos ou tópicos.
FototerapiaQuanto à indicação da fototerapia em relação à atividade da doença, os estudos, na sua maioria, não especificam se a doença está em atividade ou não, se estável ou instável, e a fototerapia é usada em ambas as formas.
No vitiligo instável, em que as lesões estão em progressão, é recomendado combinar fototerapia com corticoterapia sistêmica, preferencialmente sob a forma de MPO, conforme descrito na parte específica de tratamento sistêmico, assim como a associação com antioxidantes orais.
Medicações tópicas podem ser usadas conjuntamente com a fototerapia, como inibidores de calcinerina (tacrolimus e pimecrolimus) e corticoides. Os resultados são variáveis. Alguns estudos sugerem que a associação desses tópicos com a fototerapia amplia sua resposta; outros estudos, porém, não confirmaram essa ação.42–46
Apesar de em bula estar contraindicado o uso de fonte de luz e tacrolimus, pelas evidências apresentadas, o grupo entrou em consenso que pode ser usado tacrolimus em concomitância com a fototerapia, exceto imediatamente antes da irradiação.
No vitiligo estável, a fototerapia atua na repigmentação e também pode ser associada aos antioxidantes orais e medicações tópicas citadas anteriormente. Alguns estudos sugerem melhor resposta com a associação.16,43,47
Quanto à forma clínica e localização das lesões, o vitiligo rapidamente progressivo, acompanhado por poliose precoce, e as formas segmentares tendem a ser pouco responsivas à fototerapia.48 Contudo, estudo recente demonstrou que pacientes com vitiligo segmentar recente respondem melhor à fototerapia do que com doença de longa duração.49 O que está bem estabelecido é que o vitiligo generalizado (ou não segmentar) responde melhor do que o vitiligo segmentar.50
As áreas pilosas, e especialmente as áreas da face e do pescoço, apresentam melhores índices de resposta à fototerapia, seguidas por tronco, extremidades, mãos e pés.51–53 Da mesma maneira, pacientes com fototipo superior a III usualmente têm melhor prognóstico com a fototerapia.
História prévia de doenças influenciadas pela luz e fotossensibilidade são contraindicações potenciais à fototerapia, assim como o uso de medicações com risco de fotossensibilização.54 Além disso, é contraindicada em pacientes com história de câncer de pele queratinocítico e melanoma.
Para o tratamento de lesões extensas generalizadas de vitiligo é indicada fototerapia com RUVB‐FE ou PUVA em cabines. No vitiligo localizado, recomenda‐se o uso de emissores de RUVB‐FE ou de UVA locais, direcionados apenas para as lesões. Do mesmo modo, o ExLs e o ExLz são recomendados para esse tipo de lesão localizada.55,56
Em crianças, é preciso garantir que haja indicação correta para essa modalidade terapêutica. O nível de evidência para uso de RUVB‐FE em crianças é 4, mas não existe consenso sobre a idade de início de RUVB‐FE tópico ou em cabine. PUVA tópico pode ser aplicado em crianças; para uso de PUVA oral, o British Photodermatology Group atribuiu dois critérios: um, dito maior, de só usar com idade superior a 10 anos, e outro critério, menor, com o uso de PUVA acima de 16 anos.57–59
Em relação à gravidez, não existem evidências da diminuição do ácido fólico sérico após exposição à UVA. Estudos em pacientes submetidos à NBUVB mostraram resultados diversos, potencialmente explicados pela degradação dose‐dependente do folato; exposição acumulada de>40J/cm2 e>2J/cm2 por sessão de tratamento foi associada com diminuição de 19%−27% nos níveis séricos de ácido fólico, enquanto doses mais baixas não afetaram esses níveis.60 Não há evidências de que o PUVA seja teratogênico, mas deve ser considerado como segunda opção em fototerapia, pela necessidade do uso do psoralêno.59 Houve consenso no grupo de que grávidas podem ser submetidas a tratamento com RUVB‐FE.61
Quanto à modalidade de radiação, o papel da fototerapia no tratamento do vitiligo foi bem estabelecido nas últimas décadas e, a partir dos anos 1990 os estudos evidenciaram vantagens da fototerapia com RUVB‐FE em relação à fototerapia PUVA.62,63 Alguns estudos não demonstraram superioridade clínica, porém encontraram respostas similares e vantagens operacionais.64 Diversos estudos evidenciaram maior eficácia da RUVB‐FE comparado ao PUVA; além da sua facilidade de uso, a não necessidade de psoralênico fez a fototerapia com RUVB‐FE ser a primeira escolha para o tratamento do vitiligo.52 Os protocolos de fototerapia RUVB‐FE não serão detalhados aqui e deverão ser tema para outro consenso específico.
Excimer laserExLs é caracterizado por um comprimento de onda de 308nm (gerado com gases xenônio e cloro). Vários estudos demonstram sua aplicabilidade para tratamento de vitiligo – considerado com resultado similar ao RUVB‐FE e, em alguns estudos, até superior, com resposta mais rápida.65,66 Por sua menor área de emissão, o ExLs torna possível atingir áreas menores e em regiões mais difíceis de alcançar com os emissores padrão. Contudo, essa forma de tratamento é inadequada para pacientes com áreas acometidas mais extensas ou em múltiplas regiões. Além do mais, o custo é maior do que o de outros dispositivos de fototerapia.
Excimer luzA luz excimer monocromática, lâmpada excimer (ExLz), também emite luz com comprimento de onda de 308nm, com bons resultados na indução de repigmentação. Essas lâmpadas têm um campo de tratamento maior em comparação com o ExLs e é possível tratar áreas maiores em tempo mais curto. Além disso, seu custo é bem menor do que os dispositivos a laser.67
Vários estudos compararam a eficácia terapêutica do ExLs, da ExLz e da RUVB‐FE em vitiligo.68–70 Metanálises recentes demostraram que o tratamento de tipo excimer tem maior eficácia em comparação com RUVB‐FE, com efeito mais rápido e maior grau de repigmentação.71,72 Porém, outros autores questionam essa maior eficácia.72
Quanto à fotocarcinogênese, o risco de desenvolvimento de neoplasias cutâneas em portadores de vitiligo nas áreas afetadas é raro, independentemente do tipo de fototerapia.73
Tratamento com PUVA em vitiligo parece não estar associado ao risco de câncer de pele não melanoma.74,75 De outro modo, não existem estudos consolidados do risco da fotocarcinogênese em fototerapia UVB‐F para vitiligo.73
Não existem evidências concretas de que RUVB‐FE apresente maior risco de malignização nas áreas genitais; no entanto, recomenda‐se que não seja feita exposição.76
Os tratamentos com ExLs ou ExLz mostraram bons resultados em lesões de área genital, especialmente em homens.53 Porém, o grupo entrou em consenso que a área genital não deve ser exposta à fototerapia, pelo risco já reportado de carcinomas epidermoides em pacientes submetidos à fototerapia sem proteção adequada.77
Quanto ao número de sessões terapêuticas, um estudo recente identificou padrões de resposta ao tratamento com RUVB‐ FE. A média de melhoria global após 24 sessões foi de 21,5% (579 pacientes). Os pacientes foram divididos em padrão de tempo de resposta: após 96 sessões, respondedores muito rápidos adquiriram 88% de repigmentação; os rápidos, 74,8%; os respondedores médios tiveram 58,4% de resposta; os lentos, 38,8%; e os não respondedores, 35,2%.
O número máximo de sessões recomendadas para tratamento com PUVA é de 200, mas até hoje não existe um consenso mundial sobre o número máximo para RUVB‐FE.59,73 Do mesmo modo, os autores deste artigo também não chegaram a um consenso sobre o máximo de sessões de RUVB‐FE para vitiligo.
Para avaliar a eficácia da fototerapia é necessário um período de pelo menos seis meses (em torno de 48 sessões) de tratamento.52 Para se obter a máxima resposta do vitiligo com fototerapia, recomenda‐se um tempo de tratamento longo, pelo menos um ano (média de 96 sessões).52
Em um ano (aproximadamente 96 sessões) de fototerapia, observa‐se melhor resposta em face e pescoço, seguido do tronco; já as extremidades (mãos e pés) apresentam pouca repigmentação das lesões.52
A fototerapia é um excelente instrumento terapêutico para o tratamento do vitiligo, respeitados as indicações corretas, o acompanhamento periódico, os protocolos e a individualização do manejo.
Tratamentos cirúrgicosO tratamento cirúrgico do vitiligo é indicado para casos estáveis e que sejam refratários a tratamentos clínicos prévios.78,79 Apesar de existir uma tendência de melhor resposta nos casos de vitiligo segmentar, qualquer tipo clínico estável da doença pode ser tratado, apesar de áreas específicas como lábios, glande e falanges distais terem uma resposta muito menor a esses tratamentos.80,81 Se o paciente apresentar mais de 10% de superfície corporal comprometida, mesmo que estável, e evolução tardia, não se recomenda cirurgia, a menos que tenha acesso a cultura de melanócitos. No entanto, em casos localizados específicos com mais de 10% de área afetada, podem ser usadas técnicas cirúrgicas em mais de uma etapa. Casos de vitiligo segmentar de longa duração (mais de 12 meses) costumam ter pior resposta aos tratamentos clínicos.49 Assim, nesses casos, o tratamento cirúrgico pode ser empregado como primeira opção terapêutica.9
A estabilidade do vitiligo é definida como ausência de novas lesões ou aumento de lesões antigas e os indicadores de instabilidade da doença são: fenômeno de Köbner, máculas tricrômicas e despigmentação em confete.82 Apesar de não haver parâmetros definitivos sobre o tempo de estabilidade de doença necessário antes de uma abordagem cirúrgica, é consenso entre a maioria dos autores que o tempo médio de estabilidade seja de 12 meses.83,84
A estabilidade pode ser confirmada pelo paciente por comparação fotográfica ou sistemas validados como Vitiligo Area Scoring Index (VASI), Vitiligo EuropeanTask Force Assessment (VETF) e Vitiligo Disease Activity (VIDA).9 Em casos de dificuldade de definição, o teste da minienxertia deve ser feito.78,85,86
Os pacientes devem ser avaliados em relação a história de queloide, coagulopatias, infecções ou outras contraindicações para a cirurgia.87 Além disso, precisam estar cientes sobre a necessidade de curativo oclusivo na área tratada por um período que varia de 7 a 14 dias. O curativo tem como funções acelerar a cicatrização das áreas dermoabrasadas, prevenir a contaminação bacteriana e manter os tecidos ou as células transplantadas na área receptora.88
A escolha da modalidade cirúrgica depende de alguns parâmetros, como o tamanho da lesão, a área anatômica a ser tratada, além da experiência do profissional.78 As técnicas de suspensão celular, apesar de simplificadas nas últimas décadas, demandam maior curva de aprendizado em razão da obtenção delicada do tecido da área receptora, do manejo laboratorial do tecido e do preparo da área receptora.89
As modalidades cirúrgicas podem ser classificadas em técnicas teciduais e celulares, de acordo com o tipo de enxerto a ser transplantado. Entre as modalidades de transplante de melanócitos denominadas de teciduais, destacam‐se a minienxertia, o enxerto epidérmico por bolhas de sucção, os enxertos de pele parcial e a curetagem epidérmica. Já as modalidades celulares são compostas pela suspensão de queratinócitos‐melanócitos (SQM), suspensão de células epidérmicas da bainha externa folicular e suspensão de células cultivadas.79,90
A resposta terapêutica às técnicas anteriormente citadas é de boa a excelente (50%−100% de repigmentação) em mais de 65% dos pacientes tratados com um único procedimento, varia de acordo com a técnica usada, a área anatômica tratada (áreas faciais com melhores resposta em contraste com as acrais), o tempo de estabilidade e o tipo de vitiligo (o segmentar responde melhor do que o focal, que por sua vez responde melhor do que o generalizado).87,91–99 Além disso, as modalidades celulares têm a vantagem de usar uma proporção entre área doadora e área receptora de 1:10, enquanto as técnicas teciduais normalmente trabalham com a proporção de até 1:1.9,79
Modalidades teciduais de transplante, como a minienxertia, apresentam a vantagem de ter sua execução facilitada, sem a necessidade de equipamentos laboratoriais e também em curto tempo, desde que a área a ser tratada seja pequena. Modificações da técnica que usa equipamento de punch motorizado têm viabilizado a aplicação da técnica em áreas maiores.98,100 Já as modalidades celulares de transplante celular, como a SQM, têm a vantagem de tratar áreas maiores com uma área doadora reduzida, com menor incidência de efeitos colaterais do que os vistos nas técnicas teciduais, o que as torna uma das técnicas padrão‐ouro para o tratamento cirúrgico do vitiligo atualmente.9,79,91
Já as técnicas que envolvem o cultivo de melanócitos, apesar de sua alta eficácia, necessitam de estrutura laboratorial complexa, equipe especializada e apresentam, portanto, custo elevado.79 Apesar de não haver relatos de desfechos de neoplasias malignas pós‐transplante, existem questionamentos teóricos sobre o comportamento em longo prazo dos melanócitos cultivados, deve tal técnica ser reservada num primeiro momento a estudos experimentais, mediante a aprovação do conselho de ética local, até que estudos com longos períodos de seguimento sejam feitos.101
Antes dos procedimentos, recomenda‐se a obtenção de termo de consentimento para todos os pacientes, uma vez que as técnicas cirúrgicas podem culminar em efeitos indesejados, como fenômeno de Köbner, cicatrizes inestéticas (tanto em área receptora como em área doadora), infecções e reações alérgicas.78,93 Especialmente no caso da minienxertia, o efeito em pedra de calçamento na área receptora pode ocorrer em 18% a 33% dos pacientes tratados (menor incidência quando usados enxertos de menor diâmetro), além de aspecto de repigmentação heterogênea em 24%−43%.98,99 O paciente também deve ser informado sobre a possiblidade de recidiva da doença sobre a área tratada. Um estudo de seguimento de longo prazo de pacientes tratados com técnica de suspensão de células epidérmicas não cultivadas demonstrou que o acometimento das extremidades digitais nos pacientes tratados em outras regiões e vitiligo não segmentar são fatores de risco independentes de recidiva.102
Para que o paciente tenha uma expectativa real, deve ser bem informado de que a repigmentação e homogeneização da cor demoram de dois meses ou até mais de um ano para ocorrer e que a cirurgia é um tratamento e não a cura, pois sempre existe a possibilidade de recidiva da doença.80
Há evidências de que a associação das técnicas cirúrgicas de transplante com a fototerapia adjuvante forneça melhores taxas de repigmentação, pode ser ainda aprimorada quando a fototerapia é iniciada antes do tratamento cirúrgico e continuada pós‐transplante de melanócitos.103,104
Outras técnicas indutoras de repigmentaçãoO número de estudos (ensaios e relatos de caso) que envolvem técnicas indutoras da repigmentação (TIR) sem transplante de melanócitos é crescente e não há até o momento estudos comparativos diretos entre as duas modalidades.
Entre as TIR, destaca‐se o microagulhamento. Os estudos já publicados apresentam uma taxa altamente variável de resposta (0−100%), muitos deles apontam menor resposta ou mesmo falha da resposta em áreas acrais, o que pode ser explicado pela carência de reservatório folicular de melanócitos nessas áreas anatômicas.105–117
Apesar do exposto, a técnica ainda é considerada incipiente, ainda que promissora, assim como o uso de substâncias para drug‐delivery; é prudente o aguardo de estudos com maior número de pacientes antes de sua ampla indicação. Além disso, é importante ressaltar que, embora a modalidade não envolva transplante de melanócitos, os mesmos critérios de indicação já explicitados nas outras modalidades de tratamento cirúrgico do vitiligo precisam ser respeitados, a fim de evitar possíveis efeitos adversos do procedimento.
Tratamento em crianças, gestantes, lactantes e idososFototerapiaNa faixa etária pediátrica e em gestantes, a fototerapia com UVB de banda estreita é preferível à PUVA‐terapia em virtude da maior efetividade, menor incidência de efeitos colaterais (não necessidade de medicação fotossensibilizante – categoria C de risco na gestação) e menor possibilidade de carcinogênese.118 A decisão de iniciar a fototerapia em crianças é baseada na pouca ou falta de resposta aos tratamentos tópicos, progressão rápida da doença e a possibilidade de o paciente aceitar e colaborar com o tratamento. Isso geralmente ocorre em torno de 7 a 10 anos. Na medida do possível, devem ser tentados dispositivos de irradiação localizada para evitar dano extenso e tardio.119
Até o momento, os estudos com RUVB‐FE não demonstraram aumento da carcinogênese em crianças com vitiligo, sugerem que seu uso possa ser seguro a partir da faixa escolar.120–125 A respeito de vitiligo e carcinogênese, a maioria dos estudos mostram relação inversa entre a doença e o câncer de pele, provavelmente por mecanismo genético e imunológico protetores.126 Entretanto, devido à ausência de estudos prospectivos de longo prazo para certificar a real segurança da fototerapia em crianças, sugere‐se que haja seguimento dermatológico de longo prazo nos pacientes tratados e restrição da fototerapia à área de tratamento, evitam‐se áreas genitais.121,126
Recomenda‐se também que os pacientes em tratamento ou já tratados reduzam ao máximo a exposição ambiental ao UV e façam regularmente exame de todo o tegumento.121
Assim como em adultos, é possível indicar a associação de fototerapia com o uso tópico de inibidores da calcineurina.127 Entretanto, deve ser levado em consideração o possível potencial cancerígeno dessa associação. Embora as análises de dados clínicos não tenham comprovado essa possibilidade, o uso combinado deve ser avaliado com cautela em crianças.
Não foram identificados estudos específicos em idosos.
Corticoides oraisEm crianças, os efeitos colaterais mais comuns do uso da corticoterapia oral são vômitos, alterações comportamentais e distúrbios do sono.128 O uso de corticoides orais também está vinculado ao aumento de incidência de fraturas tanto na faixa etária pediátrica quanto em pacientes idosos.129,130 Portanto, seu uso deve ser parcimonioso e evitado em indivíduos com risco para fraturas moderado a alto.
Apenas um trial com uso de minipulso de predinisolona oral foi encontrado em crianças, estudo prospectivo e intervencional em 400 participantes (crianças de 18 meses a 15 anos), com uso de dois dias consecutivos de metilprednisolona por seis meses toda semana. Além disso, os pacientes usavam fluticasona creme uma vez ao dia nas lesões. Houve uma resposta considerada boa a excelente em 65,5% dos 343 pacientes que completaram o estudo. Houve correlação inversa entre tempo de doença e resposta ao tratamento.131
Apesar de conflitantes, alguns estudos em gestantes que usaram corticoterapia oral apontam para o aumento da incidência de fendas labiais, partos prematuros, pré‐eclâmpsia e baixo peso ao nascer; é considerada medicação de categoria C de risco.132 Portanto, na população de gestantes, seu uso deve ser evitado.
No único estudo retrospectivo que detalhou o tratamento de vitiligo com início tardio, acima de 50 anos, entre os 359 tratados, 15,6% haviam sido tratados com corticosteroides orais.133 Esse estudo não pode ser extrapolado para idosos porque muitos pacientes tratados não se encaixavam nessa faixa etária.
Tratamento tópicoA escolha da medicação tópica em crianças deve levar em conta a área anatômica da aplicação e a extensão da doença, deve ser evitada em grandes extensões em função da possibilidade de efeitos colaterais sistêmicos.134,135 Na face, no pescoço e nas áreas intertriginosas, o uso tópico dos inibidores da calcineurina deve ser preferido (2×ao dia), em razão de sua eficácia e do melhor perfil de segurança.134,136
De acordo com a indicação de bula, no Brasil, os inibidores tópicos da calcineurina estão indicados para crianças maiores de 2 anos. Entretanto, essas medicações (tacrolimus 0,03% e pimecrolimus 1%) já foram estudadas na faixa de 6 a 24 meses em pacientes com vitiligo, demonstraram eficácia e tolerabilidade.137
Os corticoides tópicos de média e alta potência são a terapia de primeira linha para vitiligo infantil do corpo, exceto locais intertriginosos e genitais. As crianças, em particular com fototipo alto e lesões na face, respondem melhor do que os mais velhos com fototipo baixo. Eles são geralmente prescritos em regime intermitente, com pausas a cada duas ou três semanas, por tempo máximo de seis meses.138 Um estudo retrospectivo que incluiu 101 crianças com vitiligo tratadas com corticoides de potência moderada a alta relatou repigmentação de lesões em 64% delas.
Em virtude dos seus já conhecidos efeitos colaterais adversos locais e sistêmicos, na região corporal (extrafacial, extracervical e extraintertriginosa) recomenda‐se uso de corticoides de baixa e moderada potência, ou, ainda, corticoides de alta potência (Classe III) mais recentes, como o furoato de mometasona e aceponato de metilprednisolona, que têm eficácia similar e efeitos colaterais menos comuns do que o propionato de clobetasol, por exemplo.134
A absorção sistêmica é possível, especialmente em crianças menores com potencial para supressão do eixo hipotálamo‐hipófise‐suprarrenal e consequente síndrome de Cushing iatrogênica.139 Os corticosteroides tópicos de alta potência produzem melhores resultados em pacientes pediátricos com lesões na cabeça e pescoço, mas não são necessariamente melhores do que o tacrolimus.140 Planos de tratamento que intercalam períodos de uso com períodos de pausa (p.ex., uma semana de uso e uma semana de pausa, ou, ainda, 15 dias de tratamento por mês por seis meses), com acompanhamento clínico mensal para checagem de efeitos colaterais locais, podem ser aplicados. Apesar de, na prática, estes regimes de tratamento diminuírem os efeitos colaterais, não existem estudos comparativos em termos de sua eficácia.134,135
Corticoides tópicos de alta e muito alta potência durante a gravidez foram relacionados com maior incidência de recém‐nascidos com baixo peso, principalmente na dose acumulada de 300g ou mais.141 Portanto, o uso parcimonioso (tempo e área de tratamento reduzidos) de corticoides tópicos de potência leve a moderada seria mais indicado nessa população, assim como também em lactantes.142
Não existem estudos específicos sobre a segurança do uso de inibidores tópicos da calcineurina em gestantes e lactantes (categoria C). Entretanto, tacrolimus VO e mesmo ciclosporina VO já foram estudados em gestantes transplantadas de órgãos sólidos, sem demonstrar risco aumentado para malformações congênitas. O risco de prematuridade aumentado nesses estudos foi relacionado possivelmente à doença de base materna.143,144
Estudos sobre a farmacocinética do tacrolimus tópico em pacientes com dermatite atópica (com maior permeabilidade na barreira cutânea que pacientes com vitiligo) demonstraram mínima absorção sistêmica da medicação tópica.145,146 Pelo exposto, o uso off‐label da referida medicação pode ser aventado em pacientes com vitiligo gestantes ou lactantes, mas como segunda linha de tratamento.
Estudos retrospectivos, que incluíram um feito em população brasileira, apontam para uma tendência à estabilidade do vitiligo durante a gestação na maioria dos pacientes avaliados.147,148
Em estudo retrospectivo que envolveu 359 pacientes com início tardio da doença (> 50 anos), apenas 30,5% dos pacientes tratados com monoterapia tópica (corticoides ou inibidores da calcineurina) obtiveram bons resultados de repigmentação (repigmentação > 50%), enquanto a maioria (55,4%) dos que trataram com fototerapia associada à medicação tópica obteve bons a excelentes resultados terapêuticos.149 Assim, nosso consenso recomenda essa última terapia combinada como forma de tratamento para idosos.
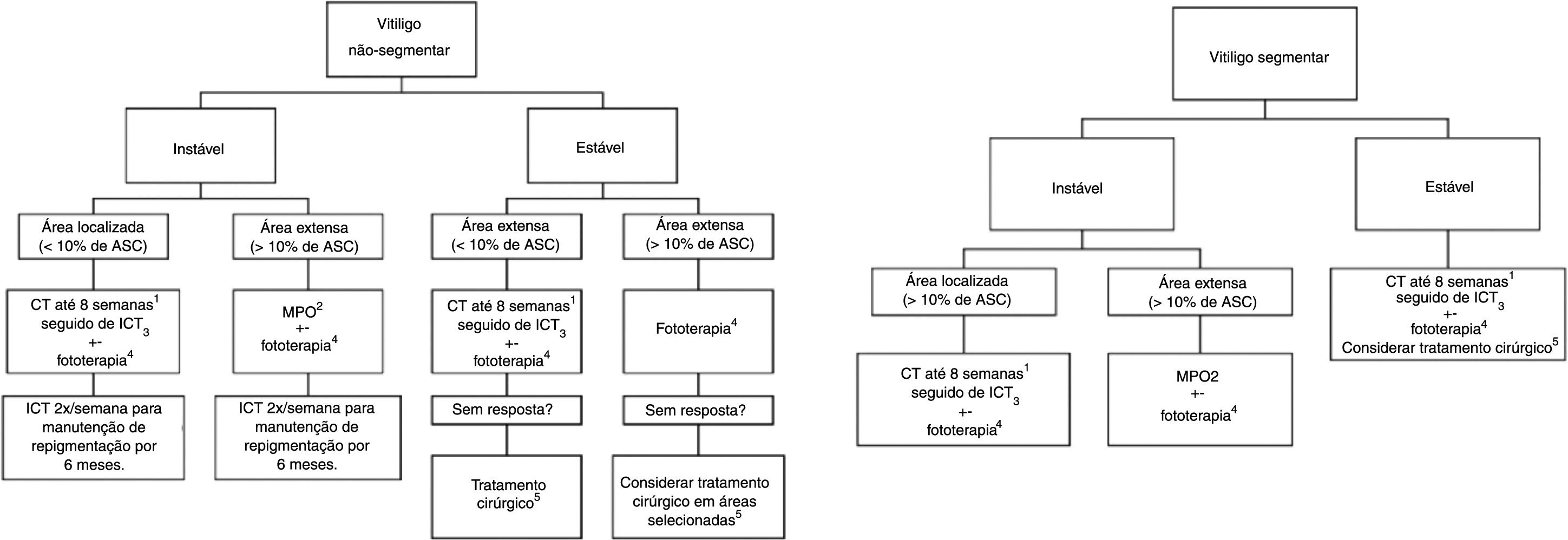
Discussão e conclusãoOs experts consultados definiram como tratamento‐padrão do vitiligo o uso de corticosteroides e inibidores da calcineurina para casos instáveis e localizados e a preferência por minipulso de corticoide em vitiligo generalizado instável. O tratamento de escolha para a repigmentação é a fototerapia com UVB de banda estreita, associada ou não à MPO e/ou antioxidantes orais em casos graves e instáveis. As modalidades cirúrgicas são consideradas principalmente nos vitiligos segmentar e generalizado estáveis, principalmente associadas à exposição à fototerapia antes e depois do tratamento cirúrgico. Ainda não dispomos de medicamentos tópicos ou sistêmicos específicos para vitiligo, mas os principais medicamentos em desenvolvimento são da classe anti‐JAK, tópico e sistêmicos, que estão entre fase I e III e são previstos testes com imunobiológicos antirreceptor da IL‐15. Um fluxograma de tratamento está na figura 1.
Fluxograma de tratamento.
ASC, área de superfície corporal; CT, corticoide tópico; ICT, inibidor de calcineurina tópico (Tactolimus ou Pimecrolimus); MPO, Minipulso de corticoide oral;+‐, associado ou não à.
1 Com acompanhemento clínico para avaliação dos efeitos colaterais locais, especialmente se área genital, facial ou dobras e face. O uso de corticoides de alta e muito alta potência deve ser restrito às demais áreas corporais. Ainda, em áreas sensíveis, o uso de ICT pode ser priorizado para minimizar os efeitos colaterais dos corticoides tópicos.
2 Em crianças e idosos avaliar o risco‐benefício do uso da corticoterapia oral, devido principalmente à relação do seu uso com déficit de crescimento e aumento de risco de fraturas, além de comorbidades que podem ser desencadeadas ou agravadas pelo uso da medicação.
3 Tracolimus (ou Pimecrolimus) 2x ao dia.
4 Preferencialemente RUVB‐FE, Excimer laser ou Excimer luz. Devido aos respondedores lentos, sugere‐se tratamento de no mínimo seis meses (2 a 3 sessões semanais). Em casos localizados, dar preferência a tratamento fototerápico que permita a irradiação restrita à área lesional. A associação com antioxidantes orais, ICT e TC durante o tratamento pode ser considerada. Foi consenso entre os pareceristas que a área genital não deve ser irradiada.
5 Se ausência de fenômeno de Köbner.
Nenhum.
Contribuição dos autoresGerson Dellatorre: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Daniela Alves Pereira Antelo: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Roberta Buense Bedrikow: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Tania Ferreira Cestari: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Ivonise Follador: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Daniel Gontijo Ramos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Caio Cesar Silva de Castro: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Dellatorre G, Antelo DAP, Bedrikow RB, Cestari TF, Follador I, Ramos DG, et al. Brazilian consensus on the treatment of vitiligo – Brazilian Society of Dermatology. An Bras Dermatol. 2020;95:70–82.
Trabalho realizado na Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.