A hanseníase está entre as doenças negligenciadas no mundo, e o Brasil é o segundo país com mais casos. Foi realizado estudo retrospectivo a partir dos prontuários de 196 pacientes com hanseníase diagnosticados em 13 anos em um hospital universitário. O objetivo foi descrever os efeitos adversos mais frequentes da poliquimioterapia e as populações mais vulneráveis a eles. No estudo, a dapsona foi a substância mais implicada, principalmente em mulheres, e o risco aumentou com a idade. Concluímos que nesse perfil de pacientes deve‐se ter maior vigilância quanto aos possíveis efeitos adversos, sobretudo a anemia.
A poliquimioterapia (PQT), recomendada pela Organização Mundial de Saúde, mudou drasticamente a história natural da hanseníase, reduzindo a prevalência e o desenvolvimento de resistência antimicrobiana.1 Uma coorte de 371 pacientes com hanseníase, acompanhados por 13 anos, identificou o perfil sociodemográfico e os efeitos adversos (EA) mais frequentes da PQT.
MétodosEstudo retrospectivo, compreendendo o período de 2002 a 2014, com 371 pacientes com hanseníase, avaliou o perfil sociodemográfico e os EA da PQT padrão. Foram excluídos os pacientes paucibacilares (PB) e multibacilares (MB) que realizaram menos de quatro e nove doses supervisionadas, respectivamente, permanecendo no estudo 196 pacientes.
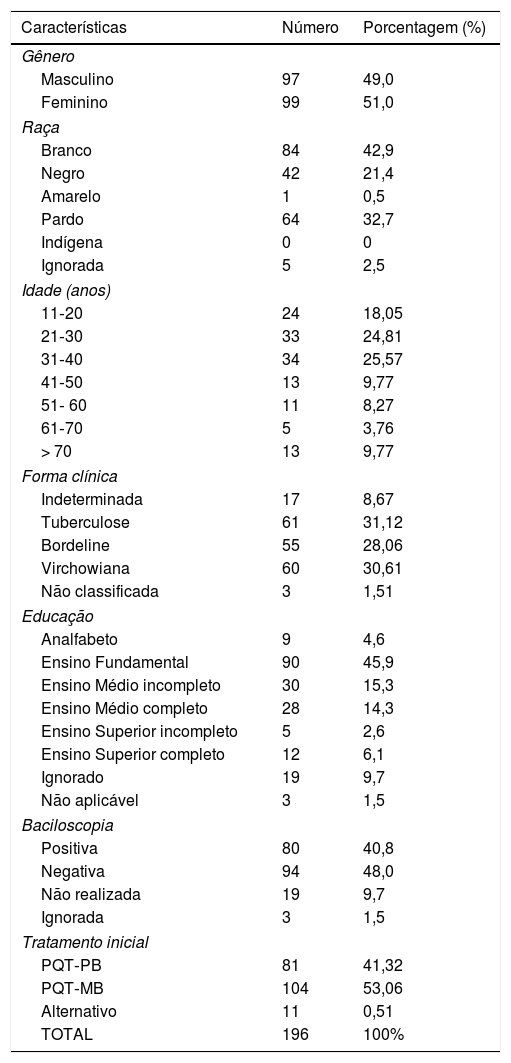
ResultadosDos 196 pacientes, 97 eram homens, e 99 mulheres; 41,32% foram tratados com PQT‐PB, 53,05% com PQT‐MB e 5,61% com esquema alternativo (tabela 1). Foram relatados 61 EA em 56 pacientes, dos quais 64,28% (36) eram mulheres. Três pacientes tinham menos de 15 anos de idade; 12, mais de 70 anos; e 73,21% (41), entre 16 e 69 anos. Anemia hemolítica foi o EA mais frequente (73,20%), forma aguda (30,35%) e crônica (42,85%), dos quais 83,3% ocorreram em mulheres, principalmente com 45 anos ou mais (63,3%). A chance de um paciente com anemia ser do sexo feminino foi 2,14 vezes maior (OR = 2,14; 95% IC 1,14‐4,12). Síndrome sulfônica ocorreu em dois pacientes; metemoglobinemia, em um (tabela 2). Alterações gastrintestinais como anorexia, náuseas, vômitos, diarreia ou epigastralgia foram observadas em praticamente 20% dos pacientes, na maioria das vezes (72,2%) em decorrência de dapsona (DDS, diaminodifenil sulfona). Fotossensibilidade ocorreu em dois pacientes. A chance de um indivíduo ter EA aumentou com cada ano de idade (OR = 1,02; 95% IC 1,00‐1,04). Apesar disso, não houve associação entre o tipo de EA e a idade.
Características dos 196 pacientes em tratamento de hanseníase acompanhados no hospital
| Características | Número | Porcentagem (%) |
|---|---|---|
| Gênero | ||
| Masculino | 97 | 49,0 |
| Feminino | 99 | 51,0 |
| Raça | ||
| Branco | 84 | 42,9 |
| Negro | 42 | 21,4 |
| Amarelo | 1 | 0,5 |
| Pardo | 64 | 32,7 |
| Indígena | 0 | 0 |
| Ignorada | 5 | 2,5 |
| Idade (anos) | ||
| 11‐20 | 24 | 18,05 |
| 21‐30 | 33 | 24,81 |
| 31‐40 | 34 | 25,57 |
| 41‐50 | 13 | 9,77 |
| 51‐ 60 | 11 | 8,27 |
| 61‐70 | 5 | 3,76 |
| > 70 | 13 | 9,77 |
| Forma clínica | ||
| Indeterminada | 17 | 8,67 |
| Tuberculose | 61 | 31,12 |
| Bordeline | 55 | 28,06 |
| Virchowiana | 60 | 30,61 |
| Não classificada | 3 | 1,51 |
| Educação | ||
| Analfabeto | 9 | 4,6 |
| Ensino Fundamental | 90 | 45,9 |
| Ensino Médio incompleto | 30 | 15,3 |
| Ensino Médio completo | 28 | 14,3 |
| Ensino Superior incompleto | 5 | 2,6 |
| Ensino Superior completo | 12 | 6,1 |
| Ignorado | 19 | 9,7 |
| Não aplicável | 3 | 1,5 |
| Baciloscopia | ||
| Positiva | 80 | 40,8 |
| Negativa | 94 | 48,0 |
| Não realizada | 19 | 9,7 |
| Ignorada | 3 | 1,5 |
| Tratamento inicial | ||
| PQT‐PB | 81 | 41,32 |
| PQT‐MB | 104 | 53,06 |
| Alternativo | 11 | 0,51 |
| TOTAL | 196 | 100% |
PQT‐MB, poliquimioterapia multibacilar; PQT‐PB, poliquimioterapia paucibacilar.
Características dos 56 pacientes que apresentaram efeitos adversos
| Características | Número | (%) |
|---|---|---|
| Gênero | ||
| Masculino | 20 | 35,71 |
| Feminino | 36 | 64,29 |
| Raça | ||
| Branco | 27 | 48,21 |
| Negro | 8 | 14,29 |
| Amarelo | 1 | 1,79 |
| Pardo | 18 | 32,14 |
| Indígena | 0 | 0 |
| Ignorado | 2 | 3,57 |
| Idade | ||
| 00‐15 | 3 | 5,36 |
| 16‐45 | 22 | 39,28 |
| 46‐69 | 19 | 33,93 |
| ≥ 70 | 12 | 21,43 |
| Forma clínica | ||
| Indeterminado | 6 | 10,71 |
| Tuberculose | 15 | 26,79 |
| Borderline | 21 | 37,50 |
| Virchowiano | 13 | 23,21 |
| Não classificado | 1 | 1,79 |
| Escolaridade | ||
| Analfabeto | 1 | 1,79 |
| Até 4ª série | 12 | 21,43 |
| 4ª série completa | 3 | 5,36 |
| 5ª a 8ª incompleta | 5 | 8,93 |
| 8ª completa (1° grau) | 1 | 1,79 |
| 1° a 3° ano incompleto | 10 | 17,85 |
| 1° a 3° ano completo (2° grau) | 10 | 17,85 |
| Ensino Superior incompleto | 1 | 1,79 |
| Ensino Superior completo | 6 | 10,71 |
| Ignorado | 5 | 8,93 |
| Não se aplica | 2 | 3,57 |
| Baciloscopia | ||
| Positiva | 20 | 35,71 |
| Negativa | 30 | 53,58 |
| Não realizada | 6 | 10,71 |
| Dose do efeito adverso | ||
| Primeira | 19 | 33,93 |
| Segunda | 9 | 16,07 |
| Terceira | 9 | 16,07 |
| Quarta | 6 | 10,71 |
| Quinta ou mais | 13 | 23,21 |
| Tratamento Inicial | ||
| PQT‐PB | 21 | 37,50 |
| PQT‐MB | 35 | 62,50 |
| TOTAL | 56 | 100 |
PQT‐MB, poliquimoterapia multibacilar; PQT‐PB, poliquimioterapia paucibacilar.
A maioria dos EA ocorreu nas primeiras doses supervisionadas – 33,92% na primeira e 76,78% até a quarta dose (tabela 2). A DDS foi a substância mais implicada, correspondendo a 96,7% dos EA (59/61), e foi substituída em quase metade dos casos (49,15%). A rifampicina (RFP) isoladamente representou 3,27% dos EA e foi suspensa em apenas um paciente, por cefaleia refratária. Trombocitopenia leve ocorreu em três pacientes que faziam uso de RFP+DDS. Alguns pacientes tiveram mais de um EA (tabela 3).
Efeitos adversos, respectivas substâncias causadoras e ocorrência de suspensão
| Efeito adverso por dapsona | n | Suspensão da dapsona |
|---|---|---|
| Anemia hemolítica crônica | 24 | 11 |
| Anemia hemolítica aguda | 17 | 12 |
| Fotossensibilidade/fotodermatite | 2 | 2 |
| Meta‐hemoglobinemia | 1 | 1 |
| Manifestação gastrintestinal | 8 | 0 |
| Síndrome de hipersensibilidade a dapsona | 3 | 3 |
| Efeito adverso por rifampicina | n | Suspensão da rifampicina |
|---|---|---|
| Manifestação gastrintestinal | 1 | 0 |
| Cefaleia | 1 | 1 |
| Efeito adverso por clofazimina e dapsona | n | Suspensão da dapsona ou clofazimina |
|---|---|---|
| Manifestação gastrintestinal | 1 | 0 |
| Efeito adverso por rifampicina e dapsona | n | Suspensão da dapsona ou rifampicina |
| Plaquetopenia | 3 | 0 |
| Total de efeitos adversos | 61 | 30 |
Dos 196 pacientes acompanhados, verificou‐se uma chance de 64% de os pacientes em tratamento com MB serem do sexo masculino. Nobre et al. reportaram duas vezes mais MB em homens (OR = 2,36; 95% IC 2,33‐2,38).2 Metade dos pacientes tinha entre 20 e 40 anos. Dados da literatura mostram que os EA podem ocorrer em até metade dos pacientes (45%) em tratamento com PQT; neste estudo, ocorreu em menos de 30%.3–5
Embora mais de 25% (n = 56) dos pacientes tenham sofrido algum EA, o medicamento foi substituído em 30 dos 185 casos que iniciaram o regime padrão. Mais de dois terços dos EA ocorreram nos primeiros quatro meses do tratamento, e a DDS foi a medicação mais envolvida, conforme relatos da literatura.5 EA hematológicos ocorreram em quase três quartos dos pacientes e têm sido relacionados à capacidade individual de acetilação e hidroxilação das sulfaminas (DDS). Indivíduos com hemoglobinopatias, deficiência G6PD e aqueles que recebem medicamentos oxidativos podem apresentar maior risco de anemia hemolítica.6 Fotoalergia pela DDS levou à descontinuação da substância em dois casos.
A ocorrência de EA em mulheres foi duas vezes maior, corroborando os achados de Dupnik sobre a associação do sexo feminino ao risco aumentado de reação a substâncias.7 Genes da G6PD estão no cromossomo X, e algumas mutações levam mulheres com deficiência parcial a desenvolver sintomas.8 Neste estudo, foi demonstrado que mulheres com mais de 45 anos de idade têm maior risco de EA, diferente de Dupnik, que o encontrou em mulheres mais novas.7
A chance de um indivíduo ter EA para ambos os sexos aumenta a cada ano de idade (OR = 1,02; 95% IC 1,00‐1,04). A metabolização mais lenta nos pacientes mais velhos justificaria esse achado.9 Goulart et al. também encontraram um risco aumentado de efeitos hematológicos em pacientes mais velhos.3 Síndrome sulfônica, embora grave, é infrequente e ocorreu em 1,53% dos casos, o que está de acordo com a literatura.3,5,10 As queixas gastrintestinais melhoraram com orientações sobre a ingestão concomitante a alimentos e/ou uso de antieméticos, não necessitando suspensão da medicação.
ConclusãoA DDS foi responsável pelo maior número de casos de EA, principalmente no primeiro trimestre de tratamento. Anemia foi o EA mais frequente, principalmente em mulheres. O risco de EA aumenta a cada ano de idade. Esses achados reforçam a necessidade de maior vigilância no início do tratamento nas mulheres e em pacientes com idade mais elevada.
Suporte financeiroNenhum.
Contribuição dos autoresVioleta Duarte Tortelly: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Egon Luiz Daxbacher: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica da literatura.
Arles Martins Brotas: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Sueli Carneiro: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Conflito de interessesNenhum.