O tratamento da leishmaniose cutânea é um desafio. Um melhor entendimento dos mecanismos in situ envolvidos na evolução e cura da doença são essenciais para o desenvolvimento de novas terapias.
ObjetivoCorrelacionar as características histopatológicas e imunológicas das lesões de leishmaniose cutânea com a evolução clínica após diferentes regimes de tratamento.
MétodosAnalisamos a infiltração celular e a imunomarcação com CD4, CD8 e IL‐17 em biópsias de 33 pacientes com leishmaniose cutânea antes do tratamento. Todos os pacientes foram recrutados em um ensaio clínico randomizado em Corte de Pedra (BA, Brasil) e designados para receber Glucantime®, Glucantime®+tamoxifeno oral ou Glucantime®+tamoxifeno tópico. Os pacientes foram acompanhados por dois a seis meses para definir o desfecho da doença.
ResultadosUma expressão semelhante de CD4, CD8 e IL‐17 foi observada nas lesões independentemente do resultado clínico. Em geral, foi observada maior quantidade de células CD8 em comparação com as células CD4. Uma observação importante foi que todos os pacientes cujo infiltrado celular não evidenciou plasmócitos foram curados após o tratamento.
Limitações do estudoA quantificação isolada de T‐CD8 e IL‐17 por imuno‐histoquímica é insuficiente para analisar o papel dessas moléculas na imunopatogênese da leishmaniose cutânea. Além disso, a expansão do painel de imuno‐histoquímica possibilitaria uma análise mais completa da resposta imune in situ.
ConclusõesA ausência de plasmócitos nas lesões de leishmaniose cutânea foi relacionada a um resultado terapêutico favorável.
A leishmaniose cutânea (LC) é causada por um protozoário intracelular do gênero Leishmania transmitido ao homem por inoculação por meio da picada de mosquito. A LC é endêmica na América do Sul, e o Brasil está entre os 10 países que concentram 75% dos casos de LC no mundo.1 A LC é uma doença tipicamente de países de baixa renda associada à pobreza e a condições insalubres.2
A LC tem uma imunopatogênese complexa, que ainda não foi totalmente compreendida. Está bem estabelecido que, em geral, o principal mecanismo de defesa contra agentes intracelulares, como a Leishmania, está associado à ativação da imunidade celular por meio da produção de citocinas T helper 1 (Th1), como interferon‐gama (IFN‐γ), fator de necrose tumoral alfa (TNF‐α) e interleucina 12 (IL‐12).3 Em contraste, a imunidade humoral relacionada à resposta das células Th2 está associada à persistência de organismos intracelulares e, portanto, à progressão da infecção.4 Portanto, a resposta imune Th1 seria adequada e eficaz para destruir o parasito e evitar doenças ou promover a cura clínica. Entretanto, vários dados indicam que uma resposta Th1 exagerada e desequilibrada pode causar dano intenso ao tecido e formas clínicas mais graves da doença.5,6 De fato, foi demonstrado que o tamanho da úlcera estava positivamente relacionado com as citocinas Th1 circulantes (IFN‐γ e TNF‐α) e células T ativadas, o que confirma essa suposição.7
Além disso, foi demonstrada uma predominância in situ de citocinas inflamatórias Th1 (IFN‐γ e IL‐12) em comparação às anti‐inflamatórias (IL‐10 e IL‐4) antes do tratamento de LC, bem como uma redução significativa dos níveis de TNF‐α e IFN‐γ circulantes após terapia e cura.6,8 Também foi demonstrada uma associação entre células que expressam IL‐17 e a intensidade do infiltrado inflamatório.9
É evidente o importante papel do sistema imunológico na patogênese da LC e suas implicações para a cura definitiva. Consequentemente, compreender a evolução da resposta inflamatória local e sua relação com a cura da LC por meio da caracterização do padrão imunológico no local da lesão pode funcionar como um preditor de resultado terapêutico. O objetivo deste estudo foi verificar se a composição celular do infiltrado inflamatório, bem como a expressão de CD4, CD8 e IL‐17 no local da lesão, podem estar correlacionados ao resultado terapêutico na LC, dado ainda não explorado na literatura.
MétodosPopulação do estudo e seguimentoOs pacientes foram encaminhados ao posto de saúde de Corte de Pedra, BA, Brasil, uma área endêmica de transmissão de Leishmania braziliensis. Os pacientes incluídos tinham idade de 18 a 65 anos; diagnóstico de LC entre 30 e 90 dias do início da lesão cutânea; uma a cinco úlceras com diâmetro, em seu eixo mais longo, entre 10 e 50mm. O diagnóstico foi confirmado por exame histopatológico mostrando formas amastigotas ou por exame de PCR positivo para L. braziliensis. Os critérios de exclusão foram gravidez ou amamentação, outras doenças agudas ou crônicas associadas e leishmaniose anterior. Os pacientes que preencheram os critérios de inclusão foram alocados aleatoriamente em três grupos: Glucantime® parenteral (SbV)+tamoxifeno oral (TO), SbV+tamoxifeno tópico (TT) ou apenas SbV (grupo controle). Os pacientes foram acompanhados mensalmente durante seis meses para a definição do resultado terapêutico; os detalhes são descritos em outro estudo.10
Aspectos éticosO estudo foi aprovado pelo Comitê de Ética do Hospital Universitário Professor Edgard Santos da Bahia, Brasil (Protocolo de Pesquisa n° 106/2009) e pelo Comitê de Ética da Universidade de São Paulo (Protocolo de Pesquisa n° 993.562). O consentimento informado por escrito foi obtido de todos os pacientes incluídos.
Administração dos medicamentosAntimoniato de meglumina (Glucantime®, Aventis) foi administrado por via intravenosa na dose de 20mg SbV/kg/dia por 20 dias; tamoxifeno oral (Sandoz) na dosagem de 20mg, 2×/dia durante 20 dias; tamoxifeno 0,1% em creme (medicamento composto) aplicado sobre todas as úlceras 2×/dia durante 20 dias (sem curativo).
Avaliação de eficáciaA cura inicial e definitiva foi definida como a cicatrização completa da(s) lesão(ões) sem infiltração nas bordas, dois e seis meses após o término do tratamento, respectivamente.
Biópsia e histopatologiaUma biópsia por punch de 4mm foi realizada das bordas das úlceras sob anestesia local antes da terapia. Os fragmentos foram fixados em solução de formalina a 10%. As biópsias de pele foram submetidas a processamento histológico de rotina, e as lâminas foram coradas com Hematoxilina & eosina (H&E) para avaliação histopatológica (padrão de inflamação – perivascular ou nodular e difuso – presença de necrose e composição do infiltrado celular: neutrófilos, plasmócitos, linfócitos, eosinófilos, histiócitos, células epitelioides, células gigantes, bem como presença de formas amastigotas).
Imuno‐histoquímicaO estudo imuno‐histoquímico foi realizado como descrito anteriormente, em 33 biópsias.11 Os seguintes anticorpos primários foram usados: anti‐IL‐17 produzido em coelho (Santa Cruz Biotechnology, Santa Cruz, CA, EUA) e anti‐CD8 de camundongo (Dako, Carpinteria, CA, EUA), anti‐CD4 de camundongo (Dako, Carpinteria, CA, EUA). IgG anticoelho, anticamundongo biotinilado, (DAKO HRP Advance – K 4068) foi usado como anticorpo secundário. As imagens digitais de todos os cortes histológicos imunomarcados foram adquiridos utilizando um microscópio óptico (Nikon E‐600) acoplado a uma câmera digital Q‐color 1 Olympus com aumento de 400×. Os níveis de expressão de T CD4, T CD8 e IL‐17 no infiltrado foram analisados em cinco campos contínuos por fragmento e quantificados por medida da área de células coradas/área total do campo. O primeiro campo selecionado para quantificação em cada amostra foi o que continha visualmente mais células imunomarcadas. A quantificação das áreas imunomarcadas foi realizada às cegas por dois leitores independentes (CSR e VB) utilizando o software Image‐Pro Plus (Media Cybernetics), e o resultado foi expresso como mediana (quartil 25 a quartil 75). Os resultados foram correlacionados com as seguintes variáveis: área da lesão, área da linfadenopatia, duração da doença no dia 0 e resultado terapêutico no sexto mês.
Análise estatísticaAs análises estatísticas foram realizadas com o software SPSS® versão 20 para MAC® e também no Prism 4 (GraphPad Software, San Diego, CA, EUA). As diferenças foram consideradas significativas quando p<0,05. As variáveis contínuas foram expressas em mediana; a diferença entre três grupos foi calculada pelo teste de Kruskal‐Wallis, e entre dois grupos, pelo teste de Mann‐Whitney. As variáveis categóricas foram expressas em frequência absoluta e frequência relativa; para o cálculo da diferença entre três grupos foi utilizado o Teste de Qui‐Quadrado, e entre dois grupos foi realizado o Teste Exato de Fisher. As taxas de cura foram calculadas utilizando ambas as análises de intenção de tratar (ITT) e por protocolo (PP).
ResultadosDesfechos terapêuticosOs 38 pacientes com LC foram alocados em três grupos: SbV (n=15); SbV+TT (n=11) e SbV+TO (n=12) (tabela 1). Durante o seguimento, quatro pacientes não completaram o protocolo de tratamento corretamente em decorrência de: reação adversa (dois pacientes: um do grupo SbV+TT e outro do grupo SbV+TO), uso de subdose de SbV (um paciente do grupo SbV+TO) e um paciente do grupo controle não retornou para as avaliações médicas após a inclusão. Esses pacientes foram excluídos deste estudo in situ. Além disso, um paciente do ensaio clínico não foi submetido à biópsia de pele e também foi excluído desta análise. Assim, entre 38 pacientes do ensaio clínico, 33 fizeram parte deste estudo in situ. Embora não significativas, as maiores taxas de cura de 80% e 70% foram observadas no grupo SbV+TO, aos dois e seis meses, respectivamente (tabela 1).
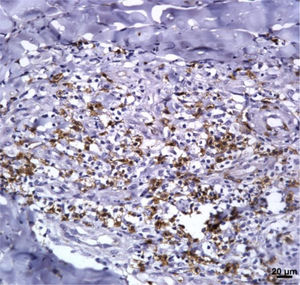
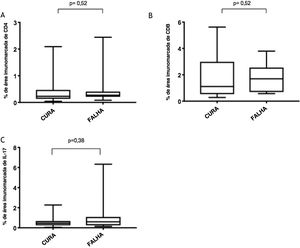
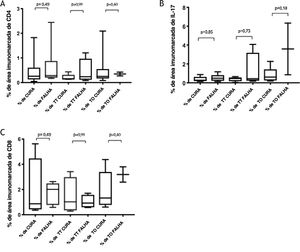
Marcadores imunológicosA expressão de T CD8+ em lesões de LC antes do tratamento é mostrada na figura 1. A análise da porcentagem média de células T CD4+ e T CD8+ imunomarcadas (fig. 2) mostrou uma expressão mais alta de células T CD8+. Para ambas as subpopulações, não houve diferenças em sua expressão entre os pacientes que apresentaram cura (n=17) e aqueles que apresentaram falha (n=16) em dois meses. A imunomarcação com IL‐17 foi maior no grupo que apresentou falha, porém não houve diferença significativa entre os grupos de cura e falha (fig. 2). Além disso, a avaliação da expressão de IL‐17, células T CD4+ e T CD8+ não mostrou diferenças quando os subgrupos de tratamento foram comparados (fig. 3).
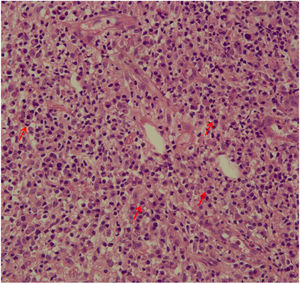
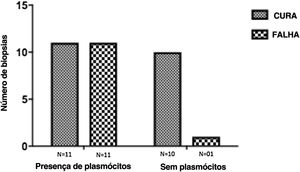
A avaliação do infiltrado inflamatório mostrou poucas diferenças entre os casos. A maioria dos pacientes apresentava biópsias com padrão inflamatório nodular e difuso, e apenas dois pacientes apresentavam padrão perivascular superficial e profundo. Em todos os casos, as células inflamatórias predominantes foram macrófagos e linfócitos. A maioria tinha neutrófilos (26/33; 78%), e em 14 casos (42%) foram observadas áreas de necrose na derme. Células gigantes foram identificadas em 13 (39%) lesões. Em três dos 33 fragmentos analisados foi observada uma quantidade significativa de eosinófilos. Plasmócitos foram encontrados no infiltrado inflamatório da maioria dos pacientes com LC (fig. 4). Curiosamente, os plasmócitos estavam ausentes em 11 indivíduos (33%), e todos esses 11 pacientes foram curados em dois meses, com apenas uma recidiva antes de seis meses (p<0,05; fig. 5).
A patogênese da LC segue um conjunto complexo de interações entre muitos fatores desencadeados pelas respostas imunes inatas e adquiridas do hospedeiro. Essas respostas inflamatórias são mediadoras do desfecho da infecção e expressão da doença.12
O papel das células T CD8+ na infecção por Leishmania pode estar associado à proteção ou dano ao tecido, dependendo das funções efetoras desencadeadas pela infecção.13 No entanto, há evidências crescentes da associação de células T CD8+ com a progressão da doença e alterações patológicas. Há uma frequência maior de células T CD8+ em úlceras de LC em comparação com lesões iniciais de LC antes da ulceração; as células T CD8+ de pacientes com lesões ulceradas de LC produziram mais granzima B e tiveram mais atividade citotóxica do que as células de pacientes com infecção subclínica; a citotoxicidade mediada por células T CD8+ ativa o inflamassoma de NLRP3 em lesões de LC.14–16
No presente estudo, observamos uma predominância de células T CD8+ sobre as células T CD4+ nas lesões ulceradas pré‐tratamento. Essa observação reforça a ideia de que as células T CD8+ estão mais envolvidas na patogênese da doença do que as células T CD4+. Entretanto, não fomos capazes de associar a expressão de células T CD8+ ou CD4 + ao resultado terapêutico.
Também avaliamos a expressão de IL‐17 decorrente de sua associação direta com o infiltrado inflamatório na LC e seu possível papel na doença.9 Embora sua expressão mais alta tenha sido encontrada em um indivíduo com LC que apresentou falha terapêutica, a comparação entre os grupos não mostrou diferenças. É possível que um tamanho de amostra maior, bem como a avaliação de outros mediadores inflamatórios como IL‐ ou granzima, possam contribuir para avaliar o perfil de T CD8+ presente nas lesões e fornecer uma correlação com o resultado terapêutico com maior precisão.
Um dado surpreendente foi a correlação entre a ausência de plasmócitos na úlcera antes do tratamento e a cura terapêutica em dois meses em todos os indivíduos, embora um paciente tenha apresentado recidiva entre dois e seis meses. A presença de plasmócitos é reconhecida como uma característica importante do infiltrado inflamatório na LC. Entretanto, o papel exato dos plasmócitos na patogênese da LC ainda precisa ser determinado e provavelmente foi subestimado. Ridley et al. observaram uma correlação positiva significativa entre a presença de necrose e a intensidade da infiltração de plasmócitos e linfócitos.17 Por outro lado, biópsias de pele de lesões de LC não ulceradas ou atípicas, presumivelmente com uma reação inflamatória menor, apresentaram também uma quantidade menor de plasmócitos.18 Um grande número de plasmócitos está normalmente presente nos estágios finais da lesão de LC.19 As limitações do estudo são o baixo número de pacientes e a ausência da avaliação de outros marcadores da resposta imune in situ.
ConclusãoNossos dados sugerem um possível papel dos plasmócitos na patologia da LC e como marcador de resultado terapêutico, uma vez que sua ausência no infiltrado foi associada à cura em todos os casos, com apenas uma recidiva. Avaliação adicional de marcadores específicos para células B e plasmócitos em úlceras de LC, bem como estudos funcionais, devem ser realizados para verificar seu potencial papel patogênico na LC.
Suporte financeiroFunaderm – Fundo de Apoio à Dermatologia.
Contribuição dos autoresCamila Sampaio Ribeiro: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Riam Rocha França: Aprovação da versão final do manuscrito; obtenção, análise e interpretação de dados; elaboração e redação do manuscrito; análise estatística.
Juliana Almeida Silva: Aprovação da versão final do manuscrito; obtenção, análise e interpretação de dados; elaboração e redação do manuscrito.
Silvana Conceição da Silva: Aprovação da versão final do manuscrito; obtenção, análise e interpretação de dados; elaboração e redação do manuscrito.
Sílvia R.B. Uliana: Participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; obtenção, análise e interpretação de dados.
Viviane Sampaio Boaventura: Aprovação da versão final do manuscrito; revisão crítica da literatura; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Paulo R. L. Machado: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Conflito de interessesNenhum.
AgradecimentosAgradecemos ao Dr. Newton Sales Guimarães (IPAC ‐ Anatomia Patológica e Citopatologia) pelo apoio no processamento de biópsias de pele para análise em H&E.
Agradecemos a Ana Maria da Silva Carvalho e Cristina dos Santos Vasconcelos Mota pela colaboração, auxiliando na realização da imunomarcação das biópsias de pele.
Como citar este artigo: Ribeiro CS, França RR, Silva JA, Silva SC, Uliana SRB, Boaventura VS, Machado PRL. Cellular infiltrate in cutaneous leishmaniasis lesions and therapeutic outcome. An Bras Dermatol. 2021;96:544–50.
Trabalho realizado no Immunology Service, Hospital Universitário Prof. Edgar Santos, Universidade Federal da Bahia, Salvador, BA, Brasil.