O líquen simples crônico é causado pelo ato de coçar em excesso, com poucos estudos na psiconeuroimunologia.
ObjetivoNosso objetivo foi estimar os níveis de estresse, depressão e ansiedade, e medir os níveis séricos de neurotrofinas em pacientes com líquen simples crônico e correlacionar estes parâmetros com a gravidade da doença e prurido.
MétodosForam incluídos 36 pacientes com líquen simples crônico e 36 controles saudáveis pareados por idade e sexo. Cada participante recebeu os questionários Hospital Anxiety and Depression Scale e Perceived Stress Scale, juntamente com uma escala visual analógica para prurido. Os níveis de neurotrofinas (fator neurotrófico derivado do cérebro, neurotrofina‐3, fator de crescimento neural, fator neurotrófico derivado de linhagem de células gliais) foram determinados por ensaios ELISA.
ResultadosOs escores das escalas Perceived Stress Scale‐10 e Hospital Anxiety and Depression Scale foram estatisticamente maiores nos pacientes (p<0,05 para todos). Os níveis séricos de todas as neurotrofinas foram significantemente menores nos pacientes em comparação com os controles saudáveis (p<0,05 para todos). A gravidade da doença mostrou correlação não significante com as neurotrofinas. Nos modelos de regressão linear aplicados para aumento dos escores da escala visual analógica – escores de prurido e gravidade da doença – essas duas variáveis foram preditores estatisticamente significantes (p=0,043).
Limitações do estudoNosso estudo não abordou uma relação causal direta.
ConclusãoPacientes com líquen simples crônico estão sob níveis elevados de estresse, ansiedade e depressão, e apresentam níveis reduzidos de neurotrofinas, o que pode sugerir participação na fisiopatologia desse distúrbio.
O líquen simples crônico (LSC), ou neurodermatite circunscrita, é uma condição dermatológica comum, caracterizada pela liquenificação da pele decorrente do ato de coçar e/ou friccionar excessivamente a pele, causada pelo ciclo prurido‐coçar‐prurido, que é difícil de quebrar. Estima‐se que o LSC afete até 12% da população total.1 Embora alguns autores acreditem que seja uma forma crônica e localizada de dermatite atópica, sua patogênese ainda não está esclarecida. Relatos anteriores indicam que fatores psicológicos podem desempenhar um papel no início da doença e em sua persistência. Pacientes com LSC têm incidência proporcionalmente maior de transtornos depressivos, dissociativos e de ansiedade, traços de transtorno de personalidade obsessiva‐compulsiva, distúrbios do sono e disfunção sexual.2–5 Reportou‐se que pacientes com LSC tinham um aumento de probabilidade de transtornos comórbidos de saúde mental, incluindo transtornos do desenvolvimento, psicóticos e do humor, abuso de substâncias e transtornos cognitivos.6
A pele é o maior e mais inervado órgão do corpo, e o cérebro compartilha uma origem embriológica comum com o ectoderma. O sistema nervoso central (SNC) responde ao estresse psicológico ativando o eixo hipotálamo‐pituitária‐adrenal (HPA) e o sistema nervoso autônomo e modulando a microglia a nível local. As neurotrofinas, como o fator neurotrófico derivado do cérebro (BDNF, do inglês brain‐derived neurotrophic factor), neurotrofina‐3 (NT‐3), fator de crescimento do nervo (NGF, do inglês nerve growth factor) e fator neurotrófico derivado de linhagem de células gliais (GDNF, do inglês glial cell line‐derived neurotrophic factor), mostram efeitos neuroprotetores no SNC e desempenham um papel crucial no crescimento, diferenciação, manutenção e plasticidade sináptica dos sistemas neuronais e imunológicos. Anormalidades nos níveis desses fatores neurotróficos podem contribuir para a disfunção dos astrócitos e da microglia.7 Isso pode, por sua vez, criar diretamente algumas alterações na pele ou induzir a liberação de mediadores imunológicos ou hormonais que causam alterações patológicas na pele, ao perturbar o equilíbrio dos mediadores do sistema nervoso.8 Vários estudos confirmaram a presença de níveis elevados de NGF ou BDNF na dermatite atópica, urticária espontânea crônica, dermografismo sintomático, pacientes com acne vulgar com sintomas depressivos e pacientes urêmicos com prurido.9–14
Os objetivos de nosso estudo foram investigar os níveis de depressão, ansiedade, qualidade de vida e estresse percebidos e medir se os níveis de neurotrofina sérica em pacientes com LSC e determinar se há uma relação entre esses parâmetros e a gravidade dos sintomas.
MétodosEste estudo transversal, caso‐controle, foi realizado entre outubro de 2019 e novembro de 2020. Trinta e seis pacientes com diagnóstico de LSC e 36 indivíduos saudáveis pareados por idade e sexo foram incluídos no estudo. Os critérios de exclusão foram indivíduos menores de 18 anos, com qualquer outra doença cutânea/sistêmica ou mental, ou em uso de qualquer medicamento. O estudo foi aprovado pelo Comitê de Ética (n.° 1347). Todos os indivíduos deram seu consentimento informado antes da participação no estudo e foram examinados pelos mesmos dermatologistas. Investigações relevantes e/ou biópsias de pele foram realizadas para confirmar o diagnóstico de LSC, quando indicado. A gravidade da doença (leve, moderada ou grave) foi registrada15. Os dados demográficos, a gravidade da doença e os resultados do Dermatology Life Quality Index (DLQI), HADS,16 PSS‐10 e VAS‐Pruritus foram registrados para cada participante.16,17 Os níveis séricos de IgE foram determinados utilizando um ensaio de quimioluminescência automatizado; e os níveis de NGF, NT‐3, GDNF e BDNF foram determinados utilizando kits de ELISA. Detalhes completos dos questionários, dos testes ELISA e das análises estatísticas estão incluídos nos Materiais Suplementares.
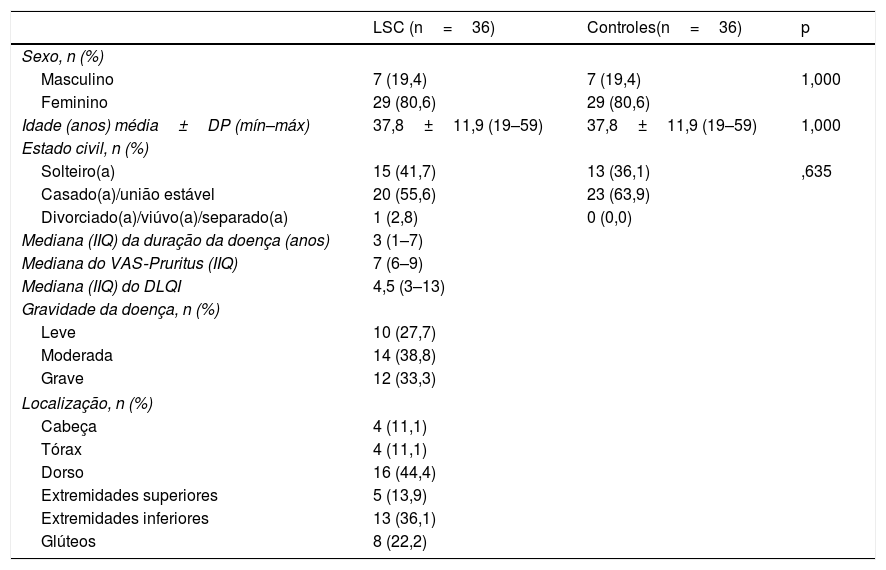
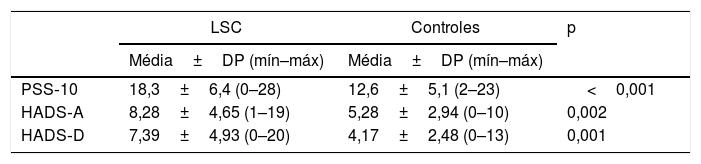
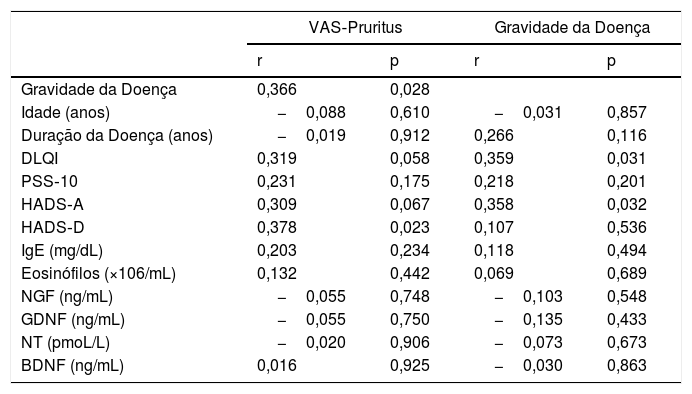
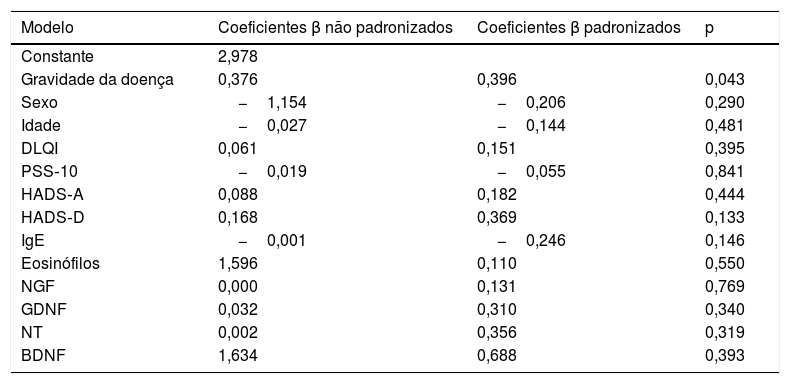
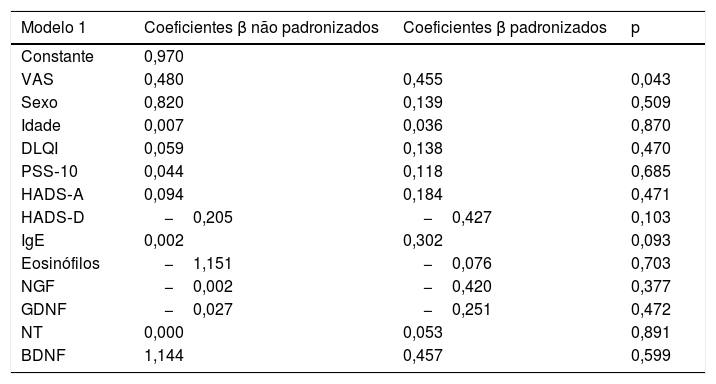
ResultadosOs dados demográficos e as características da doença do grupo de estudo são apresentados na tabela 1. A média de idade foi de 37,8±11,9, e a localização mais comum foi na região dorsal (n=16.44%). Os escores do PSS‐10, HADS‐A e HADS‐D foram estatisticamente maiores no grupo de LSC. Os parâmetros laboratoriais de todas as neurotrofinas foram significantemente menores no grupo de LSC (tabela 2). Os valores médios de IgE sérica e contagem de eosinófilos no sangue periférico não diferiram entre os grupos. Uma análise de correlação mostrou que a gravidade da doença (r=0,366, p=0,028) e o escore HADS‐D (r=0,378, p=0,023) correlacionaram‐se com o escore VAS‐Pruritus, enquanto o escore HADS‐A correlacionou‐se com a gravidade da doença (r=0,358, p=0,032). A gravidade da doença não apresentou correlação com os níveis séricos de todas as quatro neurotrofinas (p>0,05 para todas; tabela 3). As análises de regressão linear para avaliar a contribuição dos escores de todos os questionários aplicados (HADS, PSS‐10, DLQI) e os níveis séricos de neurotrofinas, bem como de IgE sérica e contagem de eosinófilos para os escores de VAS‐Pruritus e gravidade da doença, são mostradas nas tabelas 4 e 5. A gravidade da doença foi estatisticamente associada ao escore VAS‐Pruritus (p=0,043 e β=0,396).
Dados demográficos e características clínicas dos pacientes com líquen simples crônico (LSC) e controles
| LSC (n=36) | Controles(n=36) | p | |
|---|---|---|---|
| Sexo, n (%) | |||
| Masculino | 7 (19,4) | 7 (19,4) | 1,000 |
| Feminino | 29 (80,6) | 29 (80,6) | |
| Idade (anos) média±DP (mín–máx) | 37,8±11,9 (19–59) | 37,8±11,9 (19–59) | 1,000 |
| Estado civil, n (%) | |||
| Solteiro(a) | 15 (41,7) | 13 (36,1) | ,635 |
| Casado(a)/união estável | 20 (55,6) | 23 (63,9) | |
| Divorciado(a)/viúvo(a)/separado(a) | 1 (2,8) | 0 (0,0) | |
| Mediana (IIQ) da duração da doença (anos) | 3 (1–7) | ||
| Mediana do VAS‐Pruritus (IIQ) | 7 (6–9) | ||
| Mediana (IIQ) do DLQI | 4,5 (3–13) | ||
| Gravidade da doença, n (%) | |||
| Leve | 10 (27,7) | ||
| Moderada | 14 (38,8) | ||
| Grave | 12 (33,3) | ||
| Localização, n (%) | |||
| Cabeça | 4 (11,1) | ||
| Tórax | 4 (11,1) | ||
| Dorso | 16 (44,4) | ||
| Extremidades superiores | 5 (13,9) | ||
| Extremidades inferiores | 13 (36,1) | ||
| Glúteos | 8 (22,2) | ||
Comparação dos escores dos questionários e parâmetros laboratoriais entre líquen simples crônico (LSC) e controles
| LSC | Controles | p | |
|---|---|---|---|
| Média±DP (mín–máx) | Média±DP (mín–máx) | ||
| PSS‐10 | 18,3±6,4 (0–28) | 12,6±5,1 (2–23) | <0,001 |
| HADS‐A | 8,28±4,65 (1–19) | 5,28±2,94 (0–10) | 0,002 |
| HADS‐D | 7,39±4,93 (0–20) | 4,17±2,48 (0–13) | 0,001 |
| Mediana (IIQ) | Mediana (IIQ) | ||
|---|---|---|---|
| IgE (mg/dL) | 36,7 (8,3–121) | 58,1 (21,2–100) | 0,374 |
| Eosinófilos (× 106/mL) | 0,13 (0,06–0,27) | 0,12 (0,08–0,18) | 0,969 |
| NGF (ng/mL) | 141,7 (80,3–689,9) | 437 (148,4–1,142,0) | 0,010 |
| GDNF (ng/mL) | 1,61 (0,88–11,63) | 5,24 (1,80–20,26) | 0,019 |
| NT (pmoL/L) | 49 (27,1–143,1) | 98,2 (47,2–242) | 0,012 |
| BDNF (ng/mL) | 0,88 (0,71–1,87) | 1,34 (0,92–2,43) | 0,004 |
Correlação de Spearman entre VAS‐Pruritus, gravidade da doença e parâmetros do estudo
| VAS‐Pruritus | Gravidade da Doença | |||
|---|---|---|---|---|
| r | p | r | p | |
| Gravidade da Doença | 0,366 | 0,028 | ||
| Idade (anos) | −0,088 | 0,610 | −0,031 | 0,857 |
| Duração da Doença (anos) | −0,019 | 0,912 | 0,266 | 0,116 |
| DLQI | 0,319 | 0,058 | 0,359 | 0,031 |
| PSS‐10 | 0,231 | 0,175 | 0,218 | 0,201 |
| HADS‐A | 0,309 | 0,067 | 0,358 | 0,032 |
| HADS‐D | 0,378 | 0,023 | 0,107 | 0,536 |
| IgE (mg/dL) | 0,203 | 0,234 | 0,118 | 0,494 |
| Eosinófilos (×106/mL) | 0,132 | 0,442 | 0,069 | 0,689 |
| NGF (ng/mL) | −0,055 | 0,748 | −0,103 | 0,548 |
| GDNF (ng/mL) | −0,055 | 0,750 | −0,135 | 0,433 |
| NT (pmoL/L) | −0,020 | 0,906 | −0,073 | 0,673 |
| BDNF (ng/mL) | 0,016 | 0,925 | −0,030 | 0,863 |
Modelo de regressão linear para variáveis identificadas como significantes para aumento do escore do VAS‐Pruritus
| Modelo | Coeficientes β não padronizados | Coeficientes β padronizados | p |
|---|---|---|---|
| Constante | 2,978 | ||
| Gravidade da doença | 0,376 | 0,396 | 0,043 |
| Sexo | −1,154 | −0,206 | 0,290 |
| Idade | −0,027 | −0,144 | 0,481 |
| DLQI | 0,061 | 0,151 | 0,395 |
| PSS‐10 | −0,019 | −0,055 | 0,841 |
| HADS‐A | 0,088 | 0,182 | 0,444 |
| HADS‐D | 0,168 | 0,369 | 0,133 |
| IgE | −0,001 | −0,246 | 0,146 |
| Eosinófilos | 1,596 | 0,110 | 0,550 |
| NGF | 0,000 | 0,131 | 0,769 |
| GDNF | 0,032 | 0,310 | 0,340 |
| NT | 0,002 | 0,356 | 0,319 |
| BDNF | 1,634 | 0,688 | 0,393 |
Modelo de regressão linear para variáveis identificadas como significantes para a gravidade da doença
| Modelo 1 | Coeficientes β não padronizados | Coeficientes β padronizados | p |
|---|---|---|---|
| Constante | 0,970 | ||
| VAS | 0,480 | 0,455 | 0,043 |
| Sexo | 0,820 | 0,139 | 0,509 |
| Idade | 0,007 | 0,036 | 0,870 |
| DLQI | 0,059 | 0,138 | 0,470 |
| PSS‐10 | 0,044 | 0,118 | 0,685 |
| HADS‐A | 0,094 | 0,184 | 0,471 |
| HADS‐D | −0,205 | −0,427 | 0,103 |
| IgE | 0,002 | 0,302 | 0,093 |
| Eosinófilos | −1,151 | −0,076 | 0,703 |
| NGF | −0,002 | −0,420 | 0,377 |
| GDNF | −0,027 | −0,251 | 0,472 |
| NT | 0,000 | 0,053 | 0,891 |
| BDNF | 1,144 | 0,457 | 0,599 |
Nossos resultados mostraram aumento de estresse, ansiedade e depressão no grupo LSC em comparação com os controles. O estresse percebido refere‐se aos sentimentos ou pensamentos que um indivíduo tem sobre quanto estresse o mesmo está sofrendo em um determinado momento ou durante um determinado período. As definições teóricas de estresse destacam o papel da percepção como um fator crucial na sua experiência.18 O PSS mede a percepção de estresse dos indivíduos no último mês. O fato de que os pacientes com LSC tinham escores de PSS mais altos do que os controles apoia a ideia de que os pacientes com LSC experimentam maior sofrimento mental – portanto, que o estresse mental pode desempenhar um papel no LSC. Os fatores estressantes crônicos podem promover alterações psiconeuroimunológicas através do eixo HPA, resultando em uma exacerbação das doenças cutâneas atuais ou no desenvolvimento de novas doenças. Essas condições podem afetar negativamente a qualidade de vida de uma pessoa, resultando em um declínio no bem‐estar psicológico e uma exacerbação dos distúrbios psiquiátricos atuais ou no aparecimento de novos distúrbios. Além disso, encontramos altos escores de VAS‐Pruritus (média=7, mín.‐máx. 6‐9) em pacientes com LSC que se correlacionou com a gravidade da doença e com os escore de HADS‐D. Portanto, a gravidade do prurido, da doença e da depressão desempenhou um papel no processo de LSC. Dalgard et al.19 reportou que a presença de prurido em pacientes dermatológicos estava significantemente associada à depressão clínica, ideias suicidas e estresse em vários países. Yamamato et al.20 investigaram a ligação entre sintomas de prurido e estresse psicológico utilizando o PSS e mostrou‐se que havia uma relação entre a gravidade do prurido e os sintomas psicológicos na população em geral. Yalçın et al.21 descobriram que 62% dos 50 pacientes com LSC tinham pelo menos uma comorbidade psiquiátrica, principalmente transtorno depressivo maior (32%), distimia (18%) e transtorno de ansiedade generalizada (12%). Halvorsen et al.22 afirmaram que o prurido é um fator de risco maior para problemas psicológicos comparado com o eczema crônico sem prurido.
Todas esses achados questionam se o sistema psiconeuroimunológico desempenha algum papel patogenético na relação entre o prurido e o estresse psicológico e, portanto, entre LSC e estresse psicológico. Afinal, os sistemas neurológico, endócrino e imunológico interagem entre si para desenvolver uma resposta de estresse suficiente para o corpo e a mente utilizando uma série de neurotrofinas, neuropeptídeos, neurotransmissores e neuro‐hormônios.
As neurotrofinas pertencem a uma família de fatores tróficos que regulam a sobrevivência, o crescimento e a morte celular programada dos neurônios.23 Elas exercem funções imunomoduladoras não apenas nos nervos, mas também nas células do sistema imunológico, o que foi comprovado anteriormente para o NGF.24 Algumas neurotrofinas foram estudadas em diferentes condições dermatológicas.9,10,12–14 Em várias inflamações crônicas da pele, como dermatite atópica, psoríase e prurigo, a expressão de NGF estava aumentada nas lesões.25–27 De fato, relatou‐se que o número de fibras nervosas periféricas e a concentração de NGF em lesões de LSC são mais altas. Em nosso estudo, é digno de nota o fato de que os níveis de todas as neurotrofinas, incluindo NT‐3, NGF, GDNF e BDNF, eram significantemente menores em pacientes com LSC em comparação com os controles saudáveis. Isso pode significar que essas quedas estavam longe de ser ocorrências casuais. Além disso, neurotrofinas, especialmente BDNF e NT‐3, foram investigadas em transtornos de humor, e descobriu‐se que as mesmas desempenham um papel na depressão e na ansiedade.28 He et al.13 demonstraram que os níveis séricos de BDNF eram mais baixos e associados negativamente a sintomas depressivos em jovens adultos chineses com acne vulgar. Eles também descobriram que a gravidade da doença não estava relacionada aos escores de depressão em seus pacientes com acne, como no presente estudo em LSC. Em nosso estudo, todas as neurotrofinas se correlacionaram negativamente com a gravidade da doença.
Finalmente, os pacientes com LSC tinham níveis percebidos aumentados de estresse, ansiedade e depressão, e também níveis diminuídos de neurotrofinas, que desempenham um papel significativo na química do cérebro e dos nervos. No entanto, ainda não respondemos à pergunta de quem veio primeiro: o LSC ou essas questões psiconeuroimunológicas. Diminuição nos níveis de neurotrofinas pode levar à depressão ou ansiedade e pode desencadear o LSC – ou, inversamente, o LSC pode causar depressão ou ansiedade ao reduzir a qualidade de vida, o que, por sua vez, pode diminuir as neurotrofinas. Isso pode até mesmo ser uma relação de mão dupla. Esses resultados podem ser utilizados para ajudar a compreender melhor a doença, esclarecer sua patogênese ou descobrir novas opções de terapia para LSC no futuro.
ConclusãoO presente estudo mostrou que pacientes com LSC apresentam aumento dos níveis de estresse, ansiedade e depressão e diminuição da qualidade de vida e dos níveis de neurotrofinas. A redução dos níveis séricos de neurotrofinas pode estar diretamente relacionada à etiologia do LSC ou estar associada ao alto percentual de transtornos psiquiátricos nessa população de pacientes. Estudos futuros são necessários para abordar as bases psiconeuroimunológicas do LSC e para desenvolver novas terapias.
Suporte financeiroUniversity of Health Sciences, coordenação de projetos de pesquisa científica.
Contribuição dos autoresİlknur Kıvanç Altunay: Aprovação da versão final do manuscrito; revisão crítica do manuscrito; concepção e planejamento do estudo.
Ezgi Özkur: Revisão crítica da literatura; elaboração e redação do manuscrito; análise estatística.
Ece Uğurer: Obtenção, análise e interpretação dos dados.
Ecem Baltan: Obtenção, análise e interpretação dos dados.
Çiğdem Aydın: Participação efetiva na orientação da pesquisa.
Erdinç Serin: Revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Altunay İK, Özkur E, Uğurer E, Baltan E, Aydın Ç, Serin E. More than a skin disease: stress, depression, anxiety levels, and serum neurotrophins in lichen simplex chronicus. An Bras Dermatol. 2021;96:700–5.
Trabalho realizado no Şişli Hamidiye Etfal Research and Training Hospital, Istambul, Turquia.