A psoríase é uma doença de caráter inflamatório, crônico e recorrente com evidente influência genética. A intensidade, a extensão e as diferentes manifestações associadas à doença norteiam a indicação terapêutica. Avanços no conhecimento da imunopatologia da doença durante as últimas décadas culminaram com o desenvolvimento de novas medicações, chamadas imunobiológicos, que agem de modo pontual e específico em diferentes níveis da cascata inflamatória da psoríase.1 Com a introdução dos medicamentos da classe antifator de necrose tumoral alfa (anti‐TNF‐α) – etanercepte (ETA), infliximabe (INF), adalimumabe (ADA) e certolizumabe pegol (CP) – seguidas dos inibidores da interleucina 12/23, o ustequinumabe (UST), da interleucina 17 – secuquinumabe (SEC) e ixequizumabe (IXE) – e, mais recentemente, dos inibidores da interleucina 23 isoladamente – guselcumabe (GUS) e risanquizumabe (RISA) –, tornou‐se possível o eficaz tratamento das formas graves e refratárias da doença, associados a um perfil de segurança satisfatório. Por outro lado, indefinição sobre a escolha da medicação mais adequada, a resposta sustentada a longo prazo e a possibilidade de interromper a terapia impactam a decisão terapêutica.
Define‐se sobrevida da droga, ou “drug survival”, o tempo decorrente do início à descontinuação de determinado tratamento. O intervalo de tempo decorrente do início do tratamento até sua suspensão, bem como os motivos que levaram a esse desfecho, seja por perda de eficácia, complicações ou abandono do tratamento, podem variar nas diferentes populações com psoríase.2,3 Não existem, até o presente momento, dados relacionando a resposta terapêutica ao tempo de sobrevida dos imunobiológicos em doentes com psoríase no Brasil.
No intuito de determinar o tempo de sobrevida da droga, o total de 229 tratamentos com agentes imunobiológicos foi avaliado em 110 pacientes com psoríase moderada a grave do Hospital das clínicas da Universidade de São Paulo, no estado de São Paulo, por um período de dois anos e avaliados quanto à resposta aos imunobiológicos, número de tratamentos prévios e o motivo de descontinuação. A análise de prontuários também possibilitou a coleta de dados em relação aos tratamentos anteriores desde a introdução dos imunobiológicos como opção terapêutica. Definiu‐se sobrevida da droga o tempo desde o início do tratamento com o imunobiológico, ou seja, a primeira dose, até a ocorrência do evento de interesse (descontinuação temporária/definitiva do tratamento). As curvas de Kaplan‐Meier foram adotadas para estimar cada uma das probabilidades de sobrevida da droga e a diferença entre as curvas de sobrevida da droga foi verificada por meio do teste de logrank.
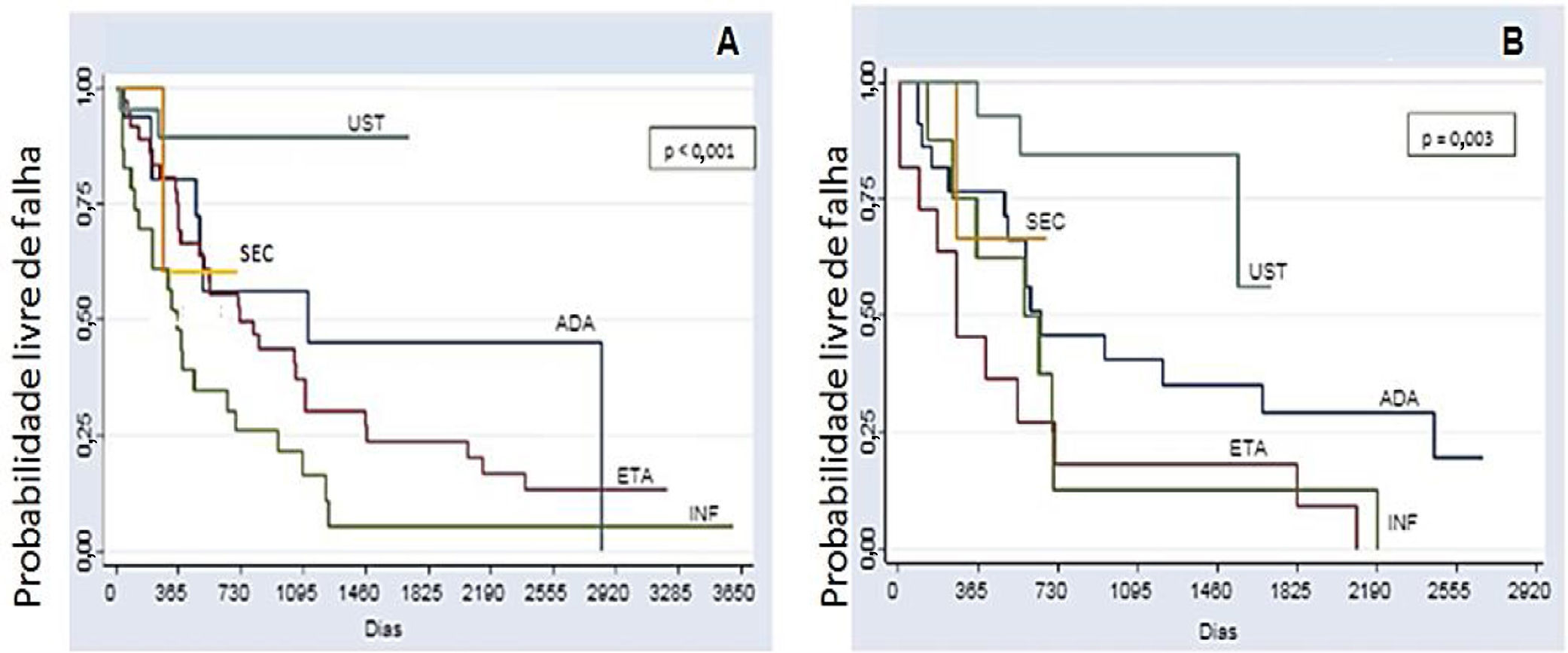
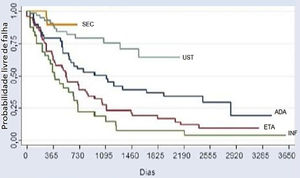
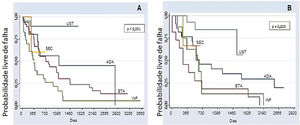
A análise comparativa entre os cinco imunobiológicos evidenciou o SEC como o medicamento de maior tempo de sobrevida, incluindo 22 (9,6%) tratamentos, seguido do UST com 64 (28%), ADA com 52 (22,7%), ETA com 56 (24,4%) e INF com 35 (15,3%) tratamentos (fig. 1). Casos de segunda linha apresentaram menor sobrevida da droga em comparação aos de primeira linha, casos de terceira linha apresentaram menor sobrevida em comparação aos de segunda linha, e assim sucessivamente. Análises isoladas quanto aos fármacos de primeira e segunda linha, evidenciaram curvas de Kaplan‐Meier demonstrando o UST com maior probabilidade de sobrevida da droga, com menos falhas. O INF mostrou menor probabilidade de sobrevida da droga em dois anos, com mais falhas. Essas diferenças mostraram‐se estatisticamente significativas (fig. 2).
Curva de Kaplan‐Meier de todos os tratamentos (p <0,001). Este gráfico espelha um melhor desempenho do secuquinumabe, seguido do ustequinumabe (segundo lugar), do adalimumabe (terceiro lugar), do etanercepte (quarto lugar) e do infliximabe (quinto lugar) no período de 2 anos (730 dias). Por meio da análise dos prontuários, foi possível avaliar a sobrevida de alguns imunobiológicos pelo período de até 10 anos (3650 dias).
Curvas de Kaplan‐Meier para os tratamentos. (A), Primeira linha (naïve) (p <0,001); (B), Segunda linha (p=0,003) em dois anos (730 dias). Nos grupos de primeira e segunda linha, o ustequinumabe apresenta maior probabilidade de sobrevida da droga em dois anos: 89,2% e 83,3% respectivamente. O infliximabe mostra menor probabilidade de sobrevida da droga em dois anos nos grupos de primeira e segunda linha (26,1% e 12,5%, respectivamente), com mais falhas). Por meio da análise dos prontuários foi possível avaliar a sobrevida de alguns imunobiológicos pelo período de até 10 anos (3650 dias). UST, ustequinumabe; SEC, secuquinumabe; ADA, adalimumabe; ETA, etanercepte;INF, infliximabe.
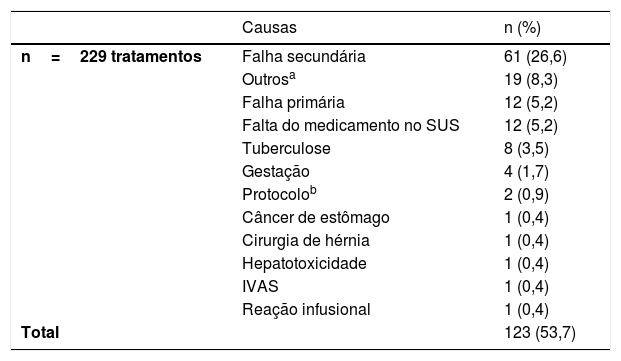
Entre os fatores que levaram à interrupção do tratamento, presente em 95 (41,5%) de um total de 229 tratamentos, a causa mais frequente de interrupção temporária foi a falta de fornecimento da medicação, presente em 76 (33,2%) dos casos analisados (tabela 1). Já entre as causas de interrupção definitiva, observada em 123 (49,6%) de um total de 229 tratamentos, a principal foi a falha secundária ao tratamento, observada em 26,6% dos casos analisados (tabela 2). De modo geral, a falha primária foi considerada quando o paciente não apresentou resposta PASI50 após 24 semanas de tratamento, e ocorreu em 5,2% dos casos. Ao analisar os resultados, deve‐se considerar o pequeno número de casos tratados com SEC, medicamento aprovado no Brasil apenas em 2016. Da mesma maneira, dados de imunobiológicos mais recentemente aprovados, como CP, IXE, GUS e RISA, não constam dos resultados deste trabalho.
Distribuição dos motivos de interrupção temporária dos tratamentos
| Causas | n (%) | |
|---|---|---|
| n=229 tratamentos | Falta do medicamento no SUS | 76 (33,2) |
| Outrosa | 9 (3,9) | |
| Gestação | 3 (1,3) | |
| Perda de seguimento | 3 (1,3) | |
| Cirurgia | 2 (0,9) | |
| IVAS de repetição | 2 (0,9) | |
| Total | 95 (41,5) |
SUS, Sistema Único de Saúde; IVAS, infecção de vias aéreas superiores.
Causas de interrupção definitiva dos tratamentos
| Causas | n (%) | |
|---|---|---|
| n=229 tratamentos | Falha secundária | 61 (26,6) |
| Outrosa | 19 (8,3) | |
| Falha primária | 12 (5,2) | |
| Falta do medicamento no SUS | 12 (5,2) | |
| Tuberculose | 8 (3,5) | |
| Gestação | 4 (1,7) | |
| Protocolob | 2 (0,9) | |
| Câncer de estômago | 1 (0,4) | |
| Cirurgia de hérnia | 1 (0,4) | |
| Hepatotoxicidade | 1 (0,4) | |
| IVAS | 1 (0,4) | |
| Reação infusional | 1 (0,4) | |
| Total | 123 (53,7) |
SUS, Sistema Único de Saúde; IVAS, infecção de vias aéreas superiores.
De acordo com a literatura, uma das principais causas para a descontinuação de um imunobiológico é a perda de eficácia, também chamada de falha secundária.4,5 Nossos resultados demonstram de maneira inédita que a falha no fornecimento da medicação foi o principal motivo de interrupção temporária dos tratamentos. Destaca‐se que, ao retornar ao tratamento imunobiológico após uma interrupção prolongada, a chance de menor resposta deve sempre ser considerada.6,7 Tais fatos reforçam a importância e a necessidade de fornecimento contínuo e regular desses tratamentos pelos provedores.
A ocorrência da tuberculose levando à descontinuação do tratamento foi exclusiva dos anti‐TNFs, assim como os poucos casos de reação infusional, IVAS, hepatotoxicidade e câncer. A falta do medicamento no SUS, levando à interrupção definitiva da terapia, foi mais frequente com UST e SEC. Em relação à principal causa de descontinuação, falha secundária ocorreu com todos os imunobiológicos, variando apenas o tempo da ocorrência da mesma.
Os resultados aqui apresentados proporcionam uma análise regional do tempo de sobrevida dos imunobiológicos e dos principais motivos para descontinuação dos tratamentos em uma instituição pública, e pode auxiliar no planejamento e monitorização dos tratamentos imunobiológicos tanto por parte de médicos prescritores quanto dos gestores de saúde.
Suporte financeiroNenhum.
Contribuição dos autoresCynthia Cristina Ferreira Mota: Terminologia, conceitualização, metodologia, investigação, recursos, curadoria de dados, redação da versão original, visualização, administração do projeto.
Ricardo Romiti: Metodologia, investigação, revisão e edição do manuscrito, supervisão.
Marcelo Arnone: Investigação.
Andre Luís da Silva Hirayama: Investigação.
Maria Denise Fonseca Takahashi: Investigação.
Conflito de interessesNenhum.
Como citar este artigo: Mota CCF, Romiti R, Arnone M, Hirayama ALS, Takahashi MDF. Therapeutic response and survival time of immunobiologicals in patients with moderate to severe psoriasis. An Bras Dermatol. 2022;97:112–5.
Trabalho realizado no Hospital das Clínicas da Universidade de São Paulo, São Paulo, SP, Brasil.