A varicela é virose comum na infância que usualmente evolui de maneira benigna; no entanto, em crianças imunossuprimidas, a evolução pode ser grave. A vacinação pode prevenir sua ocorrência e, especialmente, o desenvolvimento de quadros graves e complicados. O metotrexato é opção terapêutica sistêmica para diversas doenças inflamatórias; sua ação imunossupressora expõe os usuários a maior suscetibilidade a infecções. Relatamos um caso de varicela grave em criança imunossuprimida por uso de metotrexato.
A varicela é virose comum na infância, caracterizada por erupção vesicular. Em indivíduos imunocompetentes, os sintomas em geral são leves a moderados, mas casos graves não complicados podem se apresentar, com mais de 1.000 lesões além de sintomas constitucionais graves.1 Complicações, incluindo envolvimento do sistema nervoso central, pneumonia, infecções bacterianas secundárias e morte são descritas,2 principalmente em pacientes imunocomprometidos.3 A vacinação pode prevenir sua ocorrência e, especialmente, o desenvolvimento de quadros graves e complicados.4
A psoríase é doença inflamatória crônica que traz importante comprometimento da qualidade de vida, exigindo tratamento efetivo. Até um terço dos quadros de psoríase se inicia na infância e, apesar de a maioria das crianças apresentar quadros moderados bem controlados com terapia tópica, até 20% dessas crianças necessitam terapia sistêmica.5
O metotrexato é opção de terapia sistêmica para diversas doenças inflamatórias, com bom custo‐benefício e disponível no Sistema Único de Saúde (SUS). Entretanto, sua ação imunossupressora expõe os usuários a maior suscetibilidade a infecções.6 A avaliação pré‐metotrexato compreende: hemograma, dosagem da glicose, enzimas hepáticas e renais, sorologias para hepatite B e C, vírus da imunodeficiência humana (HIV) e radiografia de tórax.7 Esse rastreio contempla as principais contraindicações da medicação, como imunodeficiência, presença de infecção ativa, alterações hematológicas, renais e hepáticas.7 Entretanto, a atualização do cartão vacinal não faz parte da rotina para início do metotrexato.
O presente relato de caso visa chamar atenção para o aumento da suscetibilidade e da gravidade de infecções oportunistas em crianças imunossuprimidas, além de alertar para a necessidade de atualização do cartão vacinal em indivíduos sob terapia imunossupressora.
Relato do casoCriança do sexo feminino, 12 anos, portadora de psoríase eritrodérmica há dois anos, controlada com metotrexato 15 mg/semana, iniciado há um ano e cinco meses. Com o controle do quadro, estava com programação de retirada da medicação, quando retornou referindo surgimento de vesículas e bolhas dolorosas no colo havia cinco dias, que evoluíram, havia um dia, com disseminação progressiva para membros superiores, tronco, face e mucosa oral, levando a dificuldade na deglutição. A mãe referia febre não aferida ao longo do período.
A paciente apresentava rinite alérgica como antecedente pessoal; negava episódios de varicela e referia contato com criança com lesões ativas de varicela. Ao avaliar o cartão vacinal da paciente, não foi identificada vacinação prévia para esta enfermidade.
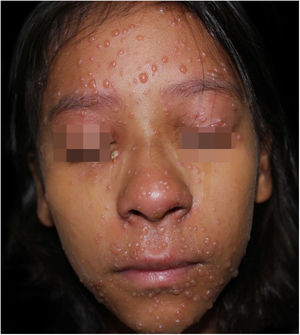
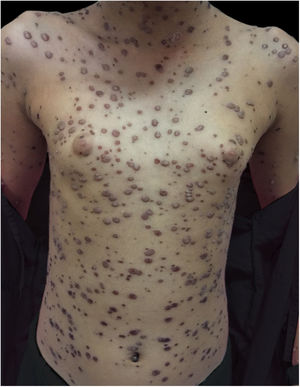
Ao exame físico, estava em regular estado geral, hipoativa, com temperatura de 39,8°C, com numerosas vesículas e bolhas tensas e confluentes na face, mucosa oral, região cervical, tronco e membros superiores, mais esparsas nos membros inferiores, onde algumas tinham conteúdo hemático (fig. 1). Apresentava placas esbranquiçadas em toda a cavidade oral.
Com a hipótese de varicela, a paciente foi prontamente internada; realizou‐se biópsia para comprovação histopatológica. Foram suspensas as medicações de uso domiciliar e iniciou‐se terapêutica com aciclovir 10 mg/kg/dia endovenoso, nistatina oral, além de banho com permanganato de potássio (1:4 L). O anatomopatológico confirmou o diagnóstico de varicela.
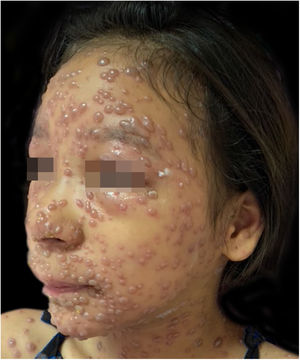
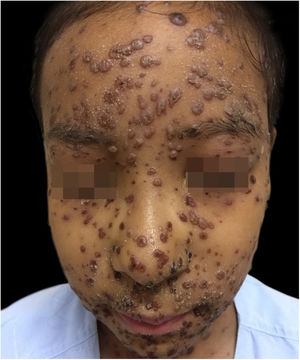
Durante a internação, a criança evoluiu com disseminação das lesões que ultrapassaram 1.000 unidades, celulite periorbitária e neutropenia febril; foi prescrito cefepima (fig. 2). Foi também iniciado ácido folínico para minorar os efeitos do metotrexato, e dexclorfeniramina para queixa de prurido. Após seis dias de internação, a febre cessou e as lesões começaram a regredir; foi iniciada combinação de ácido hipocloroso com silicone para melhor cicatrização (figs. 3 e 4).
Após 10 dias de uso de aciclovir endovenoso, a paciente recebeu alta, com a maioria das lesões cutâneas apresentando crosta. Ela recebeu orientação de manter suspenso o metotrexato, usar cefalexina por mais cinco dias, bem como manter ácido hipocloroso com silicone e banhos com permanganato de potássio.
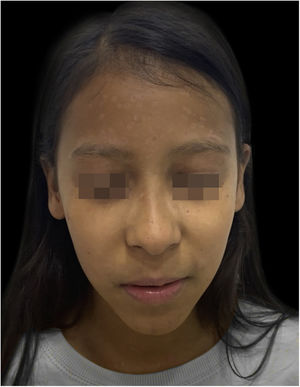
Apesar da gravidade do quadro inicial, a paciente evoluiu bem, com ótima cicatrização das lesões (fig. 5).
DiscussãoA paciente, portadora de psoríase eritrodérmica e em uso de metotrexato havia um ano e cinco meses, sem vacinação prévia para varicela, desenvolveu uma forma grave dessa doença. Durante a evolução, ocorreram duas importantes complicações: celulite periorbitária e neutropenia febril. O caso ilustra como infecções em indivíduos imunossuprimidos rapidamente podem evoluir com complicações graves.
Há recomendações bem estabelecidas quanto à vacinação em crianças com doenças reumatológicas em uso de imunossupressores.8 Recomenda‐se, de modo geral, manter o calendário nacional de vacinação. Os dados de crianças em uso de metotrexato que receberam vacinas de vírus vivo atenuado são tranquilizadores tanto sobre a segurança quanto a resposta imunológica à vacina.6,9 Há estudos que mencionam especificamente o metotrexato e a vacina da varicela: se no rastreio para o início do metotrexato houver uma criança não imune à varicela, recomenda‐se administrar a vacina e aguardar de duas a quatro semanas para iniciar a medicação.8 Entretanto, os dados na literatura são escassos quando se trata de doenças dermatológicas.
Não há, no Brasil, recomendação clara sobre como proceder a respeito da vacinação com vírus vivo atenuado em crianças portadoras de psoríase em uso de metotrexato,10 e não faz parte da rotina atualizar o cartão vacinal antes de iniciar o uso da medicação. No contexto brasileiro, essa questão torna‐se ainda mais relevante em razão do histórico da vacina da varicela, que só foi incluída no calendário nacional de vacinação do SUS em 2012, para crianças de 15 meses – portanto, há um grande contingente da população sem imunidade específica contra o vírus varicela‐zóster.
Diante do caso exposto e de sua gravidade, alertamos para a necessidade de considerar o status de vacinação antes do início do tratamento com metotrexato. Para crianças não imunes e já em tratamento, avaliar o grau de imunocomprometimento e o risco epidemiológico pode orientar a tomada de decisão.
Suporte financeiroNenhum.
Contribuição dos autoresLetícia Oba Galvão: Participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado; elaboração e redação do manuscrito; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Carmelia Matos Santiago Reis: Participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica do caso estudado; concepção e planejamento do estudo; revisão crítica do manuscrito.
Natália Lima Alves: Obtenção, análise e interpretação dos dados; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Elisa Scandiuzzi Maciel: Obtenção, análise e interpretação dos dados; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Galvão LO, Reis CMS, Alves NL, Maciel ES. Severe varicella in a child immunosuppressed with methotrexate. An Bras Dermatol. 2022;97:184–8.
Trabalho realizado no Serviço de Dermatologia do Hospital Regional da Asa Norte, Brasília, DF, Brasil.