Avaliar os efeitos da rosácea nas alterações da superfície ocular, como alterações nos parâmetros de olho seco, densitometria da córnea e aberrações, e compará‐los com controles saudáveis.
MétodosUm total de 88 olhos de 44 pacientes com diagnóstico de rosácea e 88 olhos de 44 controles saudáveis foram incluídos neste estudo transversal. Todos os participantes foram submetidos a exame dermatológico e oftalmológico abrangente e foram realizados testes Tear Break‐Up Time (TBUT) e Schirmer‐1. O subtipo de rosácea e a contagem de Demodex e o escore Ocular Surface Disease Index (OSDI) de todos os participantes foram registrados. Medidas topográficas, densitométricas e aberrométricas da córnea foram obtidas utilizando o sistema de imagens Scheimpflug.
ResultadosA média de idade dos 44 pacientes foi de 41,2±11,0 anos; 31 (70,5%) eram do gênero feminino. Os valores médios dos testes TBUT e Schirmer‐1 diminuíram significantemente e os escores OSDI aumentaram significantemente no grupo com rosácea em comparação com controles saudáveis (p<0,01 para todos). O subtipo mais comum de rosácea foi a rosácea eritemato‐telangiectásica (70,4%). A classificação da gravidade da rosácea revelou que 18 (40,9%) pacientes apresentavam eritema moderado. A contagem média de Demodex foi de 24,3±26,0, e a duração da doença foi de 53,1±71,6 meses. A comparação dos valores da densitometria corneana revelou que as medidas densitométricas em todas as zonas concêntricas, especialmente nas zonas central e posterior, foram maiores em pacientes com rosácea. Os valores aberrométricos da córnea na superfície posterior também foram menores no grupo com rosácea em comparação aos controles saudáveis. Os valores topográficos da câmara anterior foram significantemente menores no grupo com rosácea.
Limitações do estudoO tamanho relativamente pequeno da amostra, o intervalo de tempo variável até o atendimento hospitalar e a falta de dados de seguimento estão entre as limitações do estudo. Estudos futuros com amostras maiores também podem esclarecer os mecanismos dos achados controversos do segmento anterior, avaliando pacientes com rosácea que têm uveíte e que não têm.
ConclusãoDado que os sinais oculares podem preceder a doença cutânea, a rosácea é frequentemente sub‐reconhecida pelos oftalmologistas. Portanto, um exame abrangente da superfície ocular e avaliação do segmento anterior são essenciais. A principal prioridade do oftalmologista é tratar a disfunção da glândula meibomiana e a infecção por Demodex para evitar resultados oculares indesejados.
A rosácea é doença crônica progressiva que causa inflamação na pele e na superfície ocular com curso recidivante e remitente.1 A classificação da rosácea consiste em quatro subtipos (eritemato‐telangiectásica, papulopustular, fimatosa e ocular) e uma variante (granulomatosa) em relação às características primárias e secundárias descritas pelo National Rosacea Society Expert Committee on the Classification and Staging of Rosacea.2 A doença é geralmente observada na população de meia‐idade, com leve predominância no gênero feminino e tem origem desconhecida; entretanto, o sistema imunológico inato, disbiose ou variações no microbioma, incluindo infestação por Demodex, podem desempenhar papel na resposta inflamatória cutânea.3–5 A doença é considerada uma das condições inflamatórias crônicas mais conhecidas da pele, e o envolvimento ocular pode estar presente em 58%–72% dos pacientes, causando inflamação das pálpebras e da superfície ocular.6 No entanto, a rosácea ocular grave geralmente é subestimada, apesar de causar perda de visão quando não tratada ou tratada de maneira inadequada.7
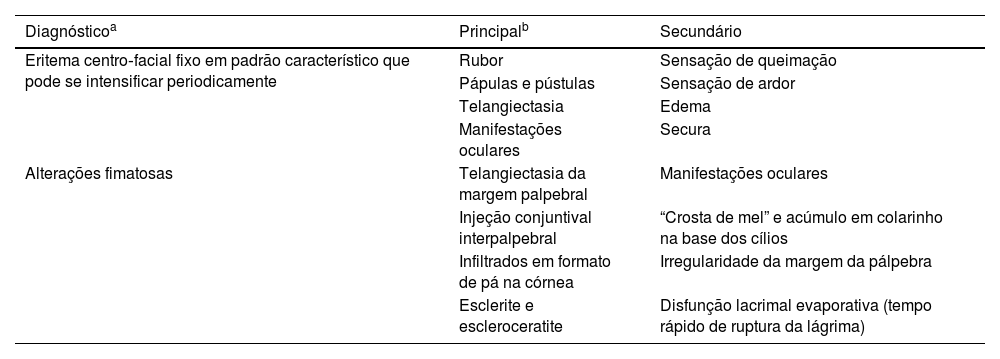
As manifestações oculares da rosácea são decorrentes de inflamação ocular externa crônica e frequentemente ignoradas pelos oftalmologistas; podem ocorrer na presença de lesões cutâneas graves, leves ou até mesmo ausentes.7 O envolvimento ocular é bilateral e comumente afeta pálpebras, conjuntiva e córnea. Blefarite, disfunção da glândula meibomiana, doença do olho seco (DOS), hordéolo/calázio recorrente e telangiectasias da margem palpebral são as manifestações oculares predominantes.8 Hiperemia difusa com congestão acentuada dos vasos conjuntivais bulbares no espaço interpalpebral é comum, e a conjuntivite crônica pode levar à formação de cicatrizes na conjuntiva. A presença de ceratite pontilhada superficial, que é tipicamente observada no terço inferior da córnea, neovascularização, infiltrados, flictênulas, edema, pannus periférico, adelgaçamento e ulceração da córnea estão entre os achados corneanos da doença.9 Além disso, estudos anteriores relataram alterações biomecânicas decorrentes do aumento da atividade proteolítica e inflamação na superfície ocular.10 Episclerite, esclerite e uveíte anterior também foram relatadas anteriormente.11 As características diagnósticas, principais e secundárias, da rosácea são apresentadas na tabela 1.
Critérios diagnósticos para rosácea
| Diagnósticoa | Principalb | Secundário |
|---|---|---|
| Eritema centro‐facial fixo em padrão característico que pode se intensificar periodicamente | Rubor | Sensação de queimação |
| Pápulas e pústulas | Sensação de ardor | |
| Telangiectasia | Edema | |
| Manifestações oculares | Secura | |
| Alterações fimatosas | Telangiectasia da margem palpebral | Manifestações oculares |
| Injeção conjuntival interpalpebral | “Crosta de mel” e acúmulo em colarinho na base dos cílios | |
| Infiltrados em formato de pá na córnea | Irregularidade da margem da pálpebra | |
| Esclerite e escleroceratite | Disfunção lacrimal evaporativa (tempo rápido de ruptura da lágrima) |
O sistema de imagens de Scheimpflug e a densitometria são técnicas que permitem avaliação adicional do segmento anterior, incluindo clareza da córnea e dispersão de luz.12 Vários fatores, incluindo aberrações ópticas, difração e dispersão de luz, limitam a qualidade óptica do olho humano.13 A dispersão reversa da luz indica a saúde óptica da córnea em relação a sua transparência e clareza e, portanto, pode ser considerada indicador substancial e conveniente na análise de inúmeras doenças da córnea com repetibilidade e reprodutibilidade.14 Alterações na densitometria corneana e na aberrometria em pacientes com olho seco foram apontadas em estudos anteriores.15–17O objetivo deste estudo foi avaliar os efeitos da rosácea nas alterações da superfície ocular, como alterações nos parâmetros do olho seco, densitometria da córnea e aberrações, em comparação com controles saudáveis.
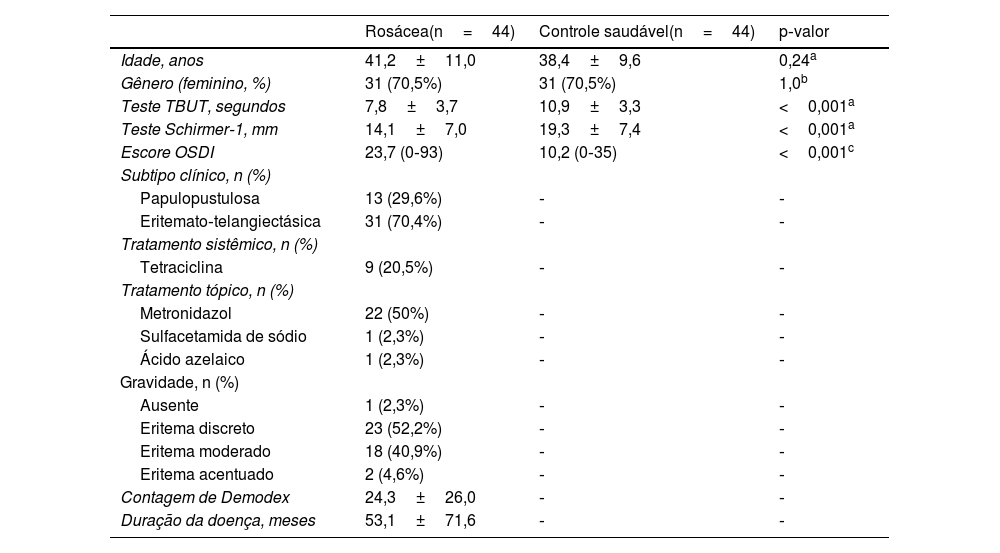
MétodosUm total de 88 olhos de 44 pacientes com diagnóstico de rosácea e 88 olhos de 44 controles saudáveis foram incluídos neste estudo transversal. O grupo controle, composto por participantes saudáveis, sem doenças sistêmicas, foi pareado ao grupo com rosácea por idade e gênero. O estudo foi aprovado pelo Comitê de Ética local e seguiu os princípios descritos na Declaração de Helsinque. O consentimento informado por escrito foi obtido de todos os pacientes. Os participantes que tinham histórico de doenças sistêmicas e autoimunes, intervenções cirúrgicas oculares e doenças oculares como glaucoma, distúrbios ectáticos da córnea, uveíte ou retinopatia foram excluídos do estudo. História de trauma, uso de lentes de contato ou medicação ocular tópica, presença de cicatrizes na córnea, opacidades e degenerações conjuntivais como pterígio também foram estabelecidos como critérios de exclusão. O diagnóstico e a classificação da rosácea foram feitos pelo mesmo dermatologista (MT), que também avaliou a presença de demodecidose. A classificação da rosácea foi realizada de acordo com as diretrizes descritas pelo National Rosacea Society Expert Committee on the Classification and Staging of Rosácea. A avaliação global dos pacientes foi graduada em ausente, discreta, moderada ou acentuada (0‐4), como demonstrado na tabela 2.
Dados demográficos e parâmetros de olho seco da população estudada
| Rosácea(n=44) | Controle saudável(n=44) | p‐valor | |
|---|---|---|---|
| Idade, anos | 41,2±11,0 | 38,4±9,6 | 0,24a |
| Gênero (feminino, %) | 31 (70,5%) | 31 (70,5%) | 1,0b |
| Teste TBUT, segundos | 7,8±3,7 | 10,9±3,3 | <0,001a |
| Teste Schirmer‐1, mm | 14,1±7,0 | 19,3±7,4 | <0,001a |
| Escore OSDI | 23,7 (0‐93) | 10,2 (0‐35) | <0,001c |
| Subtipo clínico, n (%) | |||
| Papulopustulosa | 13 (29,6%) | ‐ | ‐ |
| Eritemato‐telangiectásica | 31 (70,4%) | ‐ | ‐ |
| Tratamento sistêmico, n (%) | |||
| Tetraciclina | 9 (20,5%) | ‐ | ‐ |
| Tratamento tópico, n (%) | |||
| Metronidazol | 22 (50%) | ‐ | ‐ |
| Sulfacetamida de sódio | 1 (2,3%) | ‐ | ‐ |
| Ácido azelaico | 1 (2,3%) | ‐ | ‐ |
| Gravidade, n (%) | |||
| Ausente | 1 (2,3%) | ‐ | ‐ |
| Eritema discreto | 23 (52,2%) | ‐ | ‐ |
| Eritema moderado | 18 (40,9%) | ‐ | ‐ |
| Eritema acentuado | 2 (4,6%) | ‐ | ‐ |
| Contagem de Demodex | 24,3±26,0 | ‐ | ‐ |
| Duração da doença, meses | 53,1±71,6 | ‐ | ‐ |
Foi realizado exame oftalmológico abrangente, incluindo melhor acuidade visual corrigida (BCVA, do inglês best‐corrected visual acuity) utilizando o gráfico de Snellen, medida da pressão intraocular usando um tonômetro de sopro de ar, biomicroscopia com lâmpada de fenda para observar doenças da córnea e exame fundoscópico detalhado. Os escores Ocular Surface Disease Index (OSDI) de todos os participantes foram registrados. A superfície ocular foi avaliada com o teste Tear Break‐Up Time (TBUT) e o teste Schirmer‐1, realizados pelo mesmo médico experiente que desconhecia o diagnóstico e o objetivo do estudo. O teste Schirmer‐1 foi realizado sem anestesia utilizando uma tira de papel filtro pré‐calibrada (Schirmer Tear Test Strips, ERC Sağlık, Ancara, Turquia) que é colocada em um terço da porção lateral da pálpebra inferior, solicitando aos pacientes que fechassem suavemente os olhos sem apertá‐los por 5 minutos. O papel era então removido e a quantidade de umidade era registrada em milímetros. O teste TBUT foi medido utilizando uma tira de papel de fluoresceína (Fluorescein Sodium Strips, ERC Sağlık, Ancara, Turquia) umedecida com solução salina e depois aplicada na conjuntiva bulbar inferior. Os pacientes foram solicitados a piscar de três a cinco vezes para formar um filme sobre a superfície da córnea, e depois não piscar enquanto o filme lacrimal era observado sob amplo feixe de iluminação azul cobalto. O TBUT foi registrado como os segundos decorridos entre a última piscada completa e o aparecimento da primeira mancha seca no filme lacrimal. A média de três medidas consecutivas foi registrada para ambos os testes.13
As medidas topográficas, densitométricas e aberrométricas da córnea foram realizadas utilizando o sistema de imagens Scheimpflug (Pentacam HR, Oculus GmbH, Wetzlar, Alemanha). Esse sistema de imagens fornece um modelo tridimensional do segmento anterior que consiste em mapas de elevação da córnea, cálculos de potência e avaliação paquimétrica e biométrica do segmento anterior usando uma câmera Scheimpflug rotativa de 180° e uma câmera estática com fonte de luz de fenda monocromática. De acordo com o manual do dispositivo, varreduras mais bem alinhadas e fixadas com exame de especificação de qualidade “OK” foram incluídas para análise após três varreduras consecutivas para cada olho. Valores ceratométricos (K1, K2, Kmáx), espessura mais fina da córnea (EC), volume da córnea (VC), volume da câmara anterior (VCA), profundidade da câmara anterior (PCA), ângulo da câmara anterior (ACA), medidas aberrométricas da córnea incluindo a raiz quadrada média (RQM) de aberrações totais (RQM‐total), RQM de aberrações de ordem superior (RQM‐AOR), RQM de aberrações de ordem inferior (RQM‐AOI) e aberrações esféricas (AE) foram calculadas a partir da zona óptica central de 6mm com o software integrado v1.25r15da Pentacam. A densitometria da córnea foi medida automaticamente com o software de análise integrado fornecido com o Pentacam HR em quatro zonas concêntricas ao longo de um diâmetro corneano de 12mm. A primeira zona consiste em uma área circular com diâmetro de 2mm no centro da córnea, e a segunda, terceira e quarta zonas são áreas anulares circundando o centro de 2 a 6mm, 6 a 10mm e 10 a 12mm, respectivamente. Essa análise também fornece valores densitométricos da córnea em três profundidades diferentes: as camadas corneanas anterior (superficial 120μm), central (subtração da espessura da camada anterior e posterior do total) e posterior (60μm da córnea mais interna). Os valores de densitometria da córnea são expressos como a luminância do pixel por unidade de volume na imagem de Scheimpflug e são expressos em unidades de escala de cinza (GSU, do inglês grayscale units). A retrodifusão da luz da córnea varia de zero GSU, o que significa que não há embaçamento na córnea, até 100 GSU, definido como uma córnea completamente opaca.18 Todas as medidas da córnea foram realizadas no mesmo dia, sob as mesmas condições ambientais, na mesma sala com pouca iluminação, e com luz, temperatura, umidade e fluxo de ar constantes para evitar possível estresse ocular. Os testes Schirmer‐1 e TBUT foram realizados após as medidas com FC Pentacam.
Análise estatísticaAs análises foram realizadas utilizando o software SPSS versão 20.0, Armonk, NY: IBM Corp.) para Windows. O teste de Shapiro‐Wilk foi utilizado para verificar a normalidade das variáveis. A média±desvio padrão foi fornecida para variáveis com distribuição normal, e a mediana (mín‐máx) foi fornecida para variáveis que não tinham distribuição normal. O teste Qui‐Quadrado foi utilizado para comparação das variáveis categóricas. O teste t de Student ou teste U de Mann‐Whitney foi utilizado para comparar variáveis contínuas de acordo com a distribuição dos dados. Um valor de p<0,05 foi considerado estatisticamente significante.
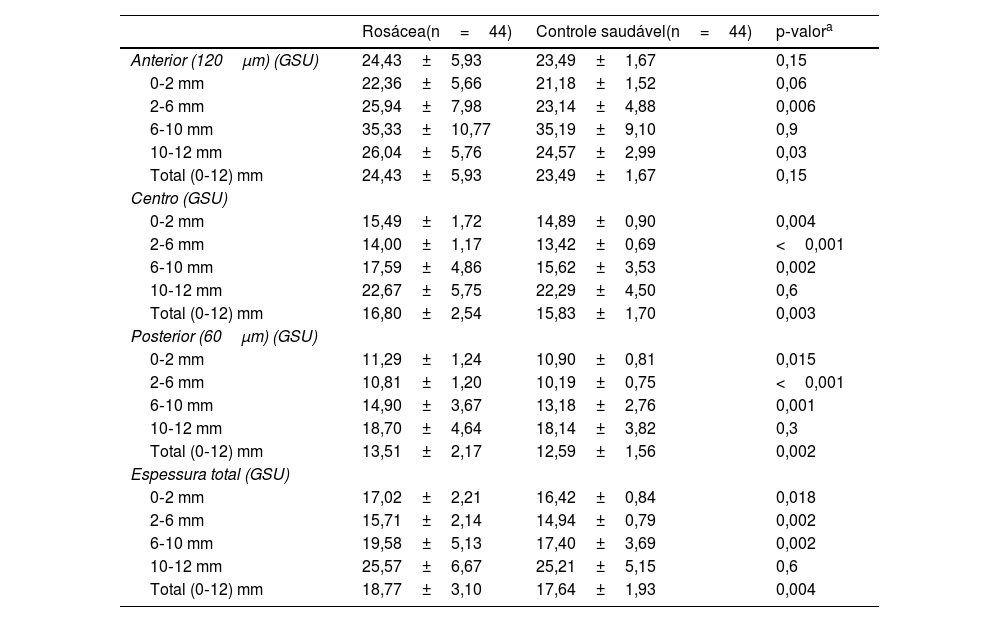
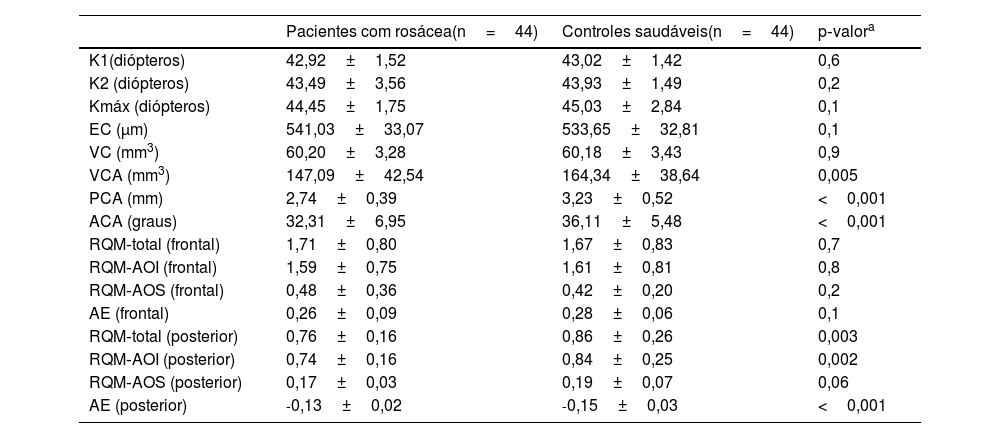
ResultadosA média de idade dos 44 pacientes foi de 41,2±11,0 anos; 31 (70,5%) pacientes eram do gênero feminino. As distribuições quanto à idade e gênero foram semelhantes entre os grupos (p>0,05 para ambos). Os valores médios dos testes TBUT e Schirmer‐1 diminuíram significantemente e os escores OSDI aumentaram significantemente no grupo com rosácea em comparação com controles saudáveis (p<0,01 para todos). O subtipo mais comum de rosácea foi a rosácea eritemato‐telangiectásica (70,4%). A classificação da gravidade da rosácea revelou que 18 (40,9%) pacientes apresentavam eritema moderado. Metade do grupo com rosácea estava em uso tópico de pomada de metronidazol, e nove (20,5%) pacientes estavam em uso de tetraciclina oral. Apenas quatro pacientes (9,1%) faziam uso de protetor solar. A contagem média de Demodex foi de 24,3±26,0, e a duração da doença foi de 53,1±71,6 meses. Os dados demográficos, as características dos pacientes e as modalidades de tratamento estão resumidos na tabela 2. A BCVA foi 20/20 em ambos os grupos. A EC média foi 541,0±33,0 nos olhos afetados e 533,6±32,8 nos olhos saudáveis, e não foi estatisticamente significante (p=0,139). A comparação dos valores da densitometria corneana revelou que as medidas densitométricas em todas as zonas concêntricas, principalmente nas zonas central e posterior, foram maiores nos pacientes com rosácea (tabela 3). Os valores aberrométricos da córnea na superfície posterior também foram menores no grupo com rosácea em comparação aos controles saudáveis (tabela 4). Os valores de VCA, PCA e ACA foram significantemente menores na população do estudo.
Medidas de densitometria da córnea da população estudada
| Rosácea(n=44) | Controle saudável(n=44) | p‐valora | |
|---|---|---|---|
| Anterior (120μm) (GSU) | 24,43±5,93 | 23,49±1,67 | 0,15 |
| 0‐2 mm | 22,36±5,66 | 21,18±1,52 | 0,06 |
| 2‐6 mm | 25,94±7,98 | 23,14±4,88 | 0,006 |
| 6‐10 mm | 35,33±10,77 | 35,19±9,10 | 0,9 |
| 10‐12 mm | 26,04±5,76 | 24,57±2,99 | 0,03 |
| Total (0‐12) mm | 24,43±5,93 | 23,49±1,67 | 0,15 |
| Centro (GSU) | |||
| 0‐2 mm | 15,49±1,72 | 14,89±0,90 | 0,004 |
| 2‐6 mm | 14,00±1,17 | 13,42±0,69 | <0,001 |
| 6‐10 mm | 17,59±4,86 | 15,62±3,53 | 0,002 |
| 10‐12 mm | 22,67±5,75 | 22,29±4,50 | 0,6 |
| Total (0‐12) mm | 16,80±2,54 | 15,83±1,70 | 0,003 |
| Posterior (60μm) (GSU) | |||
| 0‐2 mm | 11,29±1,24 | 10,90±0,81 | 0,015 |
| 2‐6 mm | 10,81±1,20 | 10,19±0,75 | <0,001 |
| 6‐10 mm | 14,90±3,67 | 13,18±2,76 | 0,001 |
| 10‐12 mm | 18,70±4,64 | 18,14±3,82 | 0,3 |
| Total (0‐12) mm | 13,51±2,17 | 12,59±1,56 | 0,002 |
| Espessura total (GSU) | |||
| 0‐2 mm | 17,02±2,21 | 16,42±0,84 | 0,018 |
| 2‐6 mm | 15,71±2,14 | 14,94±0,79 | 0,002 |
| 6‐10 mm | 19,58±5,13 | 17,40±3,69 | 0,002 |
| 10‐12 mm | 25,57±6,67 | 25,21±5,15 | 0,6 |
| Total (0‐12) mm | 18,77±3,10 | 17,64±1,93 | 0,004 |
Comparação dos valores topográficos, aberrométricos da córnea e parâmetros do segmento anterior da população estudada
| Pacientes com rosácea(n=44) | Controles saudáveis(n=44) | p‐valora | |
|---|---|---|---|
| K1(diópteros) | 42,92±1,52 | 43,02±1,42 | 0,6 |
| K2 (diópteros) | 43,49±3,56 | 43,93±1,49 | 0,2 |
| Kmáx (diópteros) | 44,45±1,75 | 45,03±2,84 | 0,1 |
| EC (μm) | 541,03±33,07 | 533,65±32,81 | 0,1 |
| VC (mm3) | 60,20±3,28 | 60,18±3,43 | 0,9 |
| VCA (mm3) | 147,09±42,54 | 164,34±38,64 | 0,005 |
| PCA (mm) | 2,74±0,39 | 3,23±0,52 | <0,001 |
| ACA (graus) | 32,31±6,95 | 36,11±5,48 | <0,001 |
| RQM‐total (frontal) | 1,71±0,80 | 1,67±0,83 | 0,7 |
| RQM‐AOI (frontal) | 1,59±0,75 | 1,61±0,81 | 0,8 |
| RQM‐AOS (frontal) | 0,48±0,36 | 0,42±0,20 | 0,2 |
| AE (frontal) | 0,26±0,09 | 0,28±0,06 | 0,1 |
| RQM‐total (posterior) | 0,76±0,16 | 0,86±0,26 | 0,003 |
| RQM‐AOI (posterior) | 0,74±0,16 | 0,84±0,25 | 0,002 |
| RQM‐AOS (posterior) | 0,17±0,03 | 0,19±0,07 | 0,06 |
| AE (posterior) | ‐0,13±0,02 | ‐0,15±0,03 | <0,001 |
Teste t de amostra independente.
K1, valor da ceratometria plana; K2, valor da ceratometria íngreme; Kmáx, valor máximo da ceratometria; EC, espessura corneana mais fina; VC, volume corneano; VCA, volume da câmara anterior; PCA, profundidade da câmara anterior; ACA, ângulo da câmara anterior; RQM, raiz quadrada média; AOI, aberrações da ordem inferior; AOS, aberrações de ordem superior; AE, aberrações esféricas.
Neste estudo prospectivo atual, foram avaliados os efeitos das alterações da superfície ocular, tais como alterações nos parâmetros do olho seco, propriedades do segmento anterior, densitometria da córnea e aberrações que podem surgir em decorrência da rosácea. Os resultados do estudo demonstraram diminuição nos escores dos testes TBUT e Schirmer‐1 e aumento nos escores OSDI em pacientes com rosácea. Os valores de VCA, PCA e ACA foram significantemente menores na população estudada. A comparação dos valores de densitometria corneana revelou que as medidas de densitometria em todas as zonas concêntricas, especialmente nas zonas central e posterior, foram maiores, e os valores aberrométricos corneanos na superfície posterior da córnea foram menores no grupo com rosácea em comparação aos controles saudáveis.
A etiologia da rosácea ainda é desconhecida; porém, sistema imunológico hiperativo, hereditariedade, fatores ambientais, microrganismos como Demodex folliculorum e Helicobacter pylori ou uma combinação desses fatores estão entre as diversas hipóteses citadas na literatura. Rosácea é dermatose inflamatória crônica que aparece predominantemente na região bucinadora, nariz, queixo e fronte, e é caracterizada por episódios recorrentes de rubor, eritema facial central transitório ou persistente, alterações fimatosas, pápulas, pústulas e telangiectasias.19 Em uma metanálise de Barakji et al. na qual mais de 9.000 pacientes foram avaliados quanto à frequência dos subtipos de rosácea, a maior proporção (57%) foi de rosácea eritemato‐telangiectásica.20 O subtipo mais comum também foi a rosácea eritemato‐telangiectásica (70,4%) na população do presente estudo. Cerca de um terço dos pacientes apresentam envolvimento ocular com potencial risco para a visão, causando graus variados de morbidade ocular.6 Em 2019, o painel ROSacea COnsensus (ROSCO) foi estabelecido para abordar o espectro da apresentação clínica a fim de melhorar o manejo do paciente.21 Estudos anteriores investigaram as manifestações oculares da rosácea que consistem em olho seco, blefarite, disfunção da glândula meibomiana e irritação ocular juntamente com propriedades da córnea, como histerese e fator de resistência da córnea.10,22,23
Os dois subtipos principais de DOS consistem em deficiência aquosa e evaporativa, associados à função reduzida da glândula lacrimal e acompanhados principalmente por disfunção da glândula meibomiana, respectivamente. Esses subtipos são considerados parte de um espectro, e não condições distintas, e coexistem como um continuum.24 Estudos anteriores relataram escores mais baixos nos testes TBUT e Schirmer‐1 em pacientes com rosácea.1,10 Níveis mais baixos de interleucina e VEGF também foram demonstrados em pacientes com rosácea, o que pode levar à inflamação na superfície ocular e, portanto, resultar em diminuição nos testes de função do filme lacrimal.25 No presente estudo, também observamos menores escores de TBUT e Schirmer‐1, em concordância com os estudos supracitados.
Em um estudo realizado por Cetin et al., a avaliação da morfologia da córnea e da câmara anterior em pacientes com inflamação intraocular não infecciosa não revelou alterações estatísticas na EC, PCA e VCA entre pacientes com uveíte ativa ou inativa e o grupo controle.26 Sabe‐se que a inflamação leva à obstrução do fluxo aquoso por meio do acúmulo de células inflamatórias no espaço intertrabecular, edema das lamelas trabeculares, fechamento do ângulo em decorrência de edema do corpo ciliar ou formação de cicatriz, ou crescimento excessivo da membrana no ângulo da câmara anterior.27 Também foi observada diminuição de VCA, PCA e ACA na população do presente estudo. Por outro lado, uma avaliação das propriedades da córnea em pacientes com artrite reumatoide (AR) não revelou diferença estatisticamente significante em termos de ceratometria, VC e PCA.16 Do mesmo modo, não foi observada diferença significante em relação aos valores de ceratometria (K1, K2 e Kmáx), EC e VC na população do presente estudo.
A densitometria corneana de Scheimpflug ganhou espaço recentemente em consequência da preferência por exames da córnea sem contato, que são fáceis de realizar, rápidos, repetíveis e não sujeitos a variações entre observadores. A densitometria da córnea fornece medidas quantitativas da clareza e transparência da córnea, tornando mais confiáveis o monitoramento de doenças e intervenções na córnea. As principais fontes de dispersão da luz da córnea são a camada epitelial e o endotélio da córnea. Que seja de conhecimento dos autores, este é o primeiro estudo que avaliou as alterações densitométricas e aberrométricas da córnea em pacientes com rosácea. Koh et al. relataram aumento da dispersão reversa da luz na córnea de pacientes com olho seco.15 Além disso, outro estudo demonstrou valores mais elevados de densitometria corneana em pacientes com AR em comparação com controles saudáveis.16 Além disso, um estudo de Cetin et al. conduzido em população pediátrica com doença inflamatória revelou maior densidade óptica da córnea em crianças com uveíte.28 Do mesmo modo, os valores de densitometria corneana na maioria das zonas concêntricas em todas as camadas foram maiores em comparação com o grupo controle no presente estudo. O sistema de imagens Pentacam Scheimpflug também calcula os coeficientes de Zernike da córnea anterior e posterior com base nos dados de elevação corneana. Em um estudo realizado por Yildirim et al., a RQM‐total, AOI, AOS e AE foram significantemente maiores em pacientes com olho seco, e os autores concluíram que lágrimas artificiais reduziram as aberrações corneanas anteriores.17 Os resultados do presente estudo mostraram resultados semelhantes em relação à RQM‐total, AOI e AOS.
O presente estudo tem suas limitações. O tamanho relativamente pequeno da amostra, o intervalo de tempo variável até o atendimento hospitalar e a falta de dados de seguimento estão entre as limitações do estudo. Embora nenhum dos pacientes apresentasse ceratite, conjuntivite ou uveíte, foram incluídos todos os pacientes com rosácea sem classificar quem tinha rosácea ocular e quem não tinha. Estudos futuros com amostras maiores também podem esclarecer os mecanismos dos achados controversos do segmento anterior, avaliando pacientes com rosácea que têm uveíte e os que não têm.
ConclusãoEste estudo mostra as manifestações oculares da rosácea, incluindo DOS, propriedades da córnea e alterações do segmento anterior. Considerando que os sinais oculares podem preceder a doença cutânea, a rosácea é frequentemente sub‐reconhecida pelos oftalmologistas. Portanto, exame abrangente da superfície ocular e avaliação do segmento anterior são essenciais. A principal prioridade do oftalmologista é tratar a disfunção da glândula meibomiana e a infecção por Demodex a fim de prevenir resultados oculares indesejados. O papel da inflamação na patogênese da rosácea pode ser melhor compreendido através de estudos clínicos prospectivos com amostras maiores.
Suporte financeiroNenhum.
Contribuição dos autoresErman Bozali: Aprovação da versão final do manuscrito, revisão crítica da literatura, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, elaboração e redação do manuscrito, concepção e planejamento do estudo.
Duygu Yalınbaş Yeter: Aprovação da versão final do manuscrito, revisão crítica da literatura, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica do manuscrito, elaboração e redação do manuscrito, análise estatística, concepção e planejamento do estudo.
Mustafa Tosun: Aprovação da versão final do manuscrito, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados, revisão crítica do manuscrito, elaboração e redação do manuscrito, análise estatística.
Anıl Selim Apa: Aprovação da versão final do manuscrito, obtenção, análise e interpretação dos dados, participação efetiva na orientação da pesquisa, participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Conflito de interessesNenhum.
Como citar este artigo: Bozali E, Yeter DY, Tosun M, Apa AS. Assessment by the Scheimpflug imaging system of corneal clarity and anterior segment properties in rosacea patients. An Bras Dermatol. 2024;99. https://doi.org/10.1016/j.abd.2023.07.005
Trabalho realizado nos Departamentos de Oftalmologia e Dermatologia, Cumhuriyet University Faculdade de Medicina, Sivas, Turquia.