Esta é uma revisão narrativa sobre a azatioprina. Esse medicamento é imunomodulador e imunossupressor, tendo sido amplamente utilizado em diferentes especialidades médicas. A azatioprina tem se mostrado útil em várias dermatoses e tem tido sucesso quando usada em indicação off‐label para outras doenças dermatológicas. Seu mecanismo de ação é descrito detalhadamente, bem como os cuidados para monitorar níveis adequados em pacientes que a utilizam. Os dermatologistas também devem estar cientes dos possíveis eventos adversos. Em dermatologia, a azatioprina pode ser utilizada em doenças bolhosas e autoimunes e em outros quadros, incluindo prurido intratável, dermatite atópica, fotodermatoses, psoríase e outras. A azatioprina é uma alternativa como agente poupador de esteroides; esta revisão ajuda os dermatologistas a prescrevê‐la com segurança para todos os pacientes que possam se beneficiar do seu uso.
A azatioprina foi usada pela primeira vez para prevenir a doença do enxerto contra o hospedeiro. Atualmente, ela é amplamente utilizada como imunomodulador, imunossupressor e agente poupador de esteroides.
É um pró‐fármaco rapidamente convertido em 6‐mercaptopurina (6‐MP) por meio da via do metabolismo das purinas; seus efeitos terapêuticos são derivados do antimetabolismo das purinas.1 Como um análogo da purina, ela inibe a produção de DNA e exerce efeitos em células com alta taxa de proliferação (ou seja, linfócitos T e B).2
Seu uso foi aprovado para prevenir a doença do enxerto contra hospedeiro em receptores de transplantes de órgãos, artrite reumatoide grave, lúpus eritematoso sistêmico e dermatite atópica.2,3 Em dermatologia, é usada de forma off‐label em várias doenças.2,3
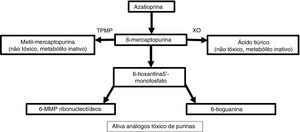
Metabolismo e farmacodinâmicaA azatioprina é sintetizada a partir de 6‐MP e um anel imidazólico no átomo de enxofre que estabiliza a molécula e evita seu catabolismo imediato.4 Esse antimetabólito purínico inibe a fase S do ciclo celular. O metabolismo das purinas endógenas produz 6‐MP.5 Existem três vias metabólicas no fígado e nos eritrócitos: xantina oxidase, tiopurina metiltransferase (TPMT) e hipoxantina fosforibosiltransferase. Essa última é responsável pela atividade do medicamento, enquanto as duas primeiras são as principais vias catabólicas e produzem metabólitos inativos como o ácido tiúrico (fig. 1).5,6
Para que o 6‐MP afete a síntese de ácidos nucleicos, ele precisa ser convertido em ácido tioinosínico.7 Esse nucleotídeo inibe a mitose, a formação de coenzimas, os neutrófilos e os monócitos, além de suprimir a síntese de prostaglandinas por meio da ciclo‐oxigenase (COX).7 A azatioprina apresenta uma atividade seletiva para linfócitos T em comparação com linfócitos B.8 Entre 70% e 80% do medicamento são absorvidos no trato gastrintestinal e atingem níveis séricos máximos duas horas após a ingestão.7,9 Ele não atravessa a barreira hematoencefálica.4
DoseOs adultos requerem uma dose de 1−3mg/kg/dia, e 1−4mg/kg/dia é a dose pediátrica.2,5 Os efeitos terapêuticos são observados um a dois meses após o início do medicamento. Os ajustes de dose devem ser feitos de acordo com a resposta de cada paciente.5,8 Sugere‐se a administração em conjunto com refeições, em doses divididas.3 A manutenção pode se estender por até 93 meses.1
Precauções antes do tratamentoÉ aconselhável explicar detalhadamente as informações sobre este medicamento ao paciente. Aqueles que não podem ser monitorados de perto não são elegíveis para tratamento.3
Solicitação:- 1.
Antígenos para hepatite B e C e ensaio imunoenzimático (ELISA) para HIV.
- 2.
Gonadotrofina coriônica humana (se indicada).
- 3.
Hemograma completo, análise química do sangue e testes de função hepática, antes do tratamento e duas vezes por mês durante os primeiros três meses. No fim deste período, é necessário um acompanhamento bimestral.
- 4.
Rastreamento anual para tuberculose.2
Em casos de disfunção hepática ou renal, faz‐se necessário o uso de doses mais baixas. Se a suspensão do medicamento for necessária, os efeitos adversos diminuirão gradualmente, devido à persistência do metabólito ativo.5
Pacientes sem história de infecção por varicela zoster recebendo tratamento e aqueles que tiveram contato próximo recente com o vírus devem ser imediatamente tratados com imunoglobulina. A administração de vacinas de vírus vivos para o paciente e parentes é proibida, devido ao risco de transmissão existente. Os membros da família devem receber vacinas de vírus inativados.3
Crianças com mais de 6 meses e aquelas que não respondem aos medicamentos mais seguros são elegíveis. O tratamento por curtos períodos pode induzir remissões prolongadas. A redução da dose deve ser realizada em seis meses até um ano.4
A fertilidade não é afetada adversamente; no entanto, há evidências escassas.4 É aconselhável evitar a gravidez e usar anticoncepcionais durante o tratamento.3 Os eventos adversos incluem nascimento prematuro ou com baixo peso.10,11 A azatioprina atravessa a barreira placentária e o fígado fetal carece das enzimas necessárias para sua conversão em metabólitos ativos.9
A literatura também relata toxicidade hematológica e anomalias esporádicas. Não há um padrão estabelecido de malformações congênitas (que podem incluir defeitos do septo atrial ou ventricular). A taxa de malformação varia de 3% a 9% e inclui mielomeningocele, microcefalia, polidactilia pré‐axial, atrofia tímica, hipoplasia adrenal e/ou hipospádia.9
É uma substância de categoria D na gravidez (benefícios aceitáveis, mas riscos para os fetos). Seu uso deve ser reservado para doenças com risco de vida.12 As pacientes devem receber metade da dose na 32ª semana de gestação se a contagem de leucócitos for inferior a um desvio‐padrão abaixo da média. Isso ajuda a prevenir leucopenia e/ou trombocitopenia no feto.10 Um estudo com mulheres grávidas que receberam azatioprina por oito semanas no primeiro trimestre resultou em evidências escassas relacionando o medicamento a malformações congênitas, baixo peso ao nascer e/ou prematuridade.13 Em homens, nenhuma anomalia no líquido seminal foi descrita três meses após o início do tratamento em pacientes com doença inflamatória intestinal (DII).14
A amamentação não é aconselhável durante o tratamento devido ao risco de tumorigênese e aumento de infecções nos bebês.15 No entanto, um estudo de acompanhamento de três anos em filhos de pacientes com DII que receberam azatioprina não observou diferenças significativas na taxa de infecções em comparação com filhos de mães saudáveis.16 A maior parte do 6‐MP é excretada no leite quatro horas após a ingestão, embora a quantidade ingerida por bebês não seja considerada significativa.17
Deficiência de TPMTA TPMT é uma enzima induzível e seus níveis variam com o tempo.2 É necessária a medição inicial desta enzima. Caso contrário, há risco de tratamento em doses subterapêuticas ou de efeitos adversos.2 Mielossupressão (neutropenia e pancitopenia) pode ser observada com doses regulares. Uma pancitopenia não identificada pode se tornar letal.5 Dez por cento dos indivíduos têm baixa atividade TPMT, o que gera toxicidade à tiopurina.5 O acúmulo resultante de nucleotídeos de tioguanina afeta a medula óssea.8 Pacientes sem atividade de TPMT não devem receber prescrição de azatioprina.5 Uma maior atividade de TPMT oferece menos risco de induzir uma resposta mielossupressora (tabela 1).2
Níveis de tiopurina metiltransferase (TPMT) e dosagem de azatioprina
| Níveis de TPMT | Dosagem de azatioprina |
|---|---|
| < 5 U | Contraindicado |
| 5−13,7 U | Até 0,5 mg/kg/dia |
| 13,7−19 U | Até 1,5 mg/kg/dia |
| > 19 U | Até 2,5 mg/kg/dia |
Adaptado de Patel et al.4.
Usado como agente poupador de esteroides de primeira linha. A azatioprina oferece melhores resultados em comparação com o micofenolato de mofetil (MMF).5,18 Outro medicamento, a ciclofosfamida, tem início de ação mais rápido; no entanto, a eficácia do tratamento é comparável aos seis meses.19 Quando combinados com prednisona, os desfechos finais são melhores, com benefícios como um maior número de pacientes em remissão e menos efeitos adversos (tabela 2).20
Contraindicações da azatioprina
| Relativa | Absoluta |
|---|---|
| Uso de alopurinol | Hipersensibilidade a 6 MP ou azatioprina |
| Tratamento anterior com ciclofosfamida ou clorambucil | Infecção ativa grave |
| Insuficiência renal | Função hepática alterada |
| Hepatite viral, HIV | Função da medula óssea alterada |
| Infecção anterior por VZV | Pancreatite |
| Pré‐malignidade | Vacinas de vírus vivos |
| Gravidez/amamentação |
VZV, vírus varicela zoster.
É aconselhável iniciar um agente poupador de esteroides desde o início do tratamento. O tempo de início dos efeitos terapêuticos da azatioprina varia de uma semana a sete meses. Em um acompanhamento de quatro anos, 44% dos pacientes alcançaram a remissão da doença.1 Ele interrompe a progressão da doença e promove a reepitelização em apenas oito semanas após o início do tratamento.21 O MMF é menos hepatotóxico, mas cinco vezes mais caro. Uma cura mais rápida e completa também foi demonstrada quando comparada ao MMF (23,8 vs. 42 dias).22 No entanto, nenhuma diferença no controle da doença foi identificada com prednisolona isolada, azatioprina e prednisolona, prednisolona com plasmaférese ou prednisolona com azatioprina ou MMF. 23
Dermatite actínica crônicaA azatioprina induz 57% a 92% de melhora nos pacientes quando comparada ao placebo. A dose varia entre 1–2,5mg/kg. Os efeitos adversos observados em pacientes com dermatite actínica crônica tratados com azatioprina incluem três mortes, 12 a 15 meses após a interrupção do tratamento (secundária à doença cerebrovascular, doença pulmonar e outra devido a doença cardíaca).1 A azatioprina demonstrou eficácia em doenças refratárias. As interações medicamentosas precisam ser revisadas, uma vez que esses pacientes costumam estar em tratamento polimedicamentoso, motivo pelo qual a azatioprina é preferida em vez da ciclosporina.24
PsoríaseA azatioprina pode ser indicada para pacientes com doença refratária. 1 Ela pode ser usada em conjunto com produtos biológicos, mas não é recomendada como monoterapia.5 Combinada com infliximabe (5mg/kg), ela induz melhora no quadro.25 A monoterapia com pulso intermitente pode ser eficaz com doses de 500mg administradas por três dias consecutivos a cada mês e 100mg por dia continuamente por 12 a 24 meses. A remissão pode ser alcançada por mais de cinco anos em alguns pacientes.26
Dermatite atópicaA informação sobre esse uso é escassa; no entanto, a azatioprina demonstrou ser tão eficaz quanto o metotrexato.1,27,28. É recomendado para variantes recalcitrantes em pacientes pediátricos ou quando há um impacto psicossocial significativo para o paciente e em sua família.2
A azatioprina pode ser usada em combinação e como um agente poupador de esteroides.1 Após três meses de tratamento, reduz‐se a escala SAS‐SAD em 26% quando comparada ao placebo (3%).29 Quando usada por 12 semanas, a atividade da dermatose foi reduzida em 37%, vs. 20% no grupo placebo.30 Uma melhoria de 27% na pontuação da gravidade da dermatite atópica (SSAD) também foi observada após seis meses. 1
Vasculite cutâneaÉ eficaz quando combinada com prednisolona para púrpura, úlceras, microinfartos ungueais e/ou necrose periférica a 2mg/kg. Observa‐se melhoria significativa da vasculite após 18 meses de tratamento e 88% dos pacientes alcançaram remissão completa. Os efeitos colaterais incluíram artrite séptica, abscesso epidural, efeitos gastrintestinais e um caso isolado de morte por insuficiência renal (devido a vasculite grave).1
Para vasculite leucocitoclástica, é recomendada como tratamento de segunda linha na púrpura de Henoch‐Schoenlein resistente a esteroides, mas foi usada com sucesso e melhorou o curso da nefrite.31
Na vasculite ANCA, foi comparada à remissão com o uso de azatioprina vs. rituximabe. Mais pacientes permaneceram em remissão aos 28 meses com rituximabe em comparação com azatioprina.32
Prurido intratávelEm um estudo retrospectivo de pacientes com prurido crônico (85% dos pacientes com sintomas por 12 meses ou mais) que responderam transitoriamente a um curso de esteroides sistêmicos, mas eram refratários a outros tratamentos, a azatioprina foi administrada em uma dose média inicial de 137,5mg/dia. O escore na escala de prurido foi reduzido de 9 para 1 ou 2.33
Doenças do tecido conjuntivo (Lúpus)A azatioprina é útil no lúpus eritematoso cutâneo subagudo refratário, lúpus discoide generalizado e lúpus erosivo palmoplantar, demonstra melhoria completa ou parcial. Quando combinada com prednisolona, pacientes com síndrome de Rowell apresentam boa resposta terapêutica.8
Para lúpus eritematoso sistêmico com manifestações cutâneas e nefrite, 1mg/kg por dia pode ser adicionado à ciclofosfamida (0,05 a 1,00g/m2 de superfície corporal por mês durante seis meses).34
DermatomiositeEm séries de casos retrospectivos, a azatioprina se mostrou eficaz. Ela é considerada igualmente eficaz quando comparada ao metotrexato. Em casos de pacientes com resposta inadequada a esses medicamentos, o tratamento combinado oferece bons resultados na doença refratária.35 A azatioprina também é recomendada para prevenir recaídas por longos períodos (um a três anos).36
Outros usos em dermatologiaEm um estudo‐piloto aberto e não controlado para alopecia areata moderada e grave, uma dose de 2mg/kg proporcionou melhoria notável.37 Em um estudo prospectivo com 14 pacientes diagnosticados com a variante universal, recalcitrantes a outras terapias sistêmicas e tópicos, 43% tiveram resposta terapêutica com uma dose média de 142mg diários e duração média do tratamento de 10 meses. O recrescimento total foi observado em 63%, e 29% mantiveram a resposta em 18 meses de acompanhamento.38
Um caso com fasceíte eosinofílica e morfeia generalizada foi tratado com 200mg/dia por dois meses com redução subsequente para 100mg/dia. A remissão foi mantida 18 meses após o tratamento.39
Na sarcoidose, demonstrou melhora em alguns casos; no entanto, em comparação com o metotrexato, a azatioprina exibiu resposta semelhante, porém com mais toxicidade.40
Penfigoide bolhoso e psoríase podem coexistir; alguns casos foram tratados com sucesso com azatioprina (50‐150mg/dia). Ela previne a reativação da psoríase ao interromper a ação dos esteroides.41 Em conjunto com a acitretina, é usada para psoríase eritrodérmica e penfigoide bolhoso. 42
Efeitos adversos/toxicidadeCurto prazoNáuseaEsse é o efeito adverso dependente de dose mais frequente. Surge no início do tratamento e melhora mesmo sem alteração da dose. Para evitá‐lo, as doses devem ser iniciadas na faixa mais baixa; uma dose de < 2,5mg/kg reduz a taxa de abandono em 20%.5 A dose pode ser dividida e tomada com as refeições.3
Hipersensibilidade à azatioprinaEsta reação idiossincrática é mediada imunologicamente. Apresenta‐se algumas semanas após o início da medicação. Sua identificação é essencial, pois pode ser mal interpretada como um sinal de infecção. Os pacientes podem apresentar febre, mialgia, artralgia, náusea, hepatite, nefrite intersticial, insuficiência renal e pneumonite.43 Os sinais cutâneos incluem eritema nodoso, síndrome de Sweet, vasculite de pequenos vasos, pustulose generalizada aguda e outras dermatoses inespecíficas. Hipotensão e choque podem ocorrer em casos graves.44
É possivelmente subdiagnosticada e os pacientes com eczema atópico são os mais propensos a desenvolver essa reação. Observa‐se remissão dos sinais e sintomas cutâneos cinco dias após a interrupção do medicamento.5,44
Médio prazoMielotoxicidadeÉ caracterizada por leucopenia, trombocitopenia, anemia e/ou pancitopenia.7 A neutropenia é dependente da dose. Este efeito colateral sério pode acontecer com mais frequência do que o presumido. Aproximadamente 19% dos pacientes desenvolvem neutropenia.5
Infecção clínica, ulceração faríngea, equimoses e/ou sangramento podem levar à sua identificação. O monitoramento é necessário se houver diminuição na contagem de plaquetas e leucócitos dentro do limite inferior normal. Se os linfócitos diminuírem < 0,50 k/uL, é aconselhável reduzir a dose. Se as alterações na contagem de plaquetas estiverem < 50 k/uL e/ou os neutrófilos estiverem < 1,0 k/uL, recomenda‐se uma consulta hematológica.3
InfecçõesObserva‐se maior suscetibilidade a infecções devido à linfopenia, mesmo sem neutropenia. Pacientes com tuberculose latente apresentam risco de reativação ao iniciar o tratamento.5
HepatotoxicidadePode ocorrer fibrose portal reversível e/ou colestase mínima.7 Alterações leves nos testes de função hepática sem implicações clínicas graves são frequentes. Existem dois tipos de hepatotoxicidade para a azatioprina: lesão hepática aguda idiossincrática, com doença hepatocelular (aumento grave da transaminase) ou colestase (aumento da fosfatase alcalina e bilirrubina).5 Eles se resolvem com a diminuição ou suspensão da medicação.3,5 Hepatotoxicidade grave é raramente observada.5
Longo prazoHá risco de infecções cutâneas e neoplasias hematológicas ou cutâneas.7 No entanto, quando usado exclusivamente para condições dermatológicas, essas reações adversas são improváveis, pois a dosagem é mais baixa e o tempo de uso é menor.1
ConclusãoA azatioprina é um medicamento útil em pacientes com condições dermatológicas complexas e/ou resistentes aos tratamentos convencionais. Foi aprovada para doenças como lúpus, dermatomiosite e pênfigo vulgar. É fundamental que o dermatologista oriente adequadamente o paciente quanto a efeitos adversos. Os médicos devem estar cientes de que esses efeitos indesejados melhoram e desaparecem quando a azatioprina é diminuída ou interrompida. Recomenda‐se sempre começar com a menor dose possível para melhorar a tolerância e evitar a descontinuação definitiva de um medicamento que pode ser extremamente benéfico para o paciente.
Suporte financeiroNenhum.
Contribuição dos autoresSonia Chavez‐Alvarez: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Maira Herz‐Ruelas: Revisão crítica da literatura.
Alejandra Villarreal‐Martinez: Concepção e planejamento do estudo; elaboração e redação do manuscrito.
Jorge Ocampo‐Candiani: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa.
Rubicela Garza‐Garza: Participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Minerva Gomez‐Flores: Concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Conflitos de interesseNenhum.
Como citar este artigo: Chavez‐Alvarez S, Herz‐Ruelas M, Villareal‐Martinez A, Ocampo‐Candiani J, Garza‐Garza R, Gomez‐Flores M. Azathioprine: its uses in dermatology. An Bras Dermatol. 2020;95:731–6.
Trabalho realizado no Hospital Universitário Dr. José Eleuterio González, Universidad Autónoma de Nuevo Léon, Nuevo León, México.