O melanoma polipoide é uma variante do melanoma nodular cujo prognóstico depende de sua espessura e da presença de ulceração no momento do diagnóstico. Os autores relatam dois casos de melanoma polipoide que se apresentam como massas polipoides largas e semelhantes a uma couve‐flor. A dermatoscopia caracterizou‐se por um padrão multicolorido, vasos pleomórficos atípicos e pelo sinal da fibra. As características clínicas e dermatoscópicas podem ajudar a diagnosticar o melanoma polipoide e a excluir outros possíveis diagnósticos diferenciais. No entanto, a histologia continua obrigatória para confirmar a suspeita diagnóstica.
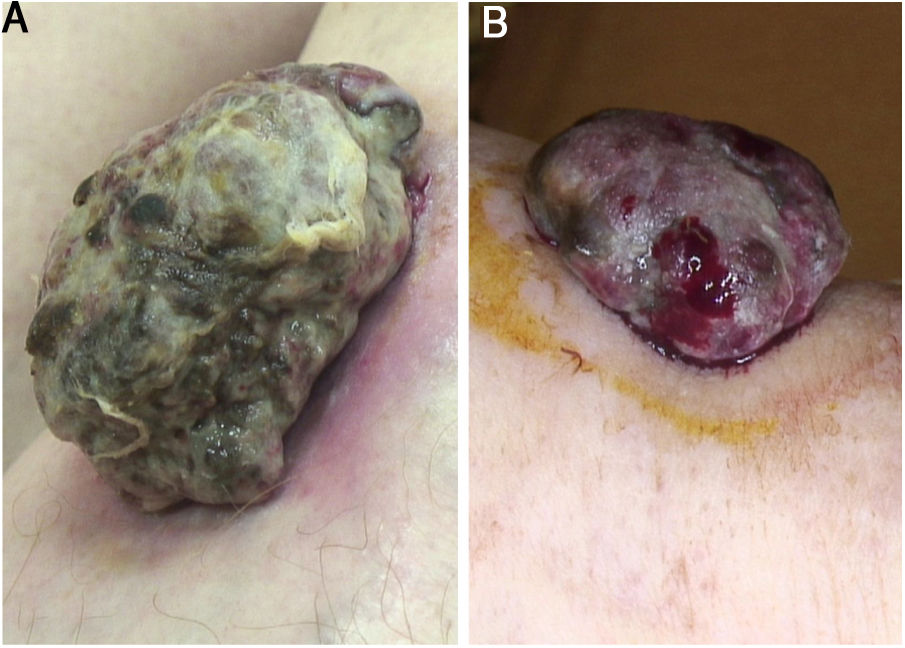
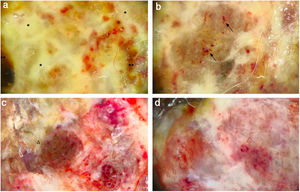
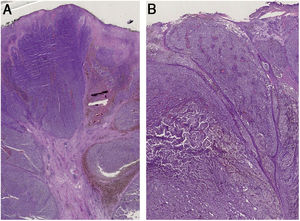
Paciente do sexo feminino, 59 anos, encaminhada ao nosso serviço por massa exofítica localizada na perna esquerda havia seis meses. Ao exame clínico, a lesão media 1,8×4,5cm em suas maiores dimensões, apresentava áreas necrótico‐hemorrágicas e fibrinosas e deformava a pele eritematosa subjacente (fig. 1A). A dermatoscopia revelou um padrão multicolorido com fundo amarelo difuso e áreas irregularmente distribuídas em vermelho, marrom e cinza. A observação de vasos pleomórficos atípicos foi difícil devido às crostas sero‐hemáticas e filamentos de gaze que estavam presos na superfície irregular da lesão (fig. 2A e B). A histopatologia evidenciou um melanoma polipoide (MP) agressivo com espessura de Breslow de 12mm, ulceração, 3‐6 mitoses/mm2, envolvimento linfovascular, traves fibroepiteliais que subdividiam o tumor em lóbulos e vasos pleomórficos (fig. 3A). Embora o envolvimento nodal tenha sido positivo, nenhuma metástase a distância foi encontrada. Iniciou‐se tratamento anti‐PD‐1. Durante o primeiro ano de acompanhamento, não se observou evidência instrumental de recorrência.
(A), Massa nodular séssil, 1,8×4,5cm em sua maior dimensão, circundada por halo eritematoso na região anterior da perna. Podem ser observadas áreas necróticas e fibrinosas e filamentos de gaze incorporados à superfície tumoral. (B), Nódulo séssil de base ampla (1,5×3,8cm em sua maior dimensão) na região anterior da perna, deformando a pele subjacente. Áreas necróticas e fibrinosas e sangramento são evidentes.
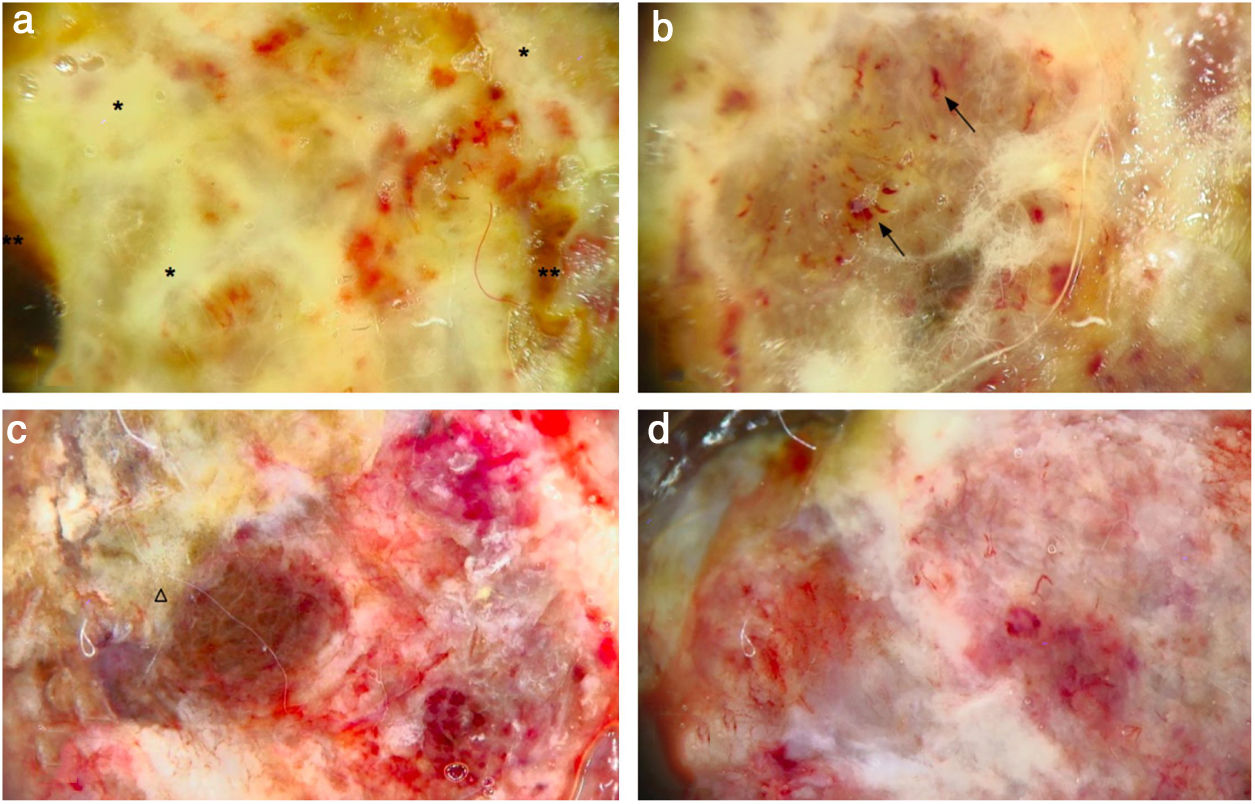
(A), Dermatoscopia evidencia um padrão multicolorido, com fundo amarelo difuso (*) e algumas áreas irregularmente distribuídas em vermelho, marrom e cinza (**). “Sinal da fibra”: a observação do componente vascular pleomórfico atípico é dificultada por filamentos de gaze presos na superfície irregular do tumor. (B,) Vasos atípicos, pleomórficos e principalmente dilatados (setas). (C), A dermatoscopia revela um padrão multicolorido, com fundo vermelho e branco difuso e algumas áreas amarelas, marrons e acinzentadas distribuídas irregularmente (triângulo). (D), Vasos atípicos sobre fundo vermelho e branco são claramente visíveis.
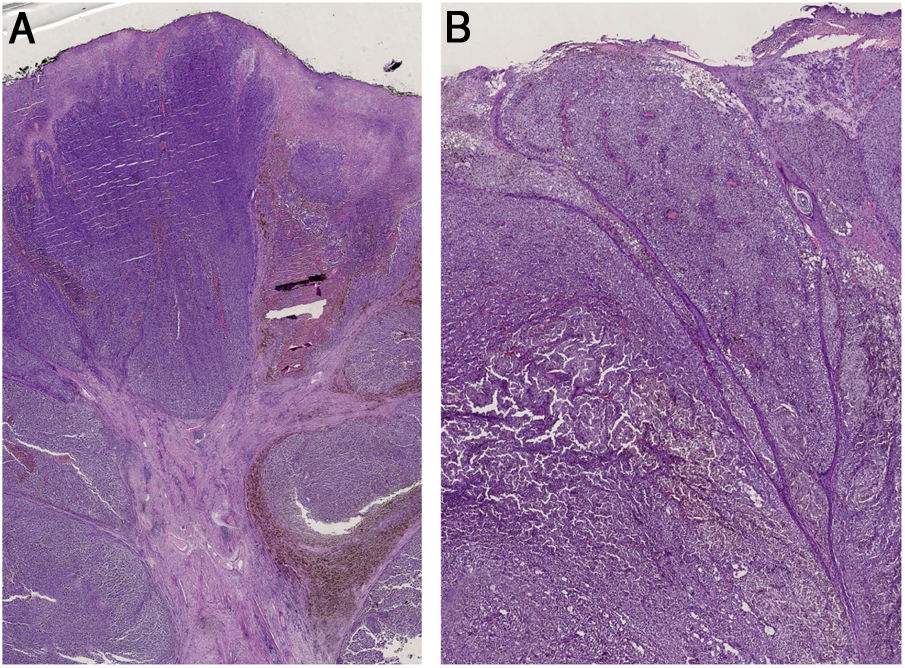
(A), Histopatologia evidencia traves fibroepiteliais que subdividem o tumor em lóbulos. A distribuição do pigmento é irregular, tanto em quantidade quanto em profundidade. Vasos pleomórficos e ulceração são visíveis ao longo das lesões. (B), Os achados histopatológicos incluem ulceração, vasos pleomórficos atípicos com depósitos esparsos de pigmento e ausência de cones epidérmicos. O infiltrado inflamatório é escasso.
Uma mulher italiana de 82 anos foi encaminhada ao nosso serviço devido à história de massa nodular na perna esquerda havia seis meses. Ao exame físico, a lesão era séssil, de grandes dimensões (1,5×3,8cm), com superfície irregular, crostosa e cruenta. A lesão deformava a pele subjacente e era circundada por halo eritematoso (fig. 1B). A dermatoscopia revelou vasos pleomórficos e um padrão multicolorido, com fundo vermelho e branco difuso e algumas áreas amarelas, marrons e cinzentas irregularmente espalhadas (fig. 2C e D). A histopatologia mostrou espessura de Breslow de 10mm, ulceração, >11 mitoses/mm2, envolvimento linfovascular, vasos pleomórficos atípicos com deposições dispersas de pigmento, ausência de cones epidérmicos e escasso infiltrado inflamatório (fig. 3B). A paciente, que foi estadiada como melanoma IIIC devido ao envolvimento nodal positivo e metástases a distância negativas, foi encaminhada para outro hospital, mais próximo de sua residência.
Em ambos os casos, a análise molecular mostrou mutação BRAF negativa (pirossequenciamento do éxon 15) e mutação NRAS positiva no éxon 3 (pirossequenciamento dos éxons 2 e 3).
DiscussãoO MP é caracterizado por uma superfície irregular e perfil semelhante a uma couve‐flor.1–3 Embora o MP tipicamente afete as mucosas, quando envolve a pele, geralmente afeta o dorso.2,3 Histologicamente, o MP mostra atipia citológica acentuada, pleomorfismo nuclear e mistoses abundantes.3,4 A fase inicial de crescimento radial‐horizontal evolui rapidamente para uma fase nodular‐vertical, com risco importante de embolia vascular.2,3 Até o momento, existem poucos relatos do uso da dermatoscopia no MP. Hikawa et al. relataram um caso de MP sobreposto a um melanoma extensivo superficial com padrão irregular de multicomponentes, caracterizado pela presença de rede atípica, glóbulos e áreas amorfas pigmentadas.1 Cabrera et al. descreveram um caso de MP com véu branco‐azulado na parte exofítica da lesão e grandes ninhos cinza‐azulados e áreas esbranquiçadas na base do pedículo.5 De acordo com Hikawa et al., uma análise dermatoscópica clara do tumor pode ser impedida pela presença de crostas e fibras de roupas, gazes ou cabelos do próprio paciente, o chamado “sinal da fibra”, que é uma indicação dermatoscópica indireta de ulceração.6
Tanto quanto é do conhecimento dos autores, este é o primeiro relato a encontrar não apenas achados clínicos macroscópicos similares e a mesma localização incomum, mas também características dermatoscópicas semelhantes: em ambos os casos, o tumor se apresentou com uma crosta fibrinosa irregular similar a uma couve‐flor e algumas áreas cruentas, marcou a pele eritematosa subjacente, como no caso relatado por Pérez‐Wilson et al.3 O achado dermatoscópico mais relevante dos presentes casos de MP foram os vasos pleomórficos atípicos e o padrão multicolorido: a cor amarela relacionou‐se principalmente à presença de fibrina; as áreas marron, preta e vermelha estavam associadas à superfície “verdadeira” do tumor; as estrias esbranquiçadas eram causadas pelo componente fibroso do tumor.
A dermatoscopia pode ser útil para o diagnóstico diferencial de MP com outras neoplasias malignas, mesmo que seja desafiador. O carcinoma espinocelular mal diferenciado mostra uma predominância da cor vermelha, erosão/ulceração e estruturas brancas residuais.7 O carcinoma espinocelular pigmentado é caracterizado por pigmentação cinza‐azulada homogênea, ulceração, estrias radiais e glóbulos.8 As principais características dermatoscópicas do carcinoma de células de Merkel incluem áreas vermelhas leitosas e áreas áreas brancas brilhantes pleomórficas dentro do corpo do tumor, assim como vasos lineares, irregulares e arboriformes.9
A histopatologia continua obrigatória para o diagnóstico definitivo de MP. A aparência irregular de couve‐flor, bem como as estrias esbranquiçadas dos presentes dois casos de MP, foi decorrente das traves fibroepiteliais que subdividiam os tumores em lóbulos, enquanto o padrão multicolorido representava a contrapartida dermatoscópica da distribuição irregular do pigmento na histopatologia.
Ambos os casos apresentaram mutação NRAS; esse achado está de acordo com a literatura, uma vez que as mutações do NRAS foram associadas ao melanoma nodular e localização nos membros.10
Suporte financeiroNenhum.
Contribuição dos autoresAmbra Di Altobrando: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Annalisa Patrizi: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa.
Emi Dika: Revisão crítica do manuscrito.
Francesco Savoia: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Ao Dr. Cosimo Misciali e à Dra. Carlotta Baraldi pelas imagens da histopatologia.