A incidência do melanoma está aumentando em todo o mundo, e mesmo tumores pequenos e finos podem metastatizar.1,2 A progressão tumoral inclui proliferação, neovascularização e linfangiogênese,3 e muitos mediadores são importantes nessa patogênese. A nestina (importante na proliferação), a endoglina (importante na neovascularização) e o VEGF‐C (importante na infangiogênese) já foram descritos no melanoma cutâneo em geral, mas com pouca ênfase em melanomas finos.
Descrevemos os dados clínicos de pacientes com melanoma fino com metástases e melanoma fino sem metástases e a expressividade imuno‐histoquímica à nestina, endoglina e VEGF‐C. O projeto de pesquisa foi aprovado pelo Comitê de Ética da Instituição (número do parecer: 332.405).
Foi realizado um estudo caso‐controle com 85 pacientes: 20 deles no grupo caso e 65 no grupo controle.
O grupo caso foi constituído por pacientes que apresentavam metástase de melanoma a partir de uma lesão cutânea primária de melanoma fino (até 1mm de espessura). Os controles foram pacientes com melanoma fino, mas sem metástase. Foram coletados dados quanto ao sexo, idade, topografia e subtipo histológico do melanoma.
Dos 85 pacientes, 37 expressaram marcadores (sete do grupo caso e 30 do grupo controle). No grupo caso, foram realizadas três lâminas de imuno‐histoquímica para cada marcador. No grupo controle, duas lâminas para cada marcador, visando a análise estatística de dados em clusters. Foram utilizados os anticorpos nestina (ABCAM®), endoglina (CD105) (NOVO CASTRA®) e VEGF‐C (IN VITRO GEN®) com a técnica padrão de imunoperoxidase. A substância cromógena foi o 3‐amino‐9‐etilcarbazol (AEC), como já utilizada em estudo prévio de melanoma.4
Para endoglina, foram determinados os hots spots de neovascularização das lesões em campos de dez aumentos. Foram consideradas positivas as reações imuno‐histoquímicas de moderada a forte intensidade. Foram fotografados até quatro hot spots por lâmina. A captura da imagem foi em objetiva de 40 aumentos. Em seguida, contou‐se o número de microvasos de cada lesão. Áreas de fibrose foram evitadas, pois poderiam corresponder à neovascularização de reparo, e não à neovascularização da lesão.
Para a avaliação das diferenças dos marcadores imuno‐histoquímicos, utilizamos uma análise com base no procedimento de equações de estimativas generalizadas (Generalized Estimating Equations – GEE). Essa técnica leva em consideração o efeito de dados em conglomerados (clusters) no qual um determinado paciente pode contribuir com um número maior de observações do que outro. Assim, é feito um ajuste para as medidas correlacionadas obtidas em um mesmo indivíduo. De acordo com os pressupostos de distribuição dos dados, foram utilizadas funções de ligação por identidade (Gaussiana), log e Poisson.
Quanto à análise estatística, os dados quantitativos foram descritos por média e erro‐padrão, e as variáveis categóricas foram apresentadas por contagens e percentuais. Comparações iniciais entre os grupos foram realizadas pelo teste t de Student ou pelo teste exato de Fisher. O nível de significância adotado foi de α=0,05. Os dados foram digitados em planilha de Excel e analisados com o auxílio do programa IBM‐SPSS versão 22.0.
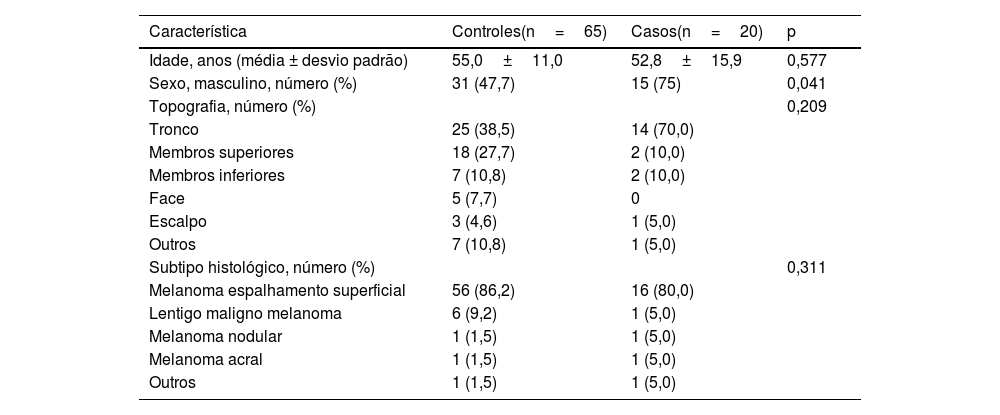
A maioria dos pacientes no grupo caso era de homens (75%). Nos controles, 47% dos pacientes eram do sexo masculino. Essa diferença foi estatisticamente significante (p <0,041). A média de idade no grupo caso foi de 52 anos, e no grupo controle de 55 anos. Nos dois grupos, a localização topográfica mais frequente do melanoma primário foi o tronco. Também nos dois grupos o subtipo histológico mais frequente foi o melanoma de espalhamento superficial. Esses dados não apresentaram diferença estatística (tabela 1).
Características gerais dos pacientes com melanoma fino com metástases (Casos) e sem metástases (Controles)
| Característica | Controles(n=65) | Casos(n=20) | p |
|---|---|---|---|
| Idade, anos (média ± desvio padrão) | 55,0±11,0 | 52,8±15,9 | 0,577 |
| Sexo, masculino, número (%) | 31 (47,7) | 15 (75) | 0,041 |
| Topografia, número (%) | 0,209 | ||
| Tronco | 25 (38,5) | 14 (70,0) | |
| Membros superiores | 18 (27,7) | 2 (10,0) | |
| Membros inferiores | 7 (10,8) | 2 (10,0) | |
| Face | 5 (7,7) | 0 | |
| Escalpo | 3 (4,6) | 1 (5,0) | |
| Outros | 7 (10,8) | 1 (5,0) | |
| Subtipo histológico, número (%) | 0,311 | ||
| Melanoma espalhamento superficial | 56 (86,2) | 16 (80,0) | |
| Lentigo maligno melanoma | 6 (9,2) | 1 (5,0) | |
| Melanoma nodular | 1 (1,5) | 1 (5,0) | |
| Melanoma acral | 1 (1,5) | 1 (5,0) | |
| Outros | 1 (1,5) | 1 (5,0) |
Dados apresentados como médias±erro‐padrão ou contagens (percentuais).
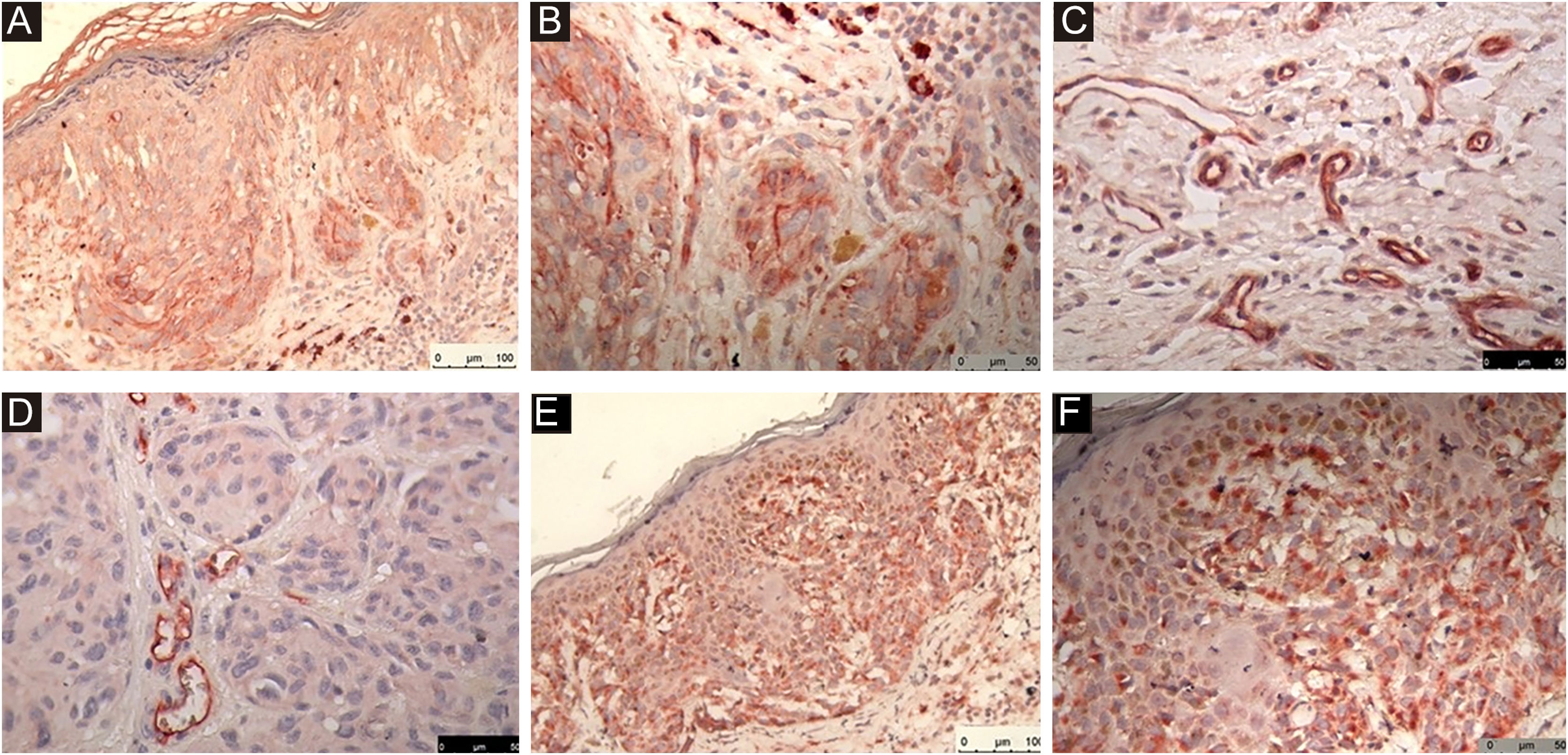
As reações imuno‐histoquímicas dos marcadores estão ilustradas na figura 1 (A: nestina, B: nestina, C: endoglina, D: endoglina, E: VEGF‐C, F: VEGF‐C).
A reação imuno‐histoquímica positiva para endoglina foi considerada moderada a forte. No grupo caso, a média do número de estruturas vasculares identificadas foi de 11,47 com erro padrão de 1,27. No grupo controle foi de 9,22, com erro padrão 0,59. Essa diferença, não foi significante (p=0,088). Nestina e VEGF‐C não apresentaram diferenças entre os grupos.
O sexo masculino já é reconhecido como o que apresenta pior prognóstico nos doentes com melanoma.2 Neste estudo, os pacientes com melanoma fino e metástases do sexo masculino prevaleceram quando comparados ao feminino.
A nestina, importante na proliferação celular, e o VEGF‐C, importante na infangiogênese, já foram descritos no melanoma cutâneo em geral.
A endoglina (também conhecida como CD105) participa da angiogênese por meio da proliferação e migração das células endoteliais e da morfogênese dos capilares.5 Foi identificada a possibilidade do envolvimento da endoglina na regulação das propriedades biológicas das células do melanoma.6 A expressão da endoglina já foi detectada em lesões melanocíticas e em culturas de células de melanoma,7 indicando seu possível envolvimento na regulação das propriedades biológicas das células do melanoma.6
É possível que ocorra participação da endoglina na angiogênese observada em melanomas finos, em especial nos tumores com metástases, mas este estudo não evidenciou comprovação estatística definitiva.
Suporte financeiroNenhum.
Contribuição dos autoresMaria Carolina Widholzer Rey: Concepção e o desenho do estudo; levantamento dos dados/análise e interpretação dos dados; análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Adriana Roehe: Levantamento dos dados/análise e interpretação dos dados; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; crítica da literatura; aprovação final da versão final do manuscrito.
Felice Riccardi: Levantamento dos dados/análise e interpretação dos dados; obtenção, análise e interpretação dos dados; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; crítica da literatura; aprovação final da versão final do manuscrito.
Beatriz Silva de Souza: Levantamento dos dados/análise e interpretação dos dados; obtenção, análise e interpretação dos dados; crítica da literatura; aprovação final da versão final do manuscrito.
Mariele Bevilaqua: Redação do artigo ou revisão crítica do conteúdo intelectual importante; revisão; crítica da literatura; aprovação final da versão final do manuscrito.
Renan Rangel Bonamigo: Concepção e desenho do estudo; levantamento dos dados/análise e interpretação dos dados; análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual na conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Agradecemos a colaboração inestimável do Dr. Mário Wagner e da Dra. Tatiana Wittee Neetzow Nunes.
Como citar este artigo: Rey MC, Roehe A, Riccardi F, Souza BS, Bevilaqua M, Bonamigo RR. Thin cutaneous melanoma: investigation of the immunohistochemical expression of endoglin, VEGF‐C and nestin. An Bras dermatol. 2022;97:814–6.
Trabalho realizado no Programa de Pós‐Graduação em Patologia e Dermatologia da Universidade Federal de Ciências da Saúde de Porto Alegre; Hospital Santa Casa de Porto Alegre, Porto Alegre, RS, Brasil.