No melasma, além da hiperfunção melanocítica, evidenciam‐se alterações na derme superior e, fibroblastos exercem função central na síntese de colágeno e na indução da pigmentação.
ObjetivoExplorar a morfologia, a taxa de crescimento e o perfil de expressão gênica dos fibroblastos da pele com melasma em comparação com fibroblastos da pele sã adjacente.
MétodosDez mulheres com melasma facial foram biopsiadas (lesão e pele sã adjacente), e os fragmentos foram processados para cultura de fibroblastos. Amostras de cinco participantes foram semeadas para avaliação das curvas de crescimento (dias 2, 5 e 8) e senescência (SA‐β‐gal). Amostras das demais participantes foram submetidas a real‐time PCR para avaliar comparativamente a expressão de 39 genes.
ResultadosFibroblastos das culturas da pele com melasma eram morfologicamente menos fusiformes e tinham uma proporção média 34% (95% IC 4‐63%) maior de células marcadas com SA‐β‐gal do que os fibroblastos da pele adjacente. A taxa de crescimento celular foi menor para as amostras de melasma após oito dias (p < 0,01). Os genes WNT3A, EDN3, ESR2, PTG2, MMP1 e SOD2 estavam sobreregulados; já COL4A1, CSF2, DKK3, COL7A1, TIMP4, CCL2 e CDH11 estavam subregulados nos fibroblastos da pele com melasma em comparação com os da pele sã adjacente.
Limitações do estudoPequeno tamanho amostral; ausência de ensaios funcionais.
ConclusõesFibroblastos da pele com melasma revelaram menor taxa de crescimento, morfologia menos fusiforme e maior acúmulo de SA‐β‐gal do que os da pele fotoexposta adjacente. Além disso, seu perfil de expressão gênica compreendeu fatores que podem contribuir para dano à derme superior e melanogênese sustentada.
Melasma é discromia adquirida e de elevada prevalência, que decorre de aumento na atividade da unidade epidermo‐melânica.1 As lesões acometem áreas fotoexpostas (por exemplo, a face), principalmente em mulheres durante o menacme. Sua patogênese ainda não é totalmente compreendida; o papel das alterações da zona da membrana basal, danos à derme superior e atividade dos fibroblastos no desenvolvimento da doença são questões de pesquisas recentes.2–5
Em comparação com a pele sã adjacente (fotoexposta), a pele com melasma apresenta aumento na quantidade de melanina epidérmica, melanossomas mais maduros, melanócitos hipertrofiados e elastose solar proeminente. Também há um aumento no número de vasos e de mastócitos, bem como expressão aumentada de mediadores inflamatórios, como iNOS, NF‐Kβ, endotelina, e fatores de crescimento, como VEGF, fator de crescimento derivado de hepatócitos, de stem cell, de fibroblastos e de nervos.6 Melanócitos em pêndulo – melanócitos da camada basal que se projetam em direção à derme superior – e alterações na membrana basal também foram descritos no melasma.2 Há diminuição do colágeno tipo I associada a aumento na atividade de metaloproteinases (MMP 1, 2, 3 e 9).7 Alguns genes relacionados ao metabolismo lipídico estão regulados negativamente na pele do melasma e a função da barreira cutânea é prejudicada.8
A exposição solar é o principal fator de risco para o desenvolvimento do melasma. A fotoexposição crônica, além da melanogênese, induz estresse oxidativo, o que promove senescência celular.5 Além do fotoenvelhecimento e do envelhecimento intrínseco, o melasma apresenta um fenótipo senescente mais proeminente na pele acometida. A senescência celular precoce induzida pela radiação ultravioleta (RUV) promove alterações funcionais que podem deflagrar e perpetuar a melanogênese.9,10
Os fibroblastos têm um papel central na pigmentação, e sua transição para perfil senescente promove modificação de suas atividades autócrina e parácrina.10 Na pele com melasma, os fibroblastos liberam mais fator derivado de stem cell e seu receptor epidérmico c‐kit.11 Fibroblastos senescentes podem expressar fatores inflamatórios e melanogênicos, o que pode levar ao desenvolvimento do melasma.3
O fenótipo senescente foi identificado nos fibroblastos com melasma de maneira mais intensa que na pele adjacente fotoexposta a partir da imunoexpressão de p16INK4A, o que pode justificar o estímulo para a pigmentação cutânea sustentada.9,10 Porém, até o momento, não foi explorado o potencial de replicação celular, ou caracterizado o perfil de expressão gênica desses fibroblastos dérmicos, no que se refere a fatores de crescimento e reparo tecidual, ativação da via de crescimento tecidual WNT/β‐catenina (WNT), neocolagênese, síntese de metaloproteinases, receptores de estrogênios e mecanismos antioxidantes. Tal caracterização pode subsidiar modelos fisiopatológicos e estratégias de tratamento.
Este estudo teve como objetivo explorar a morfologia, a taxa de crescimento e o perfil de expressão gênica de fibroblastos oriundos do melasma facial, em comparação com a pele adjacente fotoexposta.
MétodosEste projeto foi aprovado pelo Conselho de Ética em Pesquisa (Unesp, Botucatu‐SP, n.° 0461‐11) e todos os participantes consentiram em participar.
Dez mulheres adultas com melasma facial foram biopsiadas (punch 2 mm, utilizando técnica estéril) na pele com melasma da região malar e na pele fotoexposta adjacente clinicamente normal (< 2 cm de distância), lateralmente. As participantes estavam sem tratamento para a dermatose por pelo menos 30 dias, exceto pelo uso de protetor solar.
Os fragmentos de pele foram seccionados e colocados em cultura de fibroblastos, mantidos em meio 106 (GibcoTM) contendo fatores de crescimento (LSGS Kit, GibcoTM). Os fibroblastos foram semeados (em triplicada) a uma densidade de 5×103 em placa de cultura celular de 12 poços.
Fibroblastos cultivados, de pele sã e lesada, de cinco participantes foram semeados a uma densidade de 1 × 104 em placa de cultura celular de seis poços, e o número de células por cm2 foi avaliado após 2, 5 e 8 dias, a partir da avaliação de 30 campos, e comparados (entre as topografias) por modelo linear generalizado de efeitos mistos. A normalidade das amostras foi avaliada pelo teste de Shapiro‐Wilk.
Posteriormente, a senescência celular foi avaliada por meio de senescence β‐galactosidase (SA‐β‐gal) staining kit (Cell Signaling Technology®), seguindo as instruções do fabricante. Após 24 horas do plaqueamento das células, foi removido o meio de cultura, seguiu‐se com lavagem com PBS e adição de solução de fixação por 15 minutos à temperatura ambiente. Então, realizou‐se lavagem com PBS por duas vezes e incubação overnight com solução de β‐galactosidase (Cell Signaling Technology®), a 37°C. Após remoção da solução, foi adicionado glicerina 70%.
Foram contadas 300 células por amostra. A morfologia dos fibroblastos em cultura e o percentual de células marcadas com SA‐β‐gal citoplasmático foram comparados entre as topografias (melasma e pele sã adjacente).
Fibroblastos da cultura celular primária das outras cinco participantes foram submetidos a real‐time PCR array (placa de 96 poços, Custom RT2Profiler PCR Arrays, Qiagen) para avaliar a expressão de 39 genes associados a fatores de crescimento e reparo tecidual, ativação da via WNT, neocolagênese, síntese de metaloproteinases, receptores de estrogênios e mecanismos antioxidantes. (tabela 1). O RNA total foi obtido com RNase mini kit (Qiagen), e a transcrição reversa do RNA foi realizada utilizando RT2First Strand Kit for RT‐PCR (Qiagen), seguindo as instruções do fabricante.
Lista dos 39 genes explorados no estudo, e sua função principal na pele
| Gene | Nome | Função principal (cutânea) |
|---|---|---|
| CCL2 | Quimiocina ligante C‐C tipo 2 | Quimiocina envolvida no processo de reparo tecidual |
| CDH11 | Caderina 11 | Relacionada à adesão celular e reparo epitelial |
| CDKN2A | Inibidora de quinase dependente de ciclina 2a | Resposta celular ao estímulo inflamatório e neoplásico |
| COL4A1 | Colágeno tipo IV | Componente da membrana basal |
| COL7A1 | Colágeno tipo VII | Componente das fibrilas de ancoragem |
| CSF2 | Fator estimulador de colônias tipo 2 | Envolvida no processo de reparo do epitélio |
| DKK1 | Proteína relacionada ao Dickkopf 1 | Inibidor da via de crescimento celular Wnt/β‐catenina |
| DKK3 | Proteína relacionada ao Dickkopf 3 | Inibidor da via de crescimento celular Wnt/β‐catenina |
| EDN1 | Endotelina tipo 1 | Induz melanogênese e proliferação vascular |
| EDN3 | Endotelina tipo 3 | Induz melanogênese e proliferação vascular |
| ESR1 | Receptor de estrogênio tipo 1 (α) | Receptor de estrogênio ligado à via canônica |
| ESR2 | Receptor de estrogênio tipo 2 (β) | Receptor de estrogênio ligado ao reparo tecidual |
| FGF2 | Fator de crescimento de fibroblastos tipo 2 | Reparo do dano tecidual, mitótico para fibroblastos |
| GLB1 | Beta‐galactosidase tipo 1 | Gene constitucional. Controle do experimento |
| HGF | Fator de crescimento hepático | Reparo do dano tecidual |
| IL1A | Interleucina 1a | Resposta inflamatória primária da pele |
| IL1B | Interleucina 1b | Resposta inflamatória primária da pele |
| IL6 | Interleucina 6 | Resposta inflamatória primária da pele |
| MAPK14 | Proteína‐quinase ativada por mitógeno 14 | Resposta celular ao estímulo inflamatório |
| MIF | Fator de inibição da migração de macrófago | Resposta inflamatória primária da pele |
| MMP1 | Metaloproteinase tipo 1 | Degradação dos colágenos tipo I, II e III |
| MMP2 | Metaloproteinase tipo 2 | Degradação do colágeno tipo IV |
| MMP7 | Metaloproteinase tipo 7 | Degradação da matriz extracelular |
| MMP9 | Metaloproteinase tipo 9 | Degradação da matriz extracelular e angiogênese |
| NGR1 | Neuroregulina tipo 1 | Regula o crescimento melanocítico e cor da pele |
| OXR1 | Proteína de resistência oxidativa tipo 1 | Resposta celular ao estresse oxidativo |
| OXSR1 | Proteína de estresse oxidativo tipo 1 | Resposta celular ao estresse oxidativo |
| PTGS2 | Ciclo‐oxigenase tipo 2 | Síntese de prostaglandina E2 |
| SOD1 | Superóxido dismutase tipo 1 | Protege a célula das espécies ativas de oxigênio |
| SOD2 | Superóxido dismutase tipo 2 | Induzida em resposta ao estresse oxidativo mitocondrial |
| TIMP1 | Inibidor da metaloproteinase tipo 1 | Inibidor da degradação dos colágenos I, II e III |
| TIMP2 | Inibidor da metaloproteinase tipo 2 | Inibidor da degradação do colágeno IV |
| TIMP3 | Inibidor da metaloproteinase tipo 3 | Inibidor da degradação do colágeno e matriz extracelular |
| TIMP4 | Inibidor da metaloproteinase tipo 4 | Inibidor da degradação da matriz extracelular |
| TP53 | Proteína p53 | Marcador de fotoagressão UVB, antiangiogênico |
| VEGFA | Fator de crescimento endotelial tipo A | Promotor da angiogênese |
| WIF1 | Fator inibidor WNT tipo 1 | Inibe a via de crescimento celular Wnt / β‐catenina |
| WNT3A | Membro 3A da família WNT | Ativador da via canônica Wnt / β‐catenina |
| WNT5A | Membro 5A da família WNT | Ativador da via não‐canônica Wnt |
O tamanho do efeito para a expressão gênica (2−ΔΔCt) foi estimado pelo fold change (melasma/pele adjacente) para cada participante.12 Os fold changes foram representadas por sua média e 95% IC, estimados por 10.000 reamostragens com correção acelerada de viés (accelerated bias correction – BCa).
ResultadosOs principais dados clínicos e demográficos dos pacientes estudados estão dispostos na tabela 2.
Principais características das dez pacientes com melasma facial submetidas à biópsia da face na região com melasma malar e pele facial fotoexposta adjacente, cujas amostras foram utilizadas para curva de crescimento, morfologia e marcação SA‐β‐gal, ou teste de expressão gênica
| Curva de crescimento, morfologia e marcação SA‐β‐gal | |||||
|---|---|---|---|---|---|
| Caso | Idade | Fototipo | Tempo de melasma (anos) | História familiar de melasma | mMASI |
| 1 | 46 | IV | 10 | Sim | 9,5 |
| 2 | 46 | IV | 13 | Sim | 8,2 |
| 3 | 35 | III | 2 | Sim | 6,6 |
| 4 | 41 | IV | 11 | Não | 11,5 |
| 5 | 38 | IV | 10 | Não | 12,4 |
| Teste de expressão gênica | |||||
| 6 | 41 | IV | 23 | Não | 9,9 |
| 7 | 38 | IV | 17 | Sim | 19,2 |
| 8 | 41 | III | 16 | Sim | 9,5 |
| 9 | 47 | III | 28 | Sim | 7,6 |
| 10 | 44 | IV | 5 | Não | 10,1 |
Mmasi, Índice de gravidade do melasma (modificado).
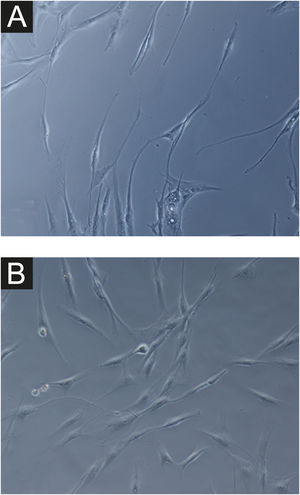
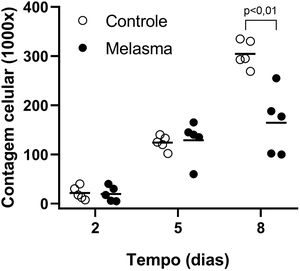
Em todas as amostras, as culturas de fibroblastos da pele do melasma foram de menor densidade celular, e morfologicamente menos alongados, mais largos, menos fusiformes, além de apresentar mais células marcadas com SA‐β‐gal (superioridade média de 34%; 95% IC 4‐63%; p < 0,05) do que as culturas oriundas da pele adjacente (figs. 1 e 2). Além disso, a taxa de crescimento celular foi menor para as amostras de melasma após oito dias em cultura (p < 0,01) (fig. 3).
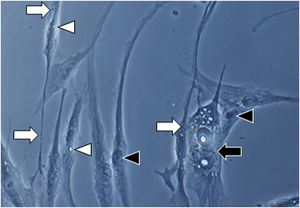
Em ampliação da Figura 1A (1000×): morfologia senescente dos fibroblastos da pele com melasma, evidenciando maior proporção de corpos justanucleares (seta preta), estruturas citoplasmáticas (SA‐β‐gal +) granulares frequentes (seta branca), gotículas de lipídeos (cabeça de seta branca), e nucléolos segmentados (cabeça de seta preta).
Curvas de crescimento dos fibroblastos (contagem de células por cm2) para cinco pacientes: pele sã e com melasma facial. Barra linha horizontal representa a média de cada amostra. Dados comparados longitudinalmente por modelo linear generalizado de efeitos mistos.
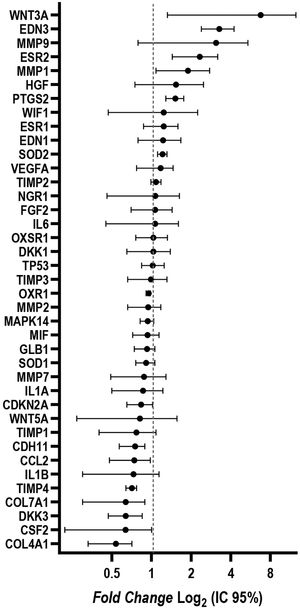
Foram identificadas alterações na expressão gênica dos fibroblastos isoladas da pele com melasma em comparação com aqueles isoladas da pele sã adjacente. Os genes WNT3A, EDN3, ESR2, PTG2, MMP1 e SOD2 estavam regulados positivamente (up‐regulated); já os genes COL4A1, CSF2, DKK3, COL7A1, TIMP4, CCL2 e CDH11 estavam regulados negativamente (down‐regulated) (fig. 4).
DiscussãoA melanogênese é processo complexo mediado por estímulos parácrinos, autócrinos e ambientais.13 As alterações fenotípicas evidenciadas na pele com melasma não decorrem primariamente ou unicamente de alteração epidérmica, uma vez que diversas alterações dérmicas são evidentes na pele acometida em comparação com a pele fotoexposta sã adjacente.14
O fibroblasto é o tipo celular mais comum na derme e, em virtude de sua grande longevidade, acumula danos em seu maquinário celular, que podem resultar em alterações funcionais e morfológicas.10 O envelhecimento intrínseco e o fotoenvelhecimento estão associados à diminuição no número e na taxa de proliferação de fibroblastos; neste contexto, a comparação do perfil gênico de fibroblastos oriundos da pele com melasma com o de área fotoexposta adjacente sã reforça que as alterações gênicas são independentes da idade e da fotoexposição.3,15
Considerando a importância dos fibroblastos dérmicos na regulação da pigmentação, as modificações de suas atividades autócrinas e parácrinas podem influenciar as desordens pigmentares.10 Neste estudo, identificamos perda da morfologia fusiforme, maior quantidade de SA‐β‐gal citoplasmático e menor taxa de crescimento nos fibroblastos da pele com melasma. Essas alterações morfológicas e metabólicas endossam um fenótipo senescente nos fibroblastos da pele com melasma.
A senescência é fator central nos mecanismos de envelhecimento, e o fenótipo secretor associado à senescência (senescence‐associated secretory phenotype ‐ SASP) é conhecido por ser o principal desencadeante dos fenótipos relacionados à idade, como rugas e pigmentação.16 Deve‐se ressaltar que há evidências sobre diferenças fenotípicas relacionadas à etnia e suscetibilidade à senescência de fibroblastos.17
Fibroblastos senescentes secretam citocinas inflamatórias e stem cell factor, que promovem a degradação do colágeno por meio da ativação de MMPs, e têm potencial mitótico reduzido. Há aumento da degradação do estroma e comprometimento no reparo tecidual, conforme evidenciado na derme do melasma. Portanto, uma estrutura em mosaico de suscetibilidade tecidual à senescência pode ser teorizada para o desenvolvimento do melasma em uma pele sob estímulos ambientais, como radiação UV, e hormônios sexuais.18
Houve aumento da expressão gênica de MMP1 e diminuição da expressão dos colágenos IV, VII (COL4A1, COL7A1) e TIMP4 nos fibroblastos isolados da pele com melasma. Durante o processo de senescência, há aumento progressivo da produção de metaloproteinase e diminuição do processo de reparo.10 Além disso, nos fibroblastos dérmicos, o α‐MSH promove upregulation da colagenase intersticial e atenua a síntese de colágeno induzida por TGFβ1. Já os danos à derme superior e à zona da membrana basal facilitam o trânsito de fatores melanogênicos para a camada basal. Neste estudo, apesar de uma implicação marginal, MMP9 demonstrou uma alta fold change (> 2), o que, em associação com a expressão mais baixa de TIMP1 e 4, sugere participação dos fibroblastos da pele com melasma no reparo deficiente da derme superior e angiogênese.
O papel dos hormônios sexuais na expressão cutânea do receptor de estrógeno β no melasma está bem estabelecido.19 Em geral, o ESR2 é expresso durante o processo de reparo.20 A derme superior e a membrana basal estão muito danificadas na pele com melasma, em comparação com a pele fotoexposta adjacente sã e a pele fotoprotegida.1,14 Além disso, o estrógeno, α‐MSH e HGF estimulam a melanogênese pela ligação direta ao receptor do melanócito e também são liberados durante o processo de cicatrização de feridas.21,22 Esses achados indicam que o processo crômico e malsucedido de reparo da derme superior pode induzir melanogênese no melasma.
Alguns genes relacionados à via Wnt/β‐catenina apresentaram comportamento distinto nos fibroblastos de pele com melasma em relação a pele adjacente fotoexposta; o fator inibitório DKK3 apresentou down‐regulation, enquanto WNT3A estava superexpresso. WNT3A desempenha um papel importante no controle da proliferação e diferenciação de precursores de melanócitos e angiogênese. Em melanócitos maduros, o WNT3A aumenta a quantidade de melanina e a atividade da tirosinase.23 A via Wnt está envolvida na fisiopatologia do melasma, e a diminuição da expressão do fator inibitório DKK3 nos fibroblastos pode influenciar a ativação epidérmica de WNT1.4 Além disso, WNT3A é importante para o processo de reparo tecidual, podendo ser ativado em decorrência dos danos à derme superior.24
EDN3 é peptídeo de 21 aminoácidos e ativa preferencialmente EDNRB.25 A sinalização de EDN3 é importante no desenvolvimento normal dos melanócitos da epiderme e da coroide, atuando durante a proliferação, diferenciação e sobrevivência celular.26 Queratinócitos expostos ao ultravioleta B aumentam a produção e a secreção de EDN, fazendo com que os melanócitos adjacentes ativem a cascata melanogênica. Além disso, melanócitos expostos a essa mesma radiação têm aumento na expressão de c‐KIT e EDNRB.26 EDN3 também participa da quimiotaxia de fibroblastos, independentemente de prolongar a sobrevivência e diferenciação celular.27
Fibroblastos senescentes estão associados à deficiência nas respostas imunológicas e na supressão tumoral da pele, mas o SASP pode variar entre os tecidos e tipos de estímulo.28 O CSF participa do crescimento, da diferenciação e da sobrevivência dos melanócitos, bem como do recrutamento de células‐tronco. Queratinócitos expostos à RUV do tipo A in vitro apresentam um nível mais elevado de CSF.29 Além disso, a IL‐1 produzida por queratinócitos induz fibroblastos a sintetizar CSF, o que promove a proliferação e a diferenciação de queratinócitos. Uma diminuição de CSF nos fibroblastos senescentes pode configurar redução nos estímulos aos queratinócitos, o que dificulta o reparo ao tecido danificado.30
CCL2 é quimiocina que atua como regulador crítico no recrutamento de macrófagos e células‐tronco durante a cicatrização de feridas, no câncer e em infecções.31 Após a estimulação celular com lipopolissacarídeo, há uma down‐regulation constitucional de CCL2 nos melanócitos de indivíduos melanodérmicos em comparação com os melanócitos de indivíduos de fototipo baixo.32 O perfil de expressão de CCL2 nos fibroblastos pode induzir o fenótipo focal mais escuro do melasma.
As proteínas da família das caderinas desempenham papel importante na regulação da adesão intercelular e na síntese da matriz extracelular, além de contribuírem para a sinalização de eventos que controlam a homeostase celular.33 Nos fibroblastos da pele, CDH11 regula a síntese de colágeno e elastina, e sua down‐regulation pode influenciar uma diminuição no reparo da derme na pele com melasma.34
A superóxido dismutase (SOD) é parte do sistema antioxidante enzimático e é a principal enzima responsável pela depuração dos radicais livres de oxigênio, por meio da conversão de ânions superóxido em peróxido de hidrogênio e oxigênio.35 A SOD é um complexo de enzimas intracelulares, e o nível sérico de SOD é maior entre os pacientes com melasma quando comparados aos controles, o que indica aumento do estado oxidativo sistêmico e reforça o uso de antioxidantes no tratamento do melasma.36 SOD2 é uma enzima mitocondrial tetramérica que contém manganês e é direcionada ao espaço intermembrana mitocondrial. O aumento de SOD2 identificado nos fibroblastos é induzido por ambiente de estresse oxidativo e pode ser resultado de múltiplas citocinas inflamatórias; além disso, é um fenótipo característico em fibroblastos senescentes.35,37
A célula cutânea que mais contém PTGS é o fibroblasto. Essa enzima participa da síntese de prostaglandina E2 (PGE2) a partir do ácido araquidônico, e a PGE2 inibe in vitro a produção de colágeno pelos fibroblastos.38 A indução de PTGS é notável em células senescentes, que aumentam a liberação de PGE2, levando a redução na síntese de colágeno tipo I, vasodilatação e quimiotaxia.38 Além disso, o PGE2 pode induzir diretamente a melanogênese e aumento de dendritos nos melanócitos após irradiação com UV.39,40 O fenótipo pró‐inflamatório dos fibroblastos no melasma pode induzir dano à derme superior e uma melanogênese sustentada.
Este estudo tem limitações relacionadas ao pequeno tamanho amostral e à falta de ensaios proteômicos ou funcionais para confirmar os achados. No entanto, os resultados foram consistentes e permitiram explorar, de modo preliminar, a hipótese sobre o papel dos fibroblastos na patogênese do melasma, prospectando novas investigações ligadas à patogênese e estratégias terapêuticas do melasma. A amostra de pacientes submetida ao ensaio de senescência e de proliferação foi diferente da submetida à comparação da expressão gênica, apesar de os resultados serem paralelos. Finalmente, a investigação de fibroblastos oriundos de controles sem melasma, pareados por idade, padrão de fotoexposição, fotoenvelhecimento e fototipo, poderia também elucidar a respeito da suscetibilidade individual dos fibroblastos de portadoras de melasma à senescência.
Novos estudos devem investigar os fatores regulatórios dessas vias e a rede de citocinas entre queratinócitos, melanócitos, nervos, endotélio e fibroblastos no melasma, preferencialmente por meio de estudos com culturas teciduais, para experimentos genômicos, proteômicos e funcionais.
ConclusõesOs fibroblastos da pele com melasma apresentaram menor taxa de crescimento, morfologia menos fusiforme e maior acúmulo de SA‐β‐gal do que os da pele fotoexposta sã adjacente. Além disso, seu perfil de expressão gênica compreendeu fatores pró‐inflamatórios, pró‐melanogênicos e relacionados ao déficit de reparo tecidual, o que pode induzir dano à derme superior e sustentar o fenótipo pigmentar focal no melasma.
FinanciamentoFAPESP – n° 2012/09233‐5, 2012/05004‐1; CNPq – n° 401309/2016‐9.
Contribuição dos autoresAna Cláudia Cavalcante Espósito: Concepção e planejamento do estudo; Obtenção, análise e interpretação dos dados; Redação do artigo; Revisão crítica de literatura; Aprovação da versão final do manuscrito.
Gabrielli Brianezi: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Luciane Donida Bartoli Miot: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Hélio Amante Miot: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; análise estatística; redação do artigo; revisão crítica de literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Espósito ACC, Brianezi G, Miot LDB, Miot HA. Fibroblast morphology, growth rate and gene expression in facial melasma. An Bras Dermatol. 2022;97:575–82.
Trabalho realizado no Departamento de Dermatologia e Radioterapia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.