A urticária crônica espontânea (UCE) é caracterizada por urticas e/ou angioedema recorrentes por mais de seis semanas. As diretrizes recomendam omalizumabe (Oma) como tratamento de primeira linha e ciclosporina‐A (CsA) como tratamento de segunda linha em UCE resistentes aos anti‐histamínicos. Esse algoritmo gradativo pode ser demorado e caro.
ObjetivoDeterminar indicadores de resposta ao Oma ou à CsA em pacientes com UCE.
MétodosForam analisados retrospectivamente dados de sete centros da Turquia; os critérios de inclusão para os pacientes foram receber tratamento com Oma e CsA (não simultaneamente) em algum momento durante o seguimento. As características clínicas e laboratoriais foram analisadas e comparadas entre os grupos.
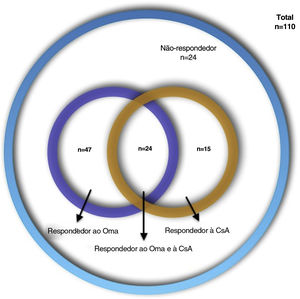
ResultadosDe 110 pacientes com UCE, 47 (42,7%) responderam ao Oma, 15 (13,6%) responderam à CsA, 24 (21,8%) responderam ao Oma e à CsA e 24 (21,8%) não responderam a nenhum dos dois medicamentos. Níveis elevados de PCR foram mais frequentes em respondedores à CsA (72,7% vs. 40,3%; p=0,055). Os respondedores ao Oma tiveram escores ao teste de controle da urticária (UCT) basais mais altos (6 vs. 4,5; p=0,045). Os respondedores a ambos os medicamentos tiveram menos angioedema e escores UCT basais mais altos em comparação com outros grupos (33,3% vs. 62,8%; p=0,01 e 8 vs. 5; p=0,017). Os não‐respondedores a ambos os medicamentos apresentaram maior frequência no sexo feminino e escores UCT basais mais baixos em comparação aos outros grupos (87,5% vs. 61,6%; p=0,017 e 5 vs. 7; p=0,06).
Limitações do estudoNatureza retrospectiva, não haver números iguais de pacientes em cada grupo, número limitado de pacientes, nenhum grupo controle, falta de teste de ativação de basófilos (BAT) ou teste de BHRA (ensaio de liberação de histamina de basófilos).
ConclusõesA avaliação basal da atividade da doença, que considera a presença de angioedema e escores de atividade da doença, sexo e níveis de PCR, pode ser útil para prever os resultados do tratamento em pacientes com UCE e escolher o tratamento mais adequado para cada paciente. A categorização de pacientes em endótipos específicos pode otimizar e aumentar o sucesso do tratamento.
A urticária crônica espontânea (UCE) é definida como urticas e/ou angioedema por mais de seis semanas. A principal célula efetora na fisiopatologia da doença é o mastócito, que sofre degranulação após estímulo, principalmente via FcɛR1 de alta afinidade e leva à liberação de vários mediadores e resulta no recrutamento de células como basófilos, eosinófilos e linfócitos T.1,2 É amplamente aceito que mecanismos autoimunes desempenham papel importante na ativação dos mastócitos. Na UCE, postulam‐se dois tipos de autoimunidade: 1) autoimunidade tipo I (também chamada de autoalergia), na qual participam autoanticorpos IgE e 2) autoimunidade tipo IIb, na qual autoanticorpos IgG contra autoantígenos ativam receptores de mastócitos.3 As International Urticaria Guidelines recomendam omalizumabe (Oma) como tratamento de primeira linha na UCE resistente aos anti‐histamínicos (pacientes que não respondem a doses quatro vezes maiores de anti‐histamínicos H1), enquanto ciclosporina‐A (CsA) é recomendada para pacientes que apresentam falha no tratamento com Oma. Embora esse algoritmo gradativo tenha sido adotado, ele pode ser demorado, caro e pode não ser adequado para todos os pacientes com UCE.1 Já houve tentativas de encontrar biomarcadores ou características clínicas que definam a resposta ao tratamento em pacientes com UCE, e o teste de soro autólogo, ensaio de liberação de histamina de basófilos (BHRA), níveis totais de IgE, d‐dímero e PCR são alguns dos biomarcadores que foram identificados como associados à resposta ao tratamento com Oma ou CsA.4 Entretanto, muitos dos estudos realizados para determinar biomarcadores concentraram‐se em um determinado medicamento, neste caso Oma ou CsA, mas faltam estudos comparando respondedores ao Oma com respondedores à CsA. O objetivo do presente estudo foi determinar se características específicas dos pacientes ou marcadores laboratoriais poderiam ser utilizados como indicadores de resposta ao Oma ou à CsA em pacientes com UCE.
MétodosForam analisados retrospectivamente os arquivos de pacientes de sete centros da Turquia (Okmeydani Training and Research Hospital, Istanbul; Uludag University, School of Medicine, Bursa; Bezmialem Vakif University, School of Medicine, Istanbul; Istanbul Medipol University, School of Medicine, Istanbul; Istanbul University, Cerrahpasa School of Medicine, Istanbul; Hacettepe University, School of Medicine, Ankara; Akdeniz University, School of Medicine, Antalya) com experiência no tratamento de pacientes com UCE. O diagnóstico de UCE foi realizado com base no exame físico e na história do paciente. Os pacientes foram considerados resistentes aos anti‐histamínicos quando não responderam a doses quatro vezes maiores de anti‐histamínicos H1. Os critérios de inclusão para pacientes com UCE foram:
- 1.
Ter UCE por mais de seis semanas;
- 2.
Ser maior de 18 anos;
- 3.
Não estar grávida ou amamentando;
- 4.
Ter sido submetido a uma tentativa de tratamento com Oma e CsA (não simultaneamente) durante o curso da doença por pelo menos três meses para decidir se houve resposta ao tratamento ou não;
- 5.
Incluir os escores do teste de controle de urticária (UCT, do inglês urticaria control test) e haver dados clínicos e laboratoriais suficientes nos arquivos.
Os critérios de exclusão foram:
- 1.
Urticária crônica induzida;
- 2.
Pacientes menores de 18 anos;
- 3.
Tratamento com CsA e Oma simultaneamente.
A resposta ao tratamento foi definida pelos escores do UCT (UCT ≥ 12, sob controle). Quatro grupos de pacientes foram definidos de acordo com as respostas ao tratamento:
- 1.
Pacientes que respondem apenas ao Oma (não respondem à CsA) – Oma−resp+;
- 2.
Pacientes que respondem apenas à CsA (não respondem ao Oma) – CsA−resp+;
- 3.
Pacientes que respondem ao Oma e à CsA – Oma−CsA−resp+;
- 4.
Pacientes que não respondem a nenhum dos medicamentos (Oma−CsA−resp−).
Foi realizada comparação entre todos os grupos de resposta em relação às características como idade, sexo, história familiar, presença de angioedema, duração da doença, urticária induzida (UI), escores UCT basais e marcadores laboratoriais, como o teste cutâneo com soro autólogo (ASST, autologous serum skin test), níveis altos de PCR, VHS, eosinopenia, basopenia, níveis baixos de IgE total, presença de doença autoimune da tireoide, bem como positividade para anticorpo antiperoxidase tireoidiana (anti‐TPO) e antitireoglobulina (anti‐TG).
A aprovação ética foi obtida do Comitê de Ética do centro coordenador do Okmeydani Training and Research Hospital (23/05/2017; número 98‐667).
DefiniçõesAltos níveis de PCR: ≥ 5mg/L;
Altos níveis de VHS: ≥ 20mm/h;
Basopenia <0,01 × 109/L;
Eosinopenia <0,05 × 109/L;
Baixos níveis de IgE total, <43 UI/mL;
Doença autoimune da tireoide (AIT): diagnóstico estabelecido de AIT encontrado nos arquivos dos pacientes (não apenas da positividade ao anti‐TPO/anti‐TG);
Alta atividade de doença UCT <6.
Análise estatísticaAs características basais foram descritas como médias e desvios‐padrão (DP) para variáveis contínuas e frequências e porcentagens para variáveis categóricas. O teste Qui‐Quadrado de Pearson e o teste exato de Fisher foram usados para comparação de grupos de variáveis categóricas. O teste U de Mann‐Whitney foi utilizado para as comparações das variáveis contínuas entre os grupos. Acredita‐se que somente um nível baixo de IgE pode ser considerado tendo uma associação com os resultados do tratamento com CsA5 que confundiria as associações apresentadas em artigos anteriores, embora não esteja totalmente confirmada. Portanto, foram utilizados modelos de regressão logística multinomial para calcular ORs ajustados para níveis baixos (< 43) de IgE (aAORs) para examinar as associações entre os resultados do tratamento com CsA para UCE. Os valores bilaterais de p <0,05 foram considerados estatisticamente significantes.
ResultadosForam incluídos 110 prontuários de pacientes com UCE de sete centros (74 mulheres [67,3%], com média de idade de 40,98± 12,37; variação: 16‐81 anos, e duração média da doença de 57,21±69,31 meses; variação: 6‐402 meses). As características demográficas dos pacientes são apresentadas na tabela 1. Quatro tipos de respostas ao tratamento foram assim distribuídos: 47 (42,7%) Oma−resp+, 15 (13,6%) CsA−resp+, 24 (21,8%) Oma−CsA−resp+ e 24 (21,8%) Oma−CsA−resp− (fig. 1). Os achados laboratoriais dos pacientes são apresentados na tabela 2. Diferenças estatisticamente significantes, bem como características estatisticamente não significantes, porém mais frequentes, são apresentadas na tabela 3.
Características demográficas e clínico-laboratoriais dos pacientes
| Parâmetros clínicos | Total (n=110, %) | Respondedor ao omalizumabe (n=47, 42,7%) | Respondedor à ciclosporina (n=15, 13,6%) | Respondedor a ambos(n=24,21,8%) | Não respondedor (n=24, 21,8%) |
|---|---|---|---|---|---|
| Idade em anos | |||||
| Mín‐Máx (Mediana) | 16‐81 (39) | 27‐81 (42) | 16‐73 (37) | 21‐66 (34,5) | 20‐69 (37) |
| Média±DP | 40,98±12,37 | 43,32±10,67 | 40,20±16,52 | 37,79±12,18 | 40,08±12,64 |
| Sexo n (%) | |||||
| Masculino | 36 (32,7%) | 18 (38,3%) | 6 (40%) | 9 (37,5) | 3 (12,5) |
| Feminino | 74 (67,3%) | 29 (61,7%) | 9 (60%) | 15 (62,5%) | 21 (87,5%) |
| Acompanhado de UCI n (%) | n=99 | n=43 | n=15 | n=17 | n=24 |
| 21 (21,2%) | 9 (20,9%) | 3 (20%) | 3 (17,6%) | 6 (25%) | |
| Duração da doença (meses) | |||||
| Mín‐Máx (Mediana) | 0‐402 (30) | 2‐300 (30) | 3‐120 (36) | 0‐264 (25) | 5‐402 (36) |
| Média±DP | 57,21±69,31 | 60,32±71,26 | 45,53±38,33 | 51,46±63,72 | 64,17±86,37 |
| Angioedema, n (%) | 62 (56,4%) | 27 (57,4%) | 10 (66,7%) | 8 (33,3%) | 17 (70,8%) |
| UCT basal | n=83 | n=41 | n=8 | n=16 | n=18 |
| Mín‐Máx (Mediana) | 0‐16 (6) | 1‐16 (6) | 2‐9 (3) | 3‐16 (8) | 0‐11 (5) |
| Média±DP | 7±4,34 | 7,44±4,65 | 4,75±3,06 | 9,12±3,81 | 5,11±3,53 |
| UCT ≥ 6 | 46 (55,4%) | 23 (56,1%) | 3 (37,5%) | 13 (81,2%) | 7 (38,9%) |
| UCT <6 | 37 (44,6%) | 18 (43,9%) | 5 (62,5%) | 3 (18,8%) | 11 (61,1%) |
| História familiar positiva, n (%) | 11 (10%) | 2 (4,3%) | 3 (20%) | 3 (12,5%) | 3 (12,5%) |
UCI, urticária crônica induzida; UCT, teste de controle da urticária.
Achados laboratoriais dos pacientes em cada grupo
| Achado laboratorial | Total (n=1100%) | Respondedor ao omalizumabe(n=47, 42,7%) | Respondedor à ciclosporina (n=15, 13,6%) | Respondedor a ambos (n=24, 21,8%) | Não respondedor (n=24, 21,8%) |
|---|---|---|---|---|---|
| Altos níveis de PCR | n=88 | n=38 | n=11 | n=21 | n=18 |
| 39 (44,3%) | 16 (42,1%) | 8 (72,7%) | 7 (33,3%) | 8 (44,4%) | |
| Altos níveis de VHS | n=99 | n=44 | n=13 | n=21 | n=21 |
| 39 (39,4%) | 15 (34,1%) | 8 (61,5%) | 9 (42,9%) | 7 (33,3%) | |
| Eosinopenia | n=54 | n=23 | n=10 | n=9 | n=12 |
| 3 (5,6%) | 0 | 2 (20%) | 0 | 1 (8,3%) | |
| Basopenia | n=102 | n=46 | n=12 | n=24 | n=20 |
| 4 (3,9%) | 1 (2,2%) | 2 (16,7%) | 0 | 1 (5%) | |
| Positividade no ASST | n=77 | n=36 | n=7 | n=17 | n=17 |
| 44 (57,1%) | 19 (52,8%) | 5 (71,4%) | 10 (58,8%) | 10 (58,8%) | |
| Níveis séricos totais de IgE (IU/mL) | 2,03‐6350 (167) | 3,28‐6350 (169) | 2,03‐1282 (280) | 6,43‐1606 (150) | 9‐1434 (172) |
| 370,65±727,22 | 476,35±1000,81 | 343,27±392,27 | 252,58±368,81 | 271,05±328,70 | |
| Níveis séricos totais de IgE <43 (IU/mL) | n=94 | n=43 | n=12 | n=18 | n=21 |
| 23 (24,5%) | 9 (20,9%) | 5 (41,7%) | 3 (16,7%) | 6 (28,6%) | |
| Doença autoimune da tireoide | n=81 | n=35 | n=9 | n=20 | n=17 |
| 17 (21%) | 8 (22,9%) | 2 (22,2%) | 2 (10%) | 5 (29,4%) | |
| Altos níveis de anticorpo anti‐TPO, n (%) | n=72 | n=29 | n=8 | n=19 | n=16 |
| 25 (34,7%) | 11 (37,9%) | 4 (50%) | 4 (21,1%) | 6 (37,5%) | |
| Altos níveis de anticorpo anti‐TG, n (%) | n=66 | n=25 | n=8 | n=19 | n=14 |
| 18 (27,3%) | 8 (32%) | 2 (25%) | 3 (15,8%) | 5 (35,7%) | |
| Antígeno para H. pylori positivo nas fezes, n (%) | n=87 | n=41 | n=12 | n=19 | n=15 |
| 31 (35,6%) | 13 (31,7%) | 4 (33,3%) | 7 (36,8%) | 7 (46,7%) |
anti‐TG, anticorpo antitireoglobulina; anti‐TPO, anticorpos antiperoxidase; PCR, proteína C reativa; VHS, velocidade de hemossedimentação; H. pylori, Helicobacter pylori.
Demonstração de características estatisticamente significantes e não significantes porém mais frequentes, observadas nos grupos de resposta ao tratamento da UCE
| Grupo tratamento | p <0,05 | p> 0,05 |
|---|---|---|
| Respondedores ao Oma (somente) vs. respondedores à CsA (somente) | Nenhum | Mais frequente em respondedores à CsA: ASST positivo, história familiar positiva, PCR alta, basopenia, eosinopenia, VHS alta, níveis baixos de IgE total, positividade para anti‐TPO, escores UCT basais mais baixos |
| Respondedores ao Oma vs. não respondedores ao Oma | Mais alto em respondedores ao Oma: escore UCT basal | Mais frequentes em respondedores ao Oma: sexo masculino, menores taxas de positividade para ASST, menores taxas de história familiar, menor frequência de PCR alta, menor frequência de eosinopenia, menor frequência de basopenia, menor frequência de altos níveis de VHS, menor frequência de angioedema, menor frequência de doença autoimune da tireoide, maior frequência de níveis totais de IgE> 43 |
| Respondedores à CsA vs. não respondedores à CsA | Mais frequente em respondedores à CsA: Altos níveis de PCR | Mais frequente em respondedores à CsA: história familiar positiva, ASST positivo, eosinopenia, basopenia, altos níveis de VHS, níveis mais baixos de IgE total, positividade anti‐TPO, escores UCT basais mais baixos |
| Respondedores a ambos os medicamentos vs. outros três grupos | Mais frequente em respondedores a ambos os medicamentos: menor frequência de angioedema, maior UCT basal | Menos frequente em respondedores a ambos os medicamentos: PCR alta, eosinopenia, basopenia, doença autoimune da tireoide, positividade para anti‐TPO, positividade para anti‐TG |
| Não respondedores a ambos os medicamentos vs. outros três grupos | Maior frequência em não respondedores: sexo feminino, UCT basal inferior | Maior frequência em não respondedores: Angioedema, doença autoimune da tireoide, positividade anti‐TG, H. pylori |
| Respondedores à CsA versus não respondedores a CsA | Mais frequente em respondedores à CsA: PCR alta | Mais frequente em respondedores à CsA: história familiar positiva, ASST positivo, eosinopenia, basopenia, altos níveis de VHS, níveis mais baixos de IgE total, positividade para anti‐TPO, escores UCT basais mais baixos |
anti‐TPO, anticorpo antitireoide peroxidase; anti‐TG, anticorpo antitireoglobulina; ASST, teste cutâneo com soro autólogo; PCR, proteína C reativa; CsA, ciclosporina‐A; VHS, velocidade de hemossedimentação; H. pilori, Helicobacter pylori; Oma, omalizumabe; UCT, teste de controle de urticária.
Quando foi feita a comparação entre os pacientes que responderam apenas ao Oma (n=47) e apenas à CsA (n=15), não houve diferenças estatisticamente significantes entre os grupos quanto aos parâmetros clínicos e laboratoriais. Mas o ASST positivo (52,8% vs. 71,4%; p=0,47), história familiar positiva (4,3% vs. 20%; p=0,086), níveis elevados de PCR (42,1% vs. 72,7%; p=0,074), basopenia (2,2% vs. 16,7%; p=0,10), eosinopenia (0 vs. 20%; p=0,08), altos níveis de VHS (34,1% vs. 61,5%; p=0,07), baixos níveis de IgE total (20,9% vs. 41,7%; p=0,259), positividade para anti‐TPO (37,9% vs. 50%; p=0,69) e escores UCT basais mais baixos (6 vs. 3; p=0,122) foram mais frequentes no grupo CsA−resp+, mesmo que as diferenças não tenham sido estatisticamente significantes.
Respondedores ao Oma têm escores UCT de linha basal mais altos em comparação com os não respondedores ao OmaQuando o grupo Oma−resp+ (n=47) foi comparado com o Oma−resp− (Oma−CsA−resp− e CsA−resp+; n=39), o único parâmetro estatisticamente significante foi o escore UCT inicial, o qual foi 6 vs. 4,5 em Oma−resp+vs. CsA−resp+ e Oma−CsA−resp−, respectivamente (p=0,045). Outras características que foram observadas sem significância estatística no grupo Oma−resp+ foram maior taxa de pacientes do sexo masculino (38,3% vs. 23,1%; p=0,13), menor proporção de positividade no ASST (52,8% vs. 62,5%; p=0,45), menor proporção de história familiar (4,3% vs. 15,4%; p=0,13), menor frequência de PCR alta (42,1% vs. 55,2%; p=0,29), menor frequência de eosinopenia (0% vs. 13,6%; p=0,10), menor frequência de basopenia (2,2% vs. 9,4%; p=0,30), menor frequência de altos níveis de VHS (34,1% vs. 44,1%; p=0,36), menor frequência de angioedema (57,4% vs. 69,2%; p=0,26), menor frequência de doença autoimune da tireoide (22,9% vs. 26,9%; p=0,71) e maior frequência de IgE total> 43 (79,1% vs. 66,7%; p=0,22).
Níveis elevados de PCR são mais frequentes em respondedores à CsA em comparação com não respondedores à CsAA única diferença estatisticamente significante entre CsA−resp+ (n=15) e CsA−resp− (Oma−CsA−resp−, Oma−resp+ e Oma−CsA−resp+; n=95) foram altos níveis de PCR, o que foi mais frequente em CsA−resp+ (72,7% vs. 40,3%; OR=3,96, IC 95% 0,97‐16,1; p=0,05) e ter altos níveis de PCR aumentou a chance de resposta favorável ao tratamento com CsA em 6,1 após ajuste para níveis baixos de IgE total (ORa=6,1; IC 95% 1,17‐31,8; p=0,032).
História familiar positiva (20% vs. 8,4%; p=0,172), ASST positivo (71,4% vs. 55,7%; p=0,692), eosinopenia (20% vs. 2,3%; p=0,085), basopenia (16,7% vs. 2,2%; p=0,067), altos níveis de VHS (61,5% vs. 36%; p=0,08), níveis mais baixos de IgE total (41,7% vs. 22%; p=0,159), positividade anti‐TPO (50% vs. 32,8%; p=0,436), escores UCT basais mais baixos (3 vs. 7; p=0,107) foram mais frequentes, embora sem significância estatística, no grupo CsA−resp+.
Sexo feminino e escore UCT de linha basal mais baixo foram mais frequentes em não respondedores a qualquer um dos dois medicamentosOs não respondedores a qualquer um dos dois medicamentos foram comparados com os grupos respondedores (Oma−resp+, CsA−resp+ e Oma−CsA−resp+) e a comparação revelou que a maioria dos Oma−CsA−resp− era do sexo feminino (21; 87,5% vs. 53; 61,6%; p=0,017) e o escore UCT basal foi menor em Oma−CsA−resp− (5 vs. 7; p=0,06).
Respondedores a ambos os medicamentos tiveram menos angioedema e escore UCT basal mais altoO grupo Oma−CsA−resp+ foi comparado com o restante dos pacientes (Oma−resp+, CsA−resp+ e Oma−CsA−resp−). A frequência de angioedema foi menor (8; 33,3% vs. 54; 62,8%; p=0,01) e o escore UCT de linha basal foi maior no grupo Oma−CsA−resp+ (8 vs. 5; p=0,017).
DiscussãoO presente estudo mostrou que, em uma subpopulação de pacientes com UCE refratária aos anti‐histamínicos que receberam Oma e CsA em algum momento durante o seguimento, a maioria (40%) respondeu ao Oma, a minoria (10%) respondeu à CsA, enquanto 20% responderam a ambos, e outros 20% não responderam a nenhum dos dois medicamentos (resumo dos achados na tabela 4). Esses achados são interessantes em virtude dos relatos de altas taxas de resposta de pacientes com UCE ao tratamento com CsA, que variaram de 38 a 100%.6 Seria esperado que mais pacientes respondessem ao tratamento com CsA; entretanto, após um exame cuidadoso dos achados clínicos e laboratoriais da população de pacientes do presente estudo, verificou‐se que 65% da população de pacientes tinha níveis elevados de IgE total (> 100 UI/mL),o que foi relatado como uma característica da UCE autoimune tipo I e um fator desfavorável para a resposta ao tratamento com CsA.3,5 Maurer et al.3 descreveram algumas características da UCE autoimune tipo I versus tipo IIb e apontaram que a presença de auto‐IgE (p. ex., contra TPO, IL‐24, ds‐DNA), taxas mais altas de doenças alérgicas concomitantes, níveis de IgE total normais ou elevados e alta taxa de resposta ao Oma favorecem a UCE autoimune tipo I, enquanto a presença de auto‐IgG (contra IgE, FcɛRI), maior atividade da doença, maior duração da doença, maiores taxas de doenças autoimunes concomitantes, menores níveis de IgE total, maiores taxas de eosinopenia e basopenia, níveis mais elevados de PCR, maiores taxas de positividade para ANA, indicam baixa taxa de resposta ou resposta mais lenta ao Oma e boa resposta ao tratamento imunossupressor. Com base nessa classificação de endótipo, é possível explicar por que a taxa de resposta à CsA é baixa nessa população de pacientes; acredita‐se na baixa frequência de pacientes com eosinopenia, basopenia, baixos níveis de IgE, altos níveis de PCR e alta gravidade da doença; mas a alta frequência de pacientes com altos níveis de IgE total mostra que a maioria dessa população de pacientes é composta por UCE autoimune tipo I e, portanto, mais propensa a responder ao tratamento com Oma.
O que já se sabe sobre o tema, o que este artigo acrescenta?
| O que já se sabe sobre o tema? | O que este artigo acrescenta? |
|---|---|
| A autoimunidade na UCE foi classificada em mecanismos autoimunes tipo 1 (tipo IgE autoalérgico) e mecanismos autoimunes tipo 2b (tipo IgG). Esses dois tipos têm sido associados a diferentes características clínicas e laboratoriais e padrões de resposta ao tratamento. A urticária autoimune tipo 1 está associada a anticorpos IgE contra autoantígenos, taxas mais altas de doenças alérgicas concomitantes, níveis de IgE total normais ou altos e altas taxas de resposta a omalizumabe. A urticária autoimune tipo 2b está associada a anticorpos IgG contra autoantígenos, positividade para BHRA, BAT, ASST, doença mais grave com maior duração, maiores taxas de doenças autoimunes concomitantes, maiores taxas de basopenia e eosinopenia, níveis mais baixos de IgE total, níveis mais altos de PCR, positividade de ANA mais alta, baixas taxas de resposta a anti‐histamínicos e omalizumabe, maiores taxas de resposta à terapia imunossupressora. | Foram encontrados dois tipos distintos de endótipos de UCE de acordo com seus padrões de resposta ao tratamento que são compatíveis com os dois diferentes endótipos de urticária autoimune; os respondedores ao Oma tendem a ser mais frequentemente do sexo masculino, com atividade de doença mais baixa (escores UCT basais mais altos) e com taxas mais baixas de positividade no ASST, taxas mais baixas de história familiar, níveis mais baixos de PCR, taxas mais baixas de basopenia e eosinopenia, níveis mais baixos de VHS, menor frequência de angioedema, menor frequência de doença autoimune da tireoide e níveis mais elevados de IgE total. Estas são características que foram associadas à autoimunidade tipo 1 (tipo IgE). Os respondedores à CsA apresentaram níveis mais altos de PCR e maior frequência de história familiar positiva, ASST positivo, eosinopenia, basopenia, níveis mais altos de VHS, maior frequência de positividade anti‐TPO, níveis mais baixos de IgE total e maior atividade da doença (escores UCT basais mais baixos). Estas são características que foram associadas à autoimunidade tipo 2b (tipo IgG). |
| Os biomarcadores para a resposta ao Oma foram relatados como altos níveis de IgE total, negatividade no ASST, negatividade no BHRA, falta de atividade de up‐regulação de basófilos CD203c, alta expressão de basófilos FcɛRI e níveis mais baixos de IL‐31, enquanto biomarcadores para resposta à ciclosporina foram relatados como positividade de BHRA, níveis mais altos de PCR, baixos níveis de IgE total, positividade no ASST, baixos níveis de dímero‐D, alta atividade da doença e curta duração da doença | Os não respondedores a nenhum dos dois medicamentos são mais frequentemente do sexo feminino, com maior atividade da doença e com mais angioedema, doença autoimune da tireoide, autoanticorpos da tireoide e positividade para H. pylori. |
anti‐TPO, anticorpo antitireoide peroxidase; anti‐TG, anticorpo antitiroglobulina; ASST, teste cutâneo de soro autólogo; BAT, teste de ativação de basófilos; BHRA, ensaio de liberação de histamina de basófilos; PCR, proteína C reativa; CsA, ciclosporina‐A; UCE, urticária crônica espontânea; VHS, velocidade de hemossedimentação; H. pilori, Helicobacter pylori; Oma, omalizumabe; UCT, teste de controle de urticária.
A busca por biomarcadores que possam predizer a resposta a um determinado tratamento tem sido um assunto de interesse e muitas publicações relataram que alguns biomarcadores podem ser úteis na determinação da resposta a certos tratamentos na UCE. Para o Oma, altos níveis de IgE, negatividade no ASST, negatividade de BHRA, a falta de atividade de up‐regulação de basófilos CD203c, alta expressão de basófilos FcɛRI e níveis mais baixos de IL‐31 foram relatados como biomarcadores para boa resposta ao tratamento, enquanto para ciclosporina, positividade de BHRA, níveis mais altos de PCR, níveis baixos de IgE, positividade no ASST, níveis baixos de dímero‐D, alta atividade da doença e curta duração da doença foram indicativos de boa resposta ao tratamento.4,7 Na população do presente estudo, não houve diferença estatisticamente significante entre os respondedores ao Oma e CsA em relação aos parâmetros de comparação, mas isso pode ter sido em virtude da distribuição desequilibrada de pacientes com determinados parâmetros. Como mencionado anteriormente, havia um percentual menor de pacientes com boa resposta ao tratamento com CsA, o que pode ter resultado em limitação da análise estatística; isso se deve principalmente à escolha do Oma como tratamento de primeira linha em pacientes refratários aos anti‐histamínicos. A comparação entre os grupos mostrou que ASST positivo, história familiar positiva, altos níveis de PCR, basopenia, eosinopenia, altos níveis de VHS, baixos níveis de IgE total, positividade anti‐TPO e escores UCT basais mais baixos foram mais frequentes em respondedores à CsA do que respondedores ao Oma. Esses achados referem‐se novamente à importância dos endótipos de UCE; os parâmetros mencionados associados à resposta à CsA também são características da UCE autoimune do tipo IIb. A urticária autoimune tipo IIb é definida por autoanticorpos IgG anti‐IgE ou FcɛRI, teste de ativação de basófilos (BAT, basophil activation test) positivo e um ASST positivo e demonstrou responder melhor ao tratamento com CsA.8–11 Também foi demonstrado que pacientes com níveis elevados de PCR responderam melhor à CsA, o que é um achado relatado em estudos anteriores.12 Além disso, foi observado que níveis baixos de IgE total foram mais frequentes em respondedores à CsA, como relatado por Santiago et al.5 Semelhante aos achados de Hollander et al.,11 que relataram que a gravidade inicial mais alta predizia uma resposta bem‐sucedida ao tratamento com CsA, os respondedores à CsA no presente estudo tinham escores UCT mais baixos. Embora os respondedores à CsA no presente estudo tivessem apresentado maior frequência de positividade de ASST, a evidência de ASST ser um potencial preditor de resposta ao tratamento com CsA não foi conclusiva.
Observou‐se que os respondedores ao Oma nessa população estudada apresentavam escore UCT basal significantemente mais alto do que os não respondedores ao Oma, o que indicou atividade de doença menor. Esse fato também foi relatado por Salman et al.13 A presença de angioedema,14 sexo feminino,15 níveis elevados de PCR,16 positividade de ASST,17 eosinopenia e basopenia18 estiveram associadas à resposta insatisfatória ao Oma. Níveis séricos mais altos de IgE total são atualmente aceitos como biomarcador estabelecido da resposta ao Oma,14 embora não tenha sido estatisticamente significante no presente estudo.
Um em cada cinco pacientes do presente estudo apresentou resposta a ambos os medicamentos, e esses pacientes apresentaram menos angioedema e escores UCT basais mais altos (menor atividade basal da doença), que são características de menor atividade da doença. Uma resposta favorável ao tratamento é prevista em pacientes com menor atividade da doença; entretanto, seria esclarecedor se fosse possível realizar testes para autoanticorpos IgE e IgG e determinar que tipo de autoimunidade esses pacientes têm. Dessa maneira, a hipótese de que esses pacientes podem ter ambos os tipos de autoanticorpos e, portanto, ambos os tipos de autoimunidade poderia ser considerada. A ideia da presença de tais pacientes vem das observações de relatos crescentes de pacientes que respondem ao tratamento conjunto com Oma e CsA. Mas os pacientes nesses relatos não parecem responder ao tratamento com Oma ou CsA isoladamente, mas ao tratamento com um regime combinado, refletindo pacientes com alta atividade da doença e possivelmente com dois tipos de autoimunidade.19–21 A existência conjunta de dois tipos de autoimunidade foi demonstrada em um estudo clínico recente de Asero et al.,22 que mostraram a coexistência de autoanticorpos IgE e IgG para receptores IgE de alta e baixa afinidade (FcɛRI e FcɛRII), fator tecidual e tireoglobulina, principalmente em respondedores tardios ao Oma.
Vinte por cento dos pacientes neste estudo não responderam ao tratamento com Oma ou CsA. Essa população de pacientes refratários incluiu mais mulheres e mais pacientes com escores UCT de linha basal mais baixos. Essas características também foram associadas à doença refratária em relatos anteriores; o sexo feminino foi relatado como sendo um preditor de maior tempo até a remissão,23 resistência aos anti‐histamínicos24 e maior frequência de recorrência após o tratamento com Oma.25 Escores de UCT basais mais baixos foram associados à taxa de resposta mais baixa e maior necessidade de aumento da dose de Oma.26 Apesar de não ter significância estatística, os pacientes refratários apresentaram maior taxa de positividade para H. pylori, embora não haja informações sobre as taxas de erradicação do H. pylori nesses pacientes. Isso enfatiza a importância de avaliar e tratar comorbidades em pacientes com UCE.
O único estudo que se assemelha em alguns aspectos ao presente trabalho é o publicado por Sánchez et al., em que relataram que, de 88 pacientes em seu estudo, 26/88 (29,5%) responderam à CsA, 41/88 (46,5%) responderam ao Oma, 16/88 (18,2%) responderam quando CsA e Oma foram combinados e apenas cinco (5,6%) pacientes permaneceram sem resposta ao tratamento.19 As taxas de resposta ao Oma foram semelhantes às do presente estudo e também foram semelhantes à taxa de resposta completa relatada pelos ensaios clínicos e estudos da prática clínica do Oma, que é de aproximadamente 40 a 50%.27 Contudo, a taxa de não respondedores a ambos os medicamentos parece ser muito menor do que no presente estudo, o que pode ser atribuído à preferência do último de não incluir pacientes que utilizaram Oma e CsA ao mesmo tempo. Se esses pacientes refratários fossem tratados com ambos os medicamentos, a taxa de não respondedores poderia ter sido menor.
A razão pela qual esses pacientes não respondem nem ao Oma nem à CsA precisa ser explorada em estudos prospectivos maiores, que avaliem o perfil dos pacientes com exames laboratoriais detalhados, incluindo autoanticorpos tipo IgG e IgE, testes BAT/BHRA, bem como outros mediadores inflamatórios, tanto na pele quanto no sangue periférico. Esses pacientes podem ter um mecanismo patológico subjacente diferente, incluindo envolvimento de componentes do complemento, infiltrados na pele compostos por eosinófilos ou linfócitos T produzindo outras citoquinas inflamatórias, como IL‐4, IL‐5, IL‐23, IL‐17 ou IL‐31, ou outros mecanismos, incluindo angiogênese, coagulação e desregulação vascular.28 Há muitas variações diferentes de opções terapêuticas para esse grupo de pacientes refratários que estão sendo utilizados em ensaios clínicos em progresso ou sob desenvolvimento, incluindo dupilumabe, fenebrutinibe, benralizumabe e anti‐siglec‐8.2,29
As limitações do presente estudo compreendem a sua natureza retrospectiva, que não incluiu o mesmo número de pacientes nos quatro grupos delineados, não incluindo pacientes que foram tratados tanto com CsA quanto com Oma, um baixo número de pacientes, a falta de um grupo controle e a falta de testes BAT ou BHRA. A natureza transversal do estudo levou a uma população de estudo que pode não refletir a população geral com UCE, mas a natureza multicêntrica do estudo pode ter atenuado esse efeito.
ConclusãoA categorização de pacientes em endótipos pode ser útil para prever as respostas ao tratamento e pode ajudar na escolha da opção mais adequada de tratamento para cada paciente com UCE. Para o melhor cuidado dos pacientes, determinar a atividade da doença na linha basal e orientar a avaliação e o manejo de comorbidades são de grande importância.
Suporte financeiroNenhum.
Contribuição dos autoresEmek Kocaturk: Contribuições substanciais para a concepção e planejamento do estudo; Obtenção, análise e interpretação dos dados; Revisão crítica da literatura; Participação na redação do manuscrito; escrita do manuscrito; Aprovação da versão final do manuscrito.
Emel Bülbül Başkan: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Özlem Su Küçük: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Mustafa Özdemir: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Sinem Örnek: Obtenção dos dados, ou análise e interpretação dos dados; Participação efetiva na orientação da pesquisa; Aprovação da versão final do manuscrito.
Pelin Kuteyla Can: Obtenção dos dados, ou análise e interpretação dos dados; Participação efetiva na orientação da pesquisa; Aprovação da versão final do manuscrito.
Eda Haşal: Obtenção dos dados, ou análise e interpretação dos dados; Participação efetiva na orientação da pesquisa; Aprovação da versão final do manuscrito.
Burhan Engin: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Nilgün Atakan: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Erkan Alpsoy: Obtenção dos dados, ou análise e interpretação dos dados; Revisão crítica de conteúdo intelectual importante; Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Kocatürk E, Başkan EB, Küçük OS, Özdemir M, Örnek S, Can PK, et al. Omalizumab versus cyclosporin‐A for the treatment of chronic spontaneous urticaria: can we define better‐responding endotypes? An Bras Dermatol. 2022;97:592–600.
Trabalho realizado no Departamento de Dermatologia, Koc University, Escola de Medicina, Istambul, Turquia; Departamento de Dermatologia, Uludag University, Escola de Medicina, Bursa, Turquia; Departamento de Dermatologia, Bezmialem Vakif University, Escola de Medicina, Istambul, Turquia; Departamento de Dermatologia, Istanbul Medipol University, Escola de Medicina, Istambul, Turquia; Departamento de Dermatologia, Ankara Diskapi Yildirim Beyazit Training and Research Hospital, Ankara, Turquia; Departamento de Dermatologia, VM Medical Park Maltepe Hospital, Istanbul, Turquia; Departamento de Dermatologia, Istanbul University, Escola de Medicina Cerrahpasa, Istanbul, Turquia; Departamento de Dermatologia, Hacettepe University, Escola de Medicina, Ankara, Turquia; Departamento de Dermatologia, Akdeniz University, Escola de Medicina, Antalya, Turquia.