O pioderma gangrenoso é uma dermatose neutrofílica caracterizada por úlceras crônicas devido a uma resposta imune anormal. Apesar da existência de critérios diagnósticos, não há tratamento ou exame diagnóstico específico (padrão‐ouro). Na América Latina, reconhecer e tratar essa doença se torna ainda mais desafiador uma vez que infecções bacterianas e não bacterianas da pele e tecidos moles frequentemente simulam o pioderma gangrenoso. Assim, esta revisão se concentra em caracterizar relatos de casos de pioderma gangrenoso nessa região, para melhor avaliação e manejo da condição. Brasil, México, Argentina e Chile são os países da América Latina com o maior número de casos publicados. A apresentação clínica mais comum é a forma ulcerada e as condições associadas mais frequentes são as doenças inflamatórias intestinais, artropatias inflamatórias e neoplasias hematológicas. As modalidades de tratamento mais comuns são os corticosteroides sistêmicos e a ciclosporina. Outros tratamentos relatados incluem metotrexato, dapsona e ciclofosfamida. Finalmente, o uso de medicamentos biológicos ainda é limitado nessa região.
O pioderma gangrenoso (PG) é uma doença inflamatória, comumente caracterizada por úlceras cutâneas dolorosas, com bordas violáceas irregulares localizadas nos membros inferiores. É frequentemente associado à doença inflamatória intestinal (DII), artropatias inflamatórias e neoplasias hematológicas1,2. A incidência global é estimada em 2‐3 casos por 100.000 habitantes/ano3, mas tais números podem ser subestimados devido à falta de um exame diagnóstico padrão‐ouro. A patogênese permanece obscura, mas estudos têm sugerido uma resposta imune anormal em um paciente com predisposição genética. Assim, o PG é classificado dentro do espectro das síndromes neutrofílicas e autoinflamatórias4,5.
O diagnóstico diferencial clínico inclui infecções, vasculites/vasculopatias e desordens neoplásicas, que devem ser descartadas com o auxílio de exames laboratoriais, histopatológico e microbiológicos6. Tratamentos de primeira linha incluem corticosteroides sistêmicos e ciclosporina. As opções terapêuticas de segunda e terceira linha compreendem imunossupressores, imunomoduladores e medicamentos biológicos7. Nosso foco foi fazer uma revisão da literatura a fim de recomendar o melhor manejo clínico ao lidar com pacientes com PG na América Latina (AL).
MétodosFoi feita uma revisão sistemática de relatos de caso e séries de caso de PG oriundos da AL e constantes no Medline (PubMed) e Lilacs até outubro de 2018. As estratégias de busca estão disponíveis na tabela 1.
Estratégias de busca
| Base de dados | Pubmed (https://www.ncbi.nlm.nih.gov/pubmed/) Data: 23 de outubro de 2018 | Resultados | |
|---|---|---|---|
| Estratégia | #1 | Busca (chile OR brazil OR peru OR colombia OR mexico OR ecuador OR venezuela OR uruguay OR cuba OR puerto rico OR costa rica OR latin america OR argentina) | 702779 |
| #2 | Busca Pyoderma Gangrenosum[tiab] | 2853 | |
| #3 | Busca (#1 AND #2) | 61 | |
| Base de dados | LILACS (http://pesquisa.bvsalud.org/portal/) Data: 23 de outubro de 2018 | Resultados | |
| Estratégia | #1 | (tw:(pyoderma gangrenosum)) AND (instance: “regional”) AND (db:(“Lilacs”) | 141 |
O PG é considerado uma doença rara, com prevalência estimada em 2‐3 casos por 100.000 pessoas e taxa de incidência ajustada de 0,63 por 100.000 pessoas/ano. O risco de morte é três vezes maior do que controles em geral8. A doença tende a apresentar uma leve predominância em mulheres8,9. As comorbidades e os diagnósticos diferenciais variam significativamente, dependem da região geográfica e da prevalência local da doença. Estudos oriundos da AL são escassos, consistem em sua maioria de relatos e séries de caso10.
PatogêneseA disfunção neutrofílica tem sido implicada na patogênese do PG9. A patergia, definida como um aumento inespecífico da reação da atividade dos neutrófilos, está presente em outras desordens neutrofílicas (p.ex., doença de Behçet e síndrome de Sweet), mas tem sido descrita em pelo menos 30% dos pacientes com PG11,12. A disfunção neutrofílica compartilha os mesmos efetores pró‐inflamatórios encontrados nas síndromes autoinflamatórias. Ambas são caracterizadas por um sistema imune inato supra‐ativado, leva a um aumento da produção de inflamossomos2. Os inflamossomos são responsáveis pela ativação da caspase 1, uma protease que cliva a pró‐interleucina IL‐1β na funcionalmente ativa IL‐1β. A superprodução de IL‐1β desencadeia a liberação de diversas citocinas e quimiocinas pró‐inflamatórias, induz o recrutamento e a ativação de neutrófilos e, subsequentemente, em uma inflamação mediada por neutrófilos5. A IL‐17 parece ser crucial no recrutamento dos neutrófilos na autoinflamação e age sinergicamente com o fator de necrose tumoral (TNF)13,14. Finalmente, IL1‐β, IL‐17 e TNF‐α ativam e aumentam a produção metaloproteinases de matriz (MMPs), que são superexpressadas no infiltrado inflamatório do PG, causam injúria inflamatória e, como consequência, a destruição do tecido envolvido2,5.
Concluindo, o PG é o resultado de um sistema imune inato supra‐ativado através dos inflamossomos, em conjunto com a ativação do sistema imune adaptativo, desencadeados por uma injúria externa (p.ex., patergia) e/ou possivelmente um fator desencadeante interno em indivíduos geneticamente predispostos15.
Achados histopatológicosOs achados histopatológicos são inespecíficos. A presença de inflamação perifolicular, edema e infiltrado neutrofílico são achados iniciais encontrados em lesões sem tratamento ou em crescimento. Infiltração de leucócitos polimorfonucleares pode levar à formação de abcessos e necrose do tecido com infiltrado inflamatório misto. Achados adicionais incluem células gigantes, trombose secundária de vasos de pequeno e médio calibre e hemorragias. Vasculite leucocitoclásica secundária está presente em cerca de 40% dos casos. A imunofluorescência direta produz achados não específicos, como deposição de IgM, C3 e fibrina nos vasos da derme papilar e reticular. Devido à não especificidade desses achados, as biópsias de pele são úteis para descartar outras causas de ulcerações que podem apresentar achados clínicos similares, tais como infecções, vasculites, vasculopatias ou neoplasias12,16–18.
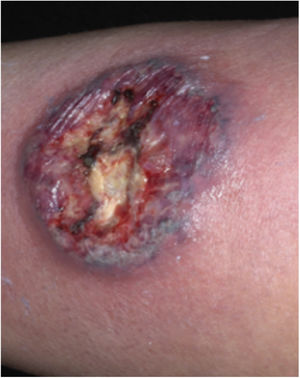
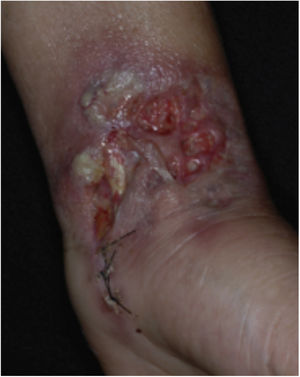
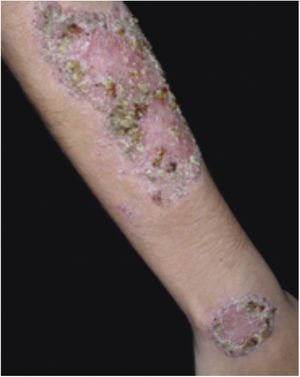
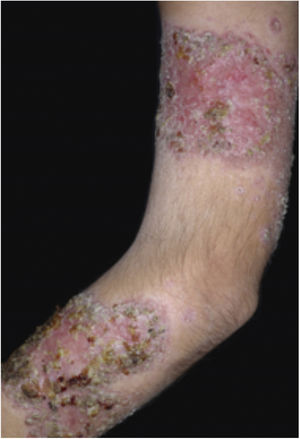
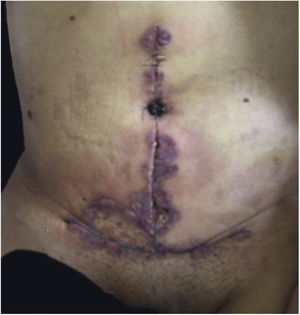
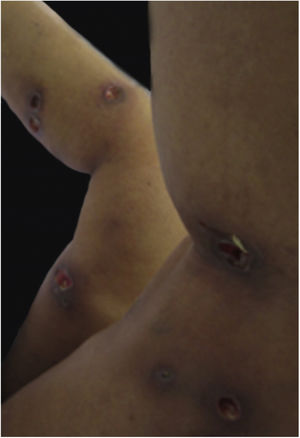
Características clínicasO PG é classificado em quatro subtipos clínicos: clássico (ulcerativo) (figs. 1 e 2), bolhoso, pustuloso e vegetante (figs. 3 e 4). PG ulcerativo ou clássico geralmente se inicia como uma pústula inflamatória, eritêmato‐violácea, com alguns milímetros de tamanho, que cresce e forma uma ulceração que gradualmente aumenta de tamanho e profundidade. A úlcera secreta um exsudato purulento e hemorrágico, que pode ser observado facilmente ao se aplicar pressão nas bordas. Esse exsudato purulento e com mau odor pode ser atribuído à colonização bacteriana ou a uma verdadeira superinfecção. A borda é bem delimitada, elevada, de lenta progressão e de cor violácea. Um halo infiltrativo, eritematoso e edematoso se estende a até 2 cm da borda da úlcera2,5,19. A lesão é geralmente solitária, mas úlceras múltiplas podem ocorrer; são tipicamente dolorosas, podem variar de poucos milímetros a até 30 cm ou mais, localizadas geralmente na face extensora das pernas, mas qualquer sítio anatômico pode ser acometido. Podem ser profundas e expor tendões, fáscia e músculos5,20. As lesões se iniciam na pele saudável e podem ser causadas por trauma (patergia). Portanto, PG pós‐cirúrgico (figs. 5 e 6), PG periostomal e piora das lesões após desbridamento cirúrgico ocorrem com frequência21. A úlcera pode propagar com rapidez, apresenta‐se de forma serpiginosa3,19. PG vem sido classicamente associado a colite inflamatória (DII e diverticulite), neoplasias hematológicas (síndrome mielodisplásica, gamopatia monoclonal, leucemia mieloide crônica etc.), doenças inflamatórias autoimunes (poliartrite soronegativa, artrite reumatoide) e tumores sólidos (próstata e adenocarcinoma de cólon)4,8. Por último, infiltrados neutrofílicos estéreis foram encontrados afetando órgãos internos, apoiando o conceito do PG como uma doença sistêmica22.
ResultadosForam encontrados 118 estudos de 1981 a 2018, com 232 casos de PG na AL. O Brasil foi o país com mais publicações de séries de casos, com 96 (41,4%) relatos de PG. Seguem‐se Argentina com 69 (29,7%) casos de PG relatados, Chile e México com, respectivamente, 21 (9,1%) e 17 (7,3%). Os resultados da revisão sistemática mostram que o PG ulcerativo foi o tipo mais frequente reportado e os outros têm prevalência similar. PG bolhoso, vegetante (granulomatoso) e pustuloso foram relatados em nove (3,9%), oito (3,5%) e cinco (2,1%) dos casos, respectivamente. O restante dos relatos de PG não especificava o subtipo (tabela 2).
Prevalência do PG na literatura latino‐americana
| Total (n) | % | Ulcerativo | Granulomatoso | Pustuloso | Bolhoso | |
|---|---|---|---|---|---|---|
| Brasil | 96 | 41,38 | 76 | 3 | 1 | 3 |
| Argentina | 69 | 29,74 | 57 | 2 | 2 | 3 |
| Bolívia | 1 | 0,43 | 1 | – | – | – |
| Chile | 21 | 9,05 | 20 | – | 1 | – |
| Colômbia | 16 | 6,90 | 14 | – | – | – |
| Costa Rica | 1 | 0,43 | 1 | – | – | – |
| Cuba | 2 | 0,86 | 1 | 1 | – | – |
| México | 17 | 7,33 | 5 | 1 | – | – |
| Paraguai | 1 | 0,43 | – | – | – | 1 |
| Peru | 5 | 2,16 | 2 | – | 1 | 2 |
| Venezuela | 3 | 1,29 | 2 | 1 | – | – |
| TOTAL | 232 | 100 | 179 | 8 | 5 | 9 |
| % | 100 | – | 77,16 | 3,45 | 2,16 | 3,88 |
Encontrou‐se uma alta prevalência de casos de PG associados a comorbidades. Em geral, 149 (64,5%) e 37 (16%) dos pacientes incluídos na análise tinham associação com alguma comorbidade ou cirurgia, respectivamente. No restante dos pacientes com PG, nenhuma comorbidade ou doença associada foi relatada. DII foi a comorbidade mais frequente (53/149; 35,6%), seguida por colite ulcerativa (CU) (32/149; 21,5%) e doença de Crohn (10/149; 6,7%). Outras doenças inflamatórias também foram frequentes (54/149; 36,2%); entre elas, artrite reumatoide (AR) (17/149; 11,4%), síndrome antifosfolípide (SAF) (15/149; 10,1%), lúpus eritematoso sistêmico (4/149; 2,7%) e arterite de Takayasu (4/149; 2,7%). Diversas neoplasias em associação com PG foram descritas (19/149; 12,8%), em particular as neoplasias hematológicas (14/149; 9,4%) e neoplasias de órgãos sólidos (5/149; 3,4%). Outras condições foram relatadas (23/149; 15,4%), inclusive presença de nódulos pulmonares (5/149; 3,4%) de etiologia desconhecida. A respeito dos procedimentos cirúrgicos, mamoplastia redutora (9/149; 6,0%), laparotomia (6/149; 4%) e enxertos cutâneos (4/149; 2,7%) foram os desencadeadores mais frequentes de PG. É importante ressaltar que, devido à informação limitada nos artigos e ao escasso número de casos de PG, apenas análise descritiva foi feita (tabela 3).
Prevalência das condições associadas ao PG na literatura latino‐americana
| Condição | n | % |
|---|---|---|
| DII | ||
| Não especificada | 11 | 7,4 |
| CU | 32 | 21,5 |
| DC | 10 | 6,7 |
| Sub‐total | 53 | 35,6 |
| Neoplasias | ||
| Hematológica | 14 | 9,4 |
| Órgãos sólidos | 5 | 3,4 |
| Subtotal | 19 | 12,8 |
| Inflamatório | ||
| Síndrome do anticorpo antifosfolípide | 15 | 10,1 |
| Artrite reumatoide | 17 | 11,4 |
| Lúpus eritematoso | 4 | 2,7 |
| Arterite de Takayasu | 4 | 2,7 |
| Outros | 14 | 9,4 |
| Subtotal | 54 | 36,2 |
| Outras condições | ||
| Nódulos pulmonares | 5 | 3,4 |
| Consumo de cocaína | 2 | 1,3 |
| Doença diverticular | 2 | 1,3 |
| Gravidez | 2 | 1,3 |
| Outras | 12 | 8,1 |
| Subtotal | 23 | 15,4 |
| Total | 149 | 64,5a |
| Secundário a cirurgia | ||
| Mamoplastia redutora | 9 | 22,5 |
| Laparotomia | 6 | 15,0 |
| Abdominoplastia | 4 | 10,0 |
| Enxerto de pele | 4 | 10,0 |
| Total cirúrgico | 37 | 16,0b |
Assim, a revisão sistemática de casos de PG da AL nos ajudou a elucidar as principais condições associadas. Na tabela 4 estão listados todos os estudos em que o PG foi relatado em associação a condições clínicas ou cirúrgicas.
Condições associadas ao PG na literatura latino‐americana
| N | Autor | Ano | País | Número de pacientes | Tipo clínico | Doença associada | Secundário a cirurgia ou medicamentos |
|---|---|---|---|---|---|---|---|
| 1 | Corti et al.59 | 1981 | Argentina | 1 | Ulcerativo | Doença de Crohn | Não |
| 2 | Della‐Giovanna et al.60 | 1991 | Argentina | 4 | Ulcerativo | Dois pacientes com colite ulcerativa, uma grávida | Não |
| 3 | Moreno et al.61 | 1994 | Argentina | 2 | Ulcerativo | Dois pacientes com artrite reumatoide | Não |
| 4 | Vignale et al.62 | 1996 | Argentina | 4 | Ulcerativo | Três pacientes com doença de Crohn, dois com artrite soronegativa e um com colite ulcerativa | Não |
| 5 | Saraceno et al.63 | 2002 | Argentina | 6 | Ulcerativo | Um paciente com síndrome mielodisplásica, um com artrite reumatoide e um com síndrome hematofagocítica e hepatite C | Não |
| 6 | Plaza64 | 2004 | Argentina | 1 | Ulcerativo | Artrite reumatoide | Não |
| 7 | Simon et al.65 | 2005 | Argentina | 1 | Ulcerativo | Colite ulcerativa | Periostomal após colectomia total |
| 8 | Vazquez et al.66 | 2009 | Argentina | 1 | Ulcerativo | Osteomielite crônica | Troca da protése de joelho |
| 9 | Sommerfleck et al.67 | 2014 | Argentina | 1 | Não relatado | Colite ulcerativa | Não |
| 10 | Achenbach et al.68 | 2014 | Argentina | 1 | Ulcerativo | Doença de Crohn | Sulfassalazina |
| 11 | Curmona et al.69 | 2014 | Argentina | 2 | Ulcerativo | Um paciente com câncer de ovário metastático | Ressecção do tumor abdominal |
| 12 | Pereyra et al.70 | 2014 | Argentina | 1 | Ulcerativo | Transplante renal | Não |
| 13 | Fassi et al.71 | 2015 | Argentina | 1 | Ulcerativo | Artrite reumatoide e colite ulcerativa | Não |
| 14 | Silva‐Feistner et al.72 | 2015 | Argentina | 1 | Ulcerativo | Nenhuma | Cesárea |
| 15 | Galimberti et al.73 | 2016 | Argentina | 1 | Ulcerativo | Colite ulcerativa | Não |
| 16 | Vacas et al.1 | 2017 | Argentina | 2722 | UlcerativoBolhosoPustuloso | Dez pacientes com DII, sete com neoplasias hematológicas, cinco com artrite reumatoide ou artrite soronegativa, e um após consumo de cocaína | Não |
| 17 | Vega et al.74 | 2018 | Argentina | 1 | Ulcerativo | Fibrose retroperitoneal | Laparotomia exploratória média |
| 18 | Vacas et al.75 | 2018 | Argentina | 1 | Bolhoso | Leucemia mieloide aguda e crônica | Não |
| 19 | Pires et al.76 | 1987 | Brasil | 1 | Ulcerativo | Hepatite crônica | Não |
| 20 | Lana et al.77 | 1990 | Brasil | 1 | Ulcerativo | Esclerose múltipla | Não |
| 21 | Pessato et al.78 | 1996 | Brasil | 9 | Não relatado | Cinco pacientes com comorbidades | Não |
| 22 | Souza et al.79 | 1999 | Brasil | 11 | Predominantemente ulcerativo | Um paciente com colite ulcerativa, um com artrite reumatoide, um com doença de Graves, um com diabetes mellitus | Não |
| 23 | Cabral et al.80 | 2004 | Brasil | 4 | Ulcerativo | Quatro pacientes com colite ulcerative, um com colangite primária esclerosante adicional, um com artrite soronegativa | Não |
| 24 | Martinez et al.81 | 2005 | Brasil | 1 | Ulcerativo | Colite ulcerativa | Não |
| 25 | Costa et al.82 | 2005 | Brasil | 1 | Ulcerativo | Artrite reumatoide | Não |
| 26 | Fraga et al.83 | 2006 | Brasil | 1 | Superficial granulomatoso | Psoríase | Não |
| 27 | Coltro et al.84 | 2006 | Brasil | 1 | Ulcerativo na área doadora | Nenhuma | Enxerto de pele para úlceras varicosas |
| 28 | Batista et al.85 | 2006 | Brasil | 1 | Bolhoso | Síndrome mielodisplásica | Não |
| 29 | Meyer et al.86 | 2006 | Brasil | 1 | Ulcerativo | Doença de Crohn | Laparotomia infraumbilical média |
| 30 | Franca et al.87 | 2006 | Brasil | 1 | Ulcerativo | Adenocarcinoma gástrico | Não |
| 31 | Burkieviecz et al.88 | 2007 | Brasil | 1 | Ulcerativo | Lúpus eritematoso sistêmico/síndrome do anticorpo antifosfolípide | Não |
| 32 | Barbato et al.89 | 2008 | Brasil | 13 | Ulcerativo | Dois pacientes com doença de Crohn, dois com diabetes, dois com colagenoses, um com leucemia | Não |
| 2 | Superficial granulomatoso | ||||||
| 1 | Bolhoso | ||||||
| 33 | Tinoco et al.90 | 2008 | Brasil | 1 | Ulcerativo | Acne | Isotretinoína |
| 34 | Dornelas et al.91 | 2008 | Brasil | 1 | Ulcerativo | Nenhuma | Mamoplastia e abdominoplastia redutoras |
| 35 | Bonamigo et al.92 | 2008 | Brasil | 1 | Ulcerativo | Nenhuma | Implante de prótese de silicone nas mamas e cirurgia facial |
| 36 | Coelho et al.93 | 2009 | Brasil | 2 | Ulcerativo | Artrite inflamatória/esplenopmegalia | Não |
| 37 | Berbert et al.94 | 2009 | Brasil | 1 | Superficial granulomatoso | Nenhuma | Área doadora após enxerto devido a queimadura |
| 38 | Furtado et al.95 | 2010 | Brasil | 1 | Ulcerativo | Nenhuma | Mamoplastia e abdominoplastia redutoras |
| 39 | Avelar et al.96 | 2011 | Brasil | 1 | Ulcerativo | Câncer de mama | Quadrantectomia de mama e radioterapia |
| 40 | Fonseca et al.97 | 2011 | Brasil | 1 | Bolhoso | Colite ulcerativa | Não |
| 41 | Grillo et al.98 | 2012 | Brasil | 1 | Ulcerativo | Nenhuma | Mamoplastia redutora |
| 42 | Maia et al.99 | 2012 | Brasil | 1 | Ulcerativo | Uso de cocaína | Não |
| 43 | Cunha et al.100 | 2012 | Brasil | 1 | Ulcerativo | Nenhuma | Laparoscopia |
| 44 | Bittencourt et al.101 | 2012 | Brasil | 1 | Ulcerativo | Nódulos pulmonares | Não |
| 45 | Andrade et al.102 | 2012 | Brasil | 1 | Ulcerativo | Doença inflamatória intestinal | Não |
| 46 | Carvalho et al.103 | 2013 | Brasil | 1 | Ulcerativo | Acometimento renal e esplênico | Não |
| 47 | Kruger et al.104 | 2013 | Brasil | 1 | Ulcerativo | Colite ulcerativa | Não |
| 48 | Soares et al.105 | 2013 | Brasil | 1 | Ulcerativo | Nenhuma | Mamoplastia e abdominoplastia redutoras |
| 49 | Beber et al.106 | 2014 | Brasil | 1 | Ulcerativo | Artrite reumatoide | Não |
| 50 | Marchiori et al.107 | 2014 | Brasil | 1 | Ulcerativo | Nódulos pulmonares | Não |
| 51 | Rosseto et al.108 | 2015 | Brasil | 1 | Ulcerativo | Nenhuma | Abdominoplastia |
| 52 | de Souza et al.109 | 2015 | Brasil | 1 | Ulcerativo | Síndrome mielodisplásica | Não |
| 53 | Sempertegui et al.110 | 2015 | Brasil | 1 | Ulcerativo | Câncer de mama | Quadrantectomia de mama e radioterapia |
| 54 | Soncini et al.111 | 2016 | Brasil | 1 | Ulcerativo | Nenhuma | Mastopexia de aumento |
| 55 | Dantas et al.55 | 2017 | Brasil | 1 | Ulcerativo | Hepatite autoimune | Não |
| 56 | Freitas et al.112 | 2017 | Brasil | 1 | Ulcerativo | Síndrome da compressão da veia ilíaca | Não |
| 57 | Gabe et al.113 | 2018 | Brasil | 1 | Ulcerativo | Artrite piogênica | Não |
| 58 | Bittencourt et al.114 | 2018 | Brasil | 1 | Ulcerativo | Mieloma múltiplo | Transplante autólogo de medula e depois colecistectomia laparoscópica |
| 59 | Clemente et al.115 | 2018 | Brasil | 2 | Ulcerativo | Dois pacientes com arterite de Takayasu atípicas | Não |
| 60 | Perez et al.116 | 2001 | Chile | 2 | Ulcerativo | Nenhuma | Cesárea |
| 61 | Lopez de Maturana et al.54 | 2001 | Chile | 31 | UlcerativoPustuloso | Dois pacientes com doença diverticular, um paciente com doença de Crohn, um paciente com artrite reumatoide | Não |
| 62 | Hevia et al.117 | 2004 | Chile | 1 | Ulcerativo | Colite ulcerativa | Periostomal após colectomia total |
| 63 | Eulufi et al.118 | 2006 | Chile | 3 | Ulcerativo | Nenhuma | Dois pacientes após enxerto de pele, um paciente após mamoplastia redutora |
| 64 | Calderon et al.119 | 2011 | Chile | 1 | Ulcerativo | Colite ulcerativa | Não |
| 65 | Fernandez‐Castillo et al.120 | 2012 | Chile | 1 | Ulcerativo | Granulomatose de Wegener/doença renal crônica | Fístula arteriovenosa |
| 66 | Gosch et al.121 | 2012 | Chile | 1 | Ulcerativo | Nenhuma | Mamoplastia redutora |
| 67 | Melo and Fernandez122 | 2013 | Chile | 1 | Ulcerativo | Nenhuma | Cirurgia no pé e tornozelo |
| 68 | Calderon et al.123 | 2013 | Chile | 3 | Ulcerativo | Nenhuma | Após mamoplastia redutora |
| 69 | Bannura et al.124 | 2014 | Chile | 1 | Ulcerativo | Colite ulcerativa | Laparotomia/Ileostomia |
| 70 | Erlij et al.125 | 2018 | Chile | 1 | Ulcerativo | Eritema indurado e linfoma não Hodgkin de grandes células B | Não |
| 71 | Penaloza et al.126 | 1988 | Colômbia | 1 | Ulcerativo | Colite ulcerativa | Não |
| 72 | Restrepo et al.127 | 2006 | Colômbia | 2 | Ulcerativo | Dois pacientes com colite ulcerativa | Não |
| 73 | Jaime‐Lopez et al.128 | 2009 | Colômbia | 1 | Ulcerativo | Colite ulcerativa | Infliximabe |
| 74 | Cañas et al.129 | 2010 | Colômbia | 7 | Ulcerativo | Sete pacientes com síndrome do anticorpo antifosfolípide | Não |
| 75 | Cadavid et al.130 | 2012 | Colômbia | 1 | Ulcerativo | Colite ulcerativa | Não |
| 76 | Severiche et al.131 | 2014 | Colômbia | 1 | Ulcerativo | Tumor filoide da mama (paraneoplásico) | Não |
| 77 | Acon‐Ramirez et al.132 | 2017 | Costa Rica | 1 | Ulcerativo | Artrite reumatoide | |
| 78 | Moreira‐Preciado et al.133 | 2001 | Cuba | 1 | Superficial granulomatoso | Insuficiência renal | Não |
| 79 | Hernandez‐Urra et al.134 | 2010 | Cuba | 1 | Ulcerativo | Colite ulcerativa | Não |
| 80 | Zonana‐Nacach et al.135 | 1994 | México | 2 | Não relatado | Dois pacientes com artrite reumatoide | Não |
| 81 | Reynoso‐von Dratein et al.58 | 1997 | México | 9 | Não relatado | Três pacientes com artrite reumatoide e dois pacientes com lúpus eritematoso sistêmico | Não |
| 82 | Chacek et al.136 | 1998 | México | 1 | Ulcerativo | Síndrome da veia cava inferior devido a trombose e síndrome do anticorpo antifosfolípide | Não |
| 83 | Muñiz‐Gonzalez et al.137 | 2007 | México | 1 | Ulcerativo | Colite ulcerativa, doença diverticular | Não |
| 84 | Contreras‐Ruiz et al.138 | 2008 | México | 1 | Ulcerativo | Artrite reumatoide | Não |
| 85 | Barrera‐Vargas et al.139 | 2015 | México | 2 | Ulcerativo | Dois pacientes com nódulos pulmonares e arterite de Takayasu | Não |
| 86 | Contreras‐Verduzco et al.140 | 2018 | México | 1 | Superficial granulomatoso | Nódulos pulmonares e esclerite nodular | Não |
| 87 | Real‐Delor et al.141 | 2011 | Paraguai | 1 | Bolhoso | Colite ulcerativa | Não |
| 88 | Dominguez et al.142 | 2009 | Peru | 1 | Pustuloso | Colite ulcerativa | Não |
| 89 | Carrillo‐Nanez et al.143 | 2014 | Peru | 1 | Bolhoso | Colite ulcerativa | Não |
| 90 | Deza‐Araujo et al.144 | 2014 | Peru | 1 | Ulcerativo | Lúpus eritematoso sistêmico | Não |
| 91 | Fermin et al.145 | 1989 | Venezuela | 2 | Ulcerativo | Um paciente com colite ulcerativa | Não |
| 92 | Valecillos et al.146 | 1998 | Venezuela | 1 | Superficial granulomatoso | Gravidez | Não |
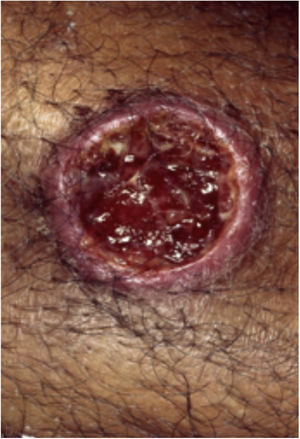
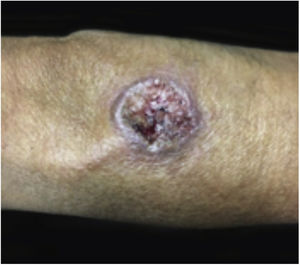
Geralmente, as entidades ulcerativas que se assemelham ao PG se enquadram em uma de seis categorias de doenças: a) Infecções cutâneas profundas primárias (esporotricose, tuberculose cutânea, leishmaniose etc.) (figs. 7 e 8); b) Doença venosa ou oclusão vascular (SAF, úlcera por estase venosa etc.); c) Vasculites (granulomatose de Wegener, poliarterite nodosa etc.); d) Processo neoplásico que envolve a pele (linfoma de células T angiocêntrico ou anaplásico de grandes células etc.); e) Injúria tecidual induzida por drogas ou exógena (desordem factícia, loxocelismo etc.); e f) Outras desordens inflamatórias (doença de Crohn cutânea, necrobiose lipoídica ulcerativa etc.). Entretanto, na AL os diagnósticos diferenciais mais comuns incluem infecções cutâneas profundas, doença vascular oclusiva e desordens metabólicas23. Descartar infecções é crucial para o manejo do PG nessa região, uma vez que os medicamentos imunossupressores usados para o tratamento do PG podem estar contraindicados nesses pacientes24. A depender da região específica, as úlceras infecciosas podem ser causadas por parasitas Leishmania, espécies de Mycobacterium atípicas, infecções fúngicas profundas (esporotricose, cromoblastomicose e micetoma), miíase e amebíase cutânea3.
A leishmaniose cutânea (LC) é uma dermatose frequente em países em desenvolvimento, como Brasil e Peru25. As lesões iniciais podem ser pápulas ou nódulos que evoluem para úlcera, com ou sem cicatriz (figs. 7 e 8). São geralmente indolores e, quando há dor, infecção bacteriana secundária geralmente está presente. O diagnóstico inicial da LC é baseado na apresentação clínica e história do paciente ter visitado uma área endêmica. A propedêutica inclui múltiplos exames para que se obtenha uma alta probabilidade de confirmar o diagnóstico. Biópsias devem ser obtidas para esfregaço de aposição (imprint), estudo histopatológico por meio de hematoxilina e eosina, Giemsa e outras colorações para agentes infecciosos, cultura e análise por reação em cadeia da polimerase (PCR) se o diagnóstico for desafiador26.
Lesões cutâneas ulceradas podem ser causadas por infecções por micobactérias, inclusive Mycobacterium ulcerans, M. marinum e M. tuberculosis. M. ulcerans é o terceiro agente de doença por micobactéria mais comum (após tuberculose e lepra) e a micobactéria mais comum que causa úlceras cutâneas27. A úlcera de Buruli, causada pelo M. ulcerans, é endêmica no oeste da África e foram relatados casos importados em países da América do Sul, como Peru, Brasil, Guiana e México28. Microscopia e PCR são usadas para diagnóstico de rotina; a cultura não é tão útil devido ao tempo de crescimento e à falta de especificidade para as espécies29. O tratamento geralmente é cirúrgico, apesar de a combinação de rifampicina e estreptomicina ser eficaz no estágio inicial.
Tuberculose cutânea (TBC) é a infecção causada pelo complexo M. tuberculosis, M. bovis e imunossuprimidos vacinados com bacilo Calmette‐Guérin (BCG)30. Um aumento de sua incidência tem sido descrita em diversos países da AL nos últimos anos, especialmente em centros urbanos e regiões com alta prevalência de infecção pelo vírus da imunodeficiência humana (HIV). O lúpus vulgar é uma forma da TBC que inicialmente se apresenta como pápulas ou lesões tuberosas latentes, que evoluem para placas com necrose e ulceração, com ou sem deformidade cicatricial e mutilação31. O manejo diagnóstico para a TBC inclui biópsia da pele com coloração para bacilo álcool‐ácido resistente, culturas e PCR no tecido da biópsia32.
Esporotricose é uma das micoses profundas mais comuns que pode ser seguida por ulceração33. A maioria dos casos de esporotricose vem sendo reportada na América do Sul e Central, com surtos recentes tendo gatos como via de transmissão34. A lesão cutânea primária pode ser uma pápula, nódulo ou pústula, que evolui para uma úlcera superficial ou em uma placa verrucosa. Durante sua progressão, a forma linfocutânea apresenta múltiplos nódulos que se formam ao longo do curso do trajeto linfático (aspecto esporotricoide). Em contraste, as formas localizadas não apresentam propagação linfática e são caracterizadas por placas enduradas ou verrucosas e ocasionalmente úlceras35,36. Seu diagnóstico é primariamente clínico devido a sua apresentação peculiar, mas, em casos desafiadores, a cultura é o padrão‐ouro37. O tratamento da esporotricose é feito com itraconazol sistêmico38.
Micetoma é uma infecção fúngica subcutânea e crônica causada pela inoculação via matéria orgânica, tais como ferpas e espinhos. Devido à natureza ubíqua do fungo responsável, pode haver uma predisposição genética para o desenvolvimento da doença39. Na América do Sul, os patógenos mais comuns são o Trematosphaeria grisea, Madurella mycetomatis e Scedosporium apiospermum. As manifestações clínicas do micetoma incluem nódulos subcutâneos indolores e de crescimento lento, que podem evoluir em abcessos necróticos com formação de fístulas. As lesões são comumente localizadas nas áreas expostas, especialmente em membros inferiores. A expressão de grãos e detritos negros das lesões é altamente sugestiva de micetoma fúngico40. O manejo diagnóstico inclui microscopia do tecido com hidróxido de potássio, biópsia de tecido profundo para cultura em ágar de dextrose Sabouraud deixado em temperatura ambiente e a 37°C. Como as culturas fúngicas podem levar várias semanas, o exame histopatológico pode acelerar o diagnóstico, mas pode não ajudar na identificação da espécie causadora.
A miíase furunculoide é frequentemente causada pela penetração da larva da Dermatobia hominis, a varejeira, e da Cordylobia anthropophaga, mosca tumbu, nos tecidos. As lesões evoluem para nódulos de dor intermitente. Pode haver apresentação de múltiplos nódulos contendo larva e a remoção tipicamente melhoria os sintomas.
Amebíase cutânea é uma manifestação extracutânea rara da infecção por Entamoeba histolytica. Pode ocorrer independentemente por inoculação direta ou por contiguidade com outro tecido envolvido. Há predileção da doença pela área perianal pela inoculação direta das fezes que leva a ulcerações, mas as lesões podem estar presentes em qualquer área do corpo41. Características clínicas notáveis incluem uma ou mais úlceras dolorosas e de mau odor com uma base necrótica42. As bordas das lesões são, com frequência, elevadas e de cor avermelhada. A progressão da úlcera é geralmente rápida, com destruição de todos os planos42. A confirmação do diagnóstico pode ser feita por identificação do patógeno na biópsia da úlcera. Esfregaços citológicos também podem ser úteis na identificação dos trofozoítos42.
A cromoblastomicose é uma infecção causada pela implantação de esporos fúngicos na pele em locais de trauma. O fungo é ubíquo no solo e na vegetação e é altamente associado a traumas que ocorreram ao ar livre43,44. Essa inoculação produz uma reação granulomatosa crônica. A infecção geralmente se inicia como uma mácula que progride para pápula e, eventualmente, para um dos vários subtipos morfológicos: nodular, verrucoso, tumoral, cicatricial ou em placa45. A progressão da doença geralmente é muito lenta e usualmente é limitada à pele e subcutâneo. Devido ao mecanismo de inoculação, é mais comum nos membros inferiores. Uma complicação rara nas lesões crônicas é a transformação em carcinoma espinocelular44,45. O diagnóstico é feito com a identificação de células moriformes ao microscópio44–48. Amostras podem ser obtidas por raspagem, fita adesiva, citologia a fresco, biópsia do tecido ou cultura. O tratamento depende do estágio ao diagnóstico e as lesões iniciais podem ser tratadas com eficácia com cirurgia ou crioterapia44,47,49.
Tratamento do PG na ALNão há tratamento padrão‐ouro para o PG, mas a terapêutica deve ser guiada pela extensão e profundidades da úlcera, doenças sistêmicas associadas, estado clínico do paciente e disponibilidade de medicamentos3,50. Terapêutica tópica é a primeira escolha para lesões pequenas e em estágios iniciais (pápulas, pústulas, nódulos ou úlceras superficiais); inclui compressas, imunomoduladores tópicos e injeção intralesional de corticoesteroides51. Um relato do Chile demonstrou uma excelente e rápida resposta à ciclosporina 5%, clobetasol 0,05% e gentamicina 0,2% em pomada, aplicada duas vezes ao dia, após 18 semanas52.
Em pacientes com formas graves de PG, ou expansão rápida e resistência ao tratamento tópico, a terapêutica sistêmica é indicada. Corticosteroides são a droga de primeira linha na fase aguda e devem ser iniciados em doses altas (1‐2 mg/kg)3,53. Uma droga poupadora de corticosteroides deve ser usada nas fases iniciais para minimizar a toxicidade e os efeitos colaterais em longo prazo. Essas drogas incluem dapsona, sulfassalazina, metotrexato, azatioprina, micofenolato mofetil, ciclofosfamida, ciclosporina e biológicos2,53.
Na AL os corticosteroides sistêmicos são, de longe, o tratamento de primeira linha mais frequente. Em uma coorte de pacientes com PG, corticosteroides sistêmicos foram administrados em 87% dos pacientes (n=27), com uma dose que variou de 1‐1,5mg/kg/dia por 2‐14 meses1. Em outra coorte, essas drogas foram iniciadas em 81,8% dos pacientes (n=9); após 60 meses, apenas dois pacientes estavam livres de recorrência, enquanto os outros apresentaram múltiplas recorrências, tratadas com sulfametoxazol e trimetoprim, minociclina, corticosteroides tópicos e ciclofosfamida54. Além disso, corticoesteroides e tratamento local foram preferidos quando o PG era associado a doenças autoimunes, como hepatite autoimune55.
A ciclosporina é usada com menos frequência como tratamento de primeira linha devido aos efeitos colaterais e ao custo elevado. Em monoterapia, induz a remissão rápida da doença em dose de 3‐5mg/kg/dia após algumas semanas de tratamento, resolução completa da lesão após 1‐3 meses, mas seu uso terapêutico em longo prazo pode ser problemático3. Em um relato da AL, foi usada em 13% (n=4) dos pacientes, por 1‐6 meses, com uma dose de 1,5‐3mg/kg/dia, sem recorrência após quatro anos de tratamento1.
A experiência com metotrexato na AL é escassa, usado como droga poupadora de corticosteroide na doença grave e refratária56. Entretanto, um relato do Chile demonstra uma resposta dramática ao uso de metotrexato intralesional. Após 40 dias de prednisolona oral, seguido de metotrexato intramuscular por oito semanas em dose de 10mg semanal, as úlceras de PG não apresentaram melhora. Após sete injeções de metotrexato (25mg/semana), administradas intralesionalmente na borda eritematosa das úlceras, quase 90% das úlceras cicatrizaram57.
No México, um estudo aberto avaliou a pulsoterapia endovenosa de ciclofosfamida em uma dose de 500mg/m2 de área corpórea mensalmente, em três ou seis doses em nove pacientes com PG. Sete pacientes obtiveram remissão completa, uma falha, uma remissão parcial, três recorrências após 3 e 12 meses58. Apesar de raros, efeitos adversos como infertilidade, cistite hemorrágica e tumores secundários podem limitar seu uso3.
Dapsona e sulfassalazina foram relatadas em apenas dois pacientes com PG no Chile54. Entretanto, a recorrência ocorreu em múltiplas ocasiões, sendo o tratamento eventualmente mudado para corticosteroides sistêmicos e ciclosporina.
Para o PG resistente aos corticosteroides, os medicamentos biológicos têm sido usados cada vez mais na AL. Os inibidores do TNF‐α são preferidos devido a sua disponibilidade e aos dados referentes à segurança em longo prazo, porém seu alto custo ainda limita o uso nessa região.
ConclusãoCom base nos estudos atuais, o PG na AL continua a ser uma doença subnotificada e há falta de estudos substanciais. A forma clínica mais comum de PG é a ulcerativa, que é mais frequentemente associada a DII. Um diagnóstico preciso na AL é ainda mais desafiador, uma vez que a prevalência de infecções cutâneas que simulam todas as formas do PG é maior do que nos países desenvolvidos. Estar atento às nuances epidemiológicas das doenças infecciosas pode facilitar o diagnóstico de lesões PG‐símiles em pacientes da AL, imigrantes e viajantes. O tratamento do PG é feito primariamente com corticosteroides sistêmicos, porém há relatos de desfechos favoráveis com uso de ciclosporina e metotrexato. Na AL os dados referentes a medicamentos biológicos são escassos, aparentemente reservados para formas de PG não responsivas aos corticosteroides, devido a seu alto custo e acesso limitado.
Suporte financeiroNenhum.
Contribuição dos autoresMilton José Max Rodríguez‐Zúñiga: Aprovação da versão final do manuscrito.
Michael Heath: Aprovação da versão final do manuscrito.
João Renato Vianna Gontijo: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito.
Alex G. Ortega‐Loayza: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Rodríguez‐Zúñiga MJM, Heath MS, Gontijo JRV, Ortega‐Loayza AG. Pyoderma gangrenosum: a review with special emphasis on Latin America literature. An Bras Dermatol. 2019;94:729–43.
Trabalho realizado na Oregon Health and Sciences University, Portland, Estados Unidos, e na Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.