A psoríase está associada à aterosclerose e ao aumento do risco cardiovascular. Atualmente, ultrassom automatizado, denominado Quantitative Intima Media Thickness, mostrou‐se um método útil para avaliar a aterosclerose subclínica.
ObjetivosComparar o aumento do risco cardiovascular em pacientes com psoríase submetidos a dois tipos de tratamentos: metotrexato e inibidor do fator de necrose tumoral alfa e avaliar a correlação do escore de Framingham com o Quantitative Intima Media Thickness.
MétodosForam selecionados 50 pacientes, com psoríase em placas, de junho de 2017 a julho de 2018, divididos em dois grupos, um em uso de metotrexato e outro em uso de inibidor do fator de necrose tumoral alfa. Foi feita a medida da circunferência abdominal, pressão arterial, índice de massa corporal e presença de síndrome metabólica. Após, os pacientes foram avaliados quanto ao aumento do risco cardiovascular com o escore de Framingham e pelo Quantitative Intima Media Thickness das artérias carótidas.
ResultadosA média de idade foi de 54,8 (± 12,5), com discreto predomínio do sexo masculino (58%). No geral, 84% dos pacientes apresentaram circunferência abdominal elevada, 82% estavam com índice de massa corporal acima do ideal e 50% apresentaram síndrome metabólica. Para a correlação entre Quantitative Intima Media Thickness e escore de Framingham, o coeficiente de correlação linear de Pearson foi 0,617 (p < 0,001), indicando uma associação positiva de moderada a forte.
Limitações do estudoNão foi avaliado o efeito protetor das terapias citadas em relação ao aumento do risco cardiovascular.
ConclusõesFoi observada uma associação positiva de moderada a forte correlacionando os valores do escore de Framingham com a mensuração do Quantitative Intima Media Thickness, não se podendo estabelecer qual medicamento apresenta risco cardiovascular mais elevado.
A psoríase (Ps) é doença inflamatória crônica e recorrente associada a ampla gama de manifestações sistêmicas. Acomete cerca de 2% a 3% da população.1 As drogas sistêmicas, entre elas metotrexato, acitretina, ciclosporina e imunobiológicos, são usadas isoladamente ou combinadas com as outras modalidades de tratamento. A escolha da terapêutica mais apropriada para cada caso envolve análise da gravidade da doença juntamente com a presença ou não de comorbidades.2
Revisões sistemáticas evidenciaram a associação da Ps ao aumento da prevalência e da incidência da síndrome metabólica (SM), como também dos seus componentes individuais: obesidade, dislipidemia, diabetes mellitus (DM2) e hipertensão arterial sistêmica (HAS) e, do aumento do risco cardiovascular (RCV).3 Também demonstraram que pacientes com Ps grave comparados àqueles com a forma leve da doença apresentaram maiores chances para o desenvolvimento da SM. Portanto, a Ps tornou‐se um fator de risco independente para eventos cardiovasculares.4
O escore de Framingham é o referencial teórico mais usado mundialmente e que evidencia relação causal com as doenças cardiovasculares (DCV) e justifica‐se a estratificação adequada do RCV para ocorrência futura de DCV.5 A ultrassonografia (US) de carótidas pode ser usada como um dos principais métodos de avaliação não invasiva no diagnóstico de doença aterosclerótica carotídea. Caracteriza‐se por ser um método de boa acurácia, dinâmico, livre de radiação e de baixo custo.6
O uso do escore para cálculo da espessura íntimo‐média da carótida pela tecnologia de radiofrequência no ultrassom Quantitative Intima Media Thickness (QIMT) é um importante parâmetro para identificar a doença aterosclerótica subclínica nos pacientes com ou sem fatores de risco. Diferentemente das outras técnicas de avaliação da espessura da artéria carótida, esse método não é examinador‐dependente, pois o resultado é dado por esse software, e não medido manualmente.7
Na Ps, os eventos inflamatórios que são perpetuados na circulação sanguínea provavelmente influenciam o aparecimento de lesões no endotélio vascular e o desenvolvimento de aterosclerose. Dessa mesma teoria, surge a hipótese de que, ao diminuir a carga inflamatória, diminuiria consequentemente o risco do aparecimento de DCV.8 O conceito de Ps como doença sistêmica direcionou a comunidade científica para a investigação da influência das terapêuticas para Ps na evolução dessas comorbidades mais prevalentes.
O objetivo deste estudo é comparar o RCV em pacientes com Ps submetidos a dois tipos de tratamento: metotrexato (MTX) e inibidor do fator de necrose tumoral alfa (Anti‐TNF‐α) e avaliar se há correlação do escore de Framingham com o QIMT.
MétodosTrata‐se de estudo observacional transversal, feito de junho de 2017 a julho de 2018 na PUC‐Campinas, para o qual foram selecionados 50 pacientes, com psoríase em placas, moderada a grave, Psoriasis Area Severity Index (PASI) ≥ 10, com idade igual ou superior a 20 anos, divididos em dois grupos:
Grupo 1: 25 pacientes em uso do MTX havia mais de 6 meses;
Grupo 2: 25 pacientes em uso de biológicos Anti‐TNF‐α (infliximabe ou adalimumabe) havia mais de 6 meses.
Avaliamos a medida da circunferência abdominal, pressão arterial, índice de massa corporal (IMC) e presença de SM. Após, foram avaliados quanto ao risco cardiovascular com o escore de Framingham e pelo QIMT das duas carótidas comuns.
Vários grupos têm desenvolvido critérios para o diagnóstico da SM. No entanto, a definição do National Cholesterol Education Program – Adult Treatment Panel III (NCEP‐ATP III) é a mais usada e recomendada pela Diretriz Brasileira de Diagnóstico e Tratamento da SM. Através de investigação clínica e laboratorial, tem como objetivo confirmar o diagnóstico da SM e identificar fatores de risco cardiovascular associados. Assim, é necessária a combinação de três dos cinco seguintes parâmetros: níveis de triglicérides ≥ 150 mg/dL; HDL < 40 mg/dL para homens e < 50 mg/dL para mulheres; circunferência abdominal > 88cm para mulheres e > 102cm para homens; Glicemia de Jejum (GJ) ≥ 100 mg/dL e pressão arterial elevada (PA ≥ 130×85 mmHg).
O escore de Framingham é calculado através de informações sobre idade, colesterol LDL e HDL, pressão arterial, diabetes mellitus e tabagismo, para homens e mulheres. A partir da soma dos pontos de cada fator é estimado o RCV em 10 anos.
Realizou-se ultrassom (US) de carótidas com a escala cinza ou modo‐B (SG), na máquina EsaoteMylab 50, com uma sonda linear de alta resolução e frequência que variou entre 3,5 e 10 MHz. A angulação para calcular a carótida comum da artéria foi inferior a 60 graus. A espessura da camada íntima‐média da carótida (IMT) foi determinada com software automatizado que avalia IMT pela radiofrequência (QIMT).9 Para obtenção do QIMT, foi usado software específico que faz a leitura semiautomática e o cálculo da relação esperada para cada paciente.
A imagem foi obtida na artéria carótida comum, bilateral, 10mm proximalmente ao bulbo da carótida e na fase diastólica final. A avaliação foi feita com a medida do espessamento da artéria.
Todos os exames foram feitos pelo mesmo médico com 10 anos de experiência em ultrassonografia. O paciente ficou em posição supina ≤ 45° para o lado contralateral ao da carótida estudada e foram avaliadas ambas as carótidas em escaneamento transversal e longitudinal.
Todos os pacientes leram e assinaram o Termo de Consentimento Livre e Esclarecido – TCLE, aprovado pelo Comitê de Ética em Pesquisa (número do comprovante: 061354/2017 e número do parecer: 2.209.814) do hospital envolvido.
Análises estatísticasForam feitas análises estatísticas descritivas e analíticas de acordo com os objetivos propostos. Todas as análises foram feitas com o auxílio do software SPSS Statistics, versão 17.0.
Para as variáveis quantitativas inicialmente foi avaliado se apresentavam distribuição normal através de análise descritiva e do teste de normalidade de Shapiro‐Wilk. A variável idade do paciente foi descrita pela média (± desvio‐padrão), pois apresentou distribuição aproximadamente normal. O tempo de uso do medicamento e os valores do PASI, com distribuições assimétricas, foram descritos pela mediana (intervalo interquartil). As variáveis categóricas foram descritas pelas frequências absolutas (n) e relativas (%).
Na análise de comparação entre os grupos foram feitos os testes t de Student para a variável idade do paciente, o de Mann‐Whitney para o tempo de uso do medicamento e os valores do PASI. Para as demais variáveis, descritas de forma categórica, foram usados os testes qui‐quadrado ou o Exato de Fisher.
Para a avaliação do RCV de acordo com o tratamento e a associação entre as classificações de RCV, foram feitas análises de regressão logística univariável e multivariável. Foram calculadas as razões de chance (OR – odds ratio) brutas e ajustadas e seus respectivos intervalos de confiança de 95% (95% IC).
A concordância entre o RCV medido pelo escore de Framingham e pelo QIMT de forma categórica foi avaliada pelo coeficiente de Kappa e 95% IC. Os cálculos de sensibilidade, especificidade e acurácia também foram feitos. Além disso, foi feita a avaliação da associação do RCV medido de forma contínua pelo escore de Framingham e valores do QIMT através da análise de regressão linear simples e múltipla. O nível de significância (a) adotado foi de 5%, foram considerados estatisticamente significativos valores de p < 0,05.
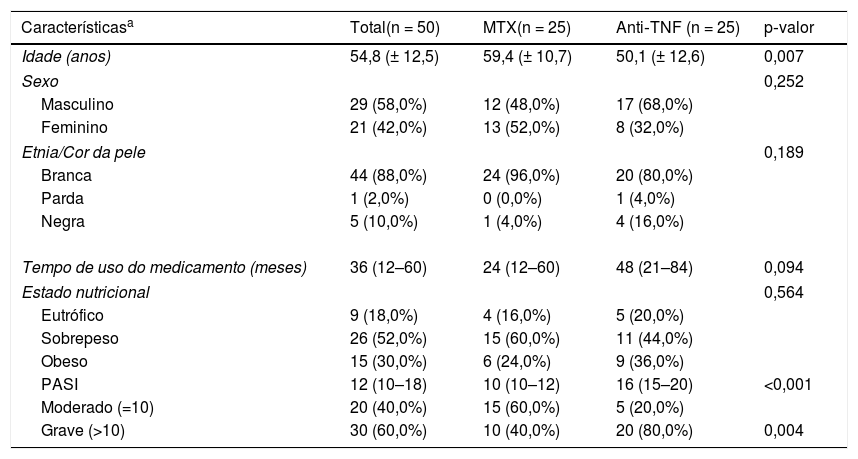
ResultadosForam avaliados 50 pacientes com Ps moderada a grave, 50% eram usuários de MTX (Grupo 1) e 50% de Anti‐TNF‐α (Grupo 2). As características da população estudada estão resumidas na tabela 1. A maioria dos pacientes era do sexo masculino (58%), da etnia branca (88%) e com média de de 54,8 (± 12,5) anos. O tempo de uso das medicações foi descrito através da mediana (1°–3° quartis) com resultado de 36 (12–60) meses.
Características dos pacientes com psoríase, amostra total e de acordo com o tratamento realizado
| Característicasa | Total(n = 50) | MTX(n = 25) | Anti‐TNF (n = 25) | p‐valor |
|---|---|---|---|---|
| Idade (anos) | 54,8 (± 12,5) | 59,4 (± 10,7) | 50,1 (± 12,6) | 0,007 |
| Sexo | 0,252 | |||
| Masculino | 29 (58,0%) | 12 (48,0%) | 17 (68,0%) | |
| Feminino | 21 (42,0%) | 13 (52,0%) | 8 (32,0%) | |
| Etnia/Cor da pele | 0,189 | |||
| Branca | 44 (88,0%) | 24 (96,0%) | 20 (80,0%) | |
| Parda | 1 (2,0%) | 0 (0,0%) | 1 (4,0%) | |
| Negra | 5 (10,0%) | 1 (4,0%) | 4 (16,0%) | |
| Tempo de uso do medicamento (meses) | 36 (12–60) | 24 (12–60) | 48 (21–84) | 0,094 |
| Estado nutricional | 0,564 | |||
| Eutrófico | 9 (18,0%) | 4 (16,0%) | 5 (20,0%) | |
| Sobrepeso | 26 (52,0%) | 15 (60,0%) | 11 (44,0%) | |
| Obeso | 15 (30,0%) | 6 (24,0%) | 9 (36,0%) | |
| PASI | 12 (10–18) | 10 (10–12) | 16 (15–20) | <0,001 |
| Moderado (=10) | 20 (40,0%) | 15 (60,0%) | 5 (20,0%) | |
| Grave (>10) | 30 (60,0%) | 10 (40,0%) | 20 (80,0%) | 0,004 |
A média da idade dos pacientes do grupo em uso do MTX foi de 59,4 (± 10,7) anos e do grupo em uso de Anti‐TNF‐α de 50,1 (± 12,6) anos. A mediana do tempo de uso do medicamento variou de 24 (12–60) meses para usuários de MTX a 48 (21–84) meses para o grupo do Anti‐TNF‐α.
Através do IMC, foram mostrados resultados preocupantes, já que 82% dos pacientes do estudo estavam acima do peso. Apenas 16% do Grupo 1 e 20% do Grupo 2 estavam com o peso ideal para a altura. O índice PASI do início do tratamento foi maior do que 10% para 60% dos pacientes. No grupo em uso do MTX esse percentual foi de 40% e no grupo do Anti‐TNF‐α foi de 80%. A média geral foi de 14,7 (± 5,7), com 11,8 (± 3,0) no Grupo 1 e 17,5 (± 6,8) no Grupo 2. Devido à não normalidade dos dados, a comparação do PASI entre os grupos foi feita através de teste não paramétrico, a descrição das medianas (1°–3° quartis) indicou diferença estatisticamente significativa (p < 0,001) (tabela 1).
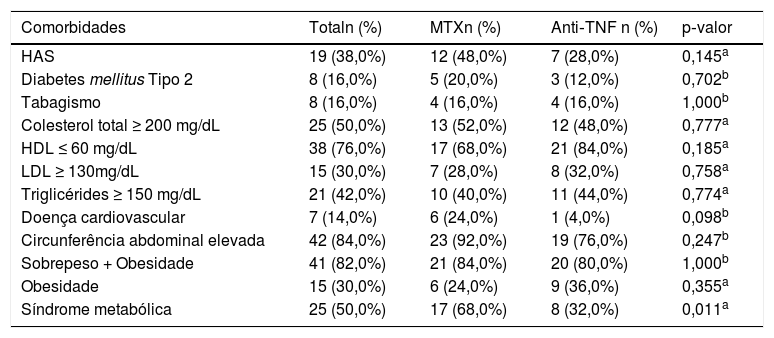
Na tabela 2 encontram‐se as comorbidades desses pacientes com Ps. Quase 40% dos pacientes apresentavam HAS diagnosticada, presente em 48% do Grupo 1 e 28% do Grupo 2. DM2 em tratamento foi observada em 16% dos pacientes, com 20% dos usuários de MTX e 12% de Anti‐TNF‐α. Em relação ao tabagismo, 16% dos participantes do estudo fumavam, com o mesmo valor dentro dos grupos. O colesterol total, HDL e LDL estavam alterados em 50%, 76% e 30% dos pacientes, respectivamente, sem diferença estatisticamente significativa entre os grupos. Valores de triglicérides maiores ou iguais ≥ 150 mg/dL foram observados em 42% dos pacientes. A respeito de doença cardiovascular prévia, 14% dos pacientes já haviam apresentado algum quadro. No geral, 84% dos pacientes apresentaram circunferência abdominal elevada e 82% estavam com o peso acima do ideal em relação à altura, com 30% já considerados obesos, sem diferença estatisticamente significativa entre os grupos. Também foi analisada a presença ou não de SM nesses pacientes com Ps e em 50% deles ela estava presente, com um percentual mais elevado de pacientes usuários de MTX (68%) do que aqueles em tratamento com Anti‐TNF (32%).
Prevalência de comorbidades dos pacientes com psoríase, de acordo com o tratamento
| Comorbidades | Totaln (%) | MTXn (%) | Anti‐TNF n (%) | p‐valor |
|---|---|---|---|---|
| HAS | 19 (38,0%) | 12 (48,0%) | 7 (28,0%) | 0,145a |
| Diabetes mellitus Tipo 2 | 8 (16,0%) | 5 (20,0%) | 3 (12,0%) | 0,702b |
| Tabagismo | 8 (16,0%) | 4 (16,0%) | 4 (16,0%) | 1,000b |
| Colesterol total ≥ 200 mg/dL | 25 (50,0%) | 13 (52,0%) | 12 (48,0%) | 0,777a |
| HDL ≤ 60 mg/dL | 38 (76,0%) | 17 (68,0%) | 21 (84,0%) | 0,185a |
| LDL ≥ 130mg/dL | 15 (30,0%) | 7 (28,0%) | 8 (32,0%) | 0,758a |
| Triglicérides ≥ 150 mg/dL | 21 (42,0%) | 10 (40,0%) | 11 (44,0%) | 0,774a |
| Doença cardiovascular | 7 (14,0%) | 6 (24,0%) | 1 (4,0%) | 0,098b |
| Circunferência abdominal elevada | 42 (84,0%) | 23 (92,0%) | 19 (76,0%) | 0,247b |
| Sobrepeso + Obesidade | 41 (82,0%) | 21 (84,0%) | 20 (80,0%) | 1,000b |
| Obesidade | 15 (30,0%) | 6 (24,0%) | 9 (36,0%) | 0,355a |
| Síndrome metabólica | 25 (50,0%) | 17 (68,0%) | 8 (32,0%) | 0,011a |
HAS, hipertensão arterial sistêmica.
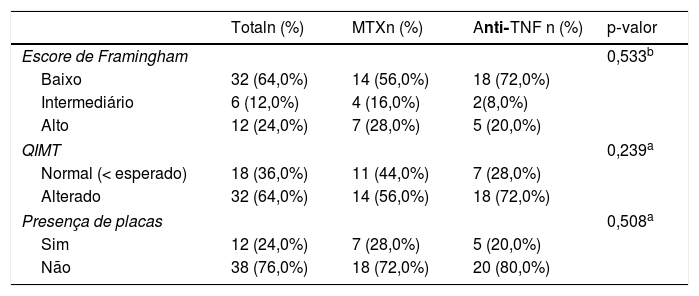
Considerando a prevalência do RCV segundo o escore de Framingham, quase um quarto dos pacientes apresentou risco alto (probabilidade maior do que 20% de apresentar doença coronariana em 10 anos), com 28% do Grupo 1 e 20% do Grupo 2; e mais de 60% apresentaram baixo risco, com probabilidade menor do que 10% de desenvolver algum evento cardiovascular em 10 anos, com 56% no grupo do MTX e 72% no grupo dos biológicos (tabela 3).
Prevalência de risco cardiovascular segundo o escore de Framingham, ultrassonografia de carótidas por radiofrequência (QIMT) e presença de placas carotídeas
| Totaln (%) | MTXn (%) | Anti‐TNF n (%) | p‐valor | |
|---|---|---|---|---|
| Escore de Framingham | 0,533b | |||
| Baixo | 32 (64,0%) | 14 (56,0%) | 18 (72,0%) | |
| Intermediário | 6 (12,0%) | 4 (16,0%) | 2(8,0%) | |
| Alto | 12 (24,0%) | 7 (28,0%) | 5 (20,0%) | |
| QIMT | 0,239a | |||
| Normal (< esperado) | 18 (36,0%) | 11 (44,0%) | 7 (28,0%) | |
| Alterado | 32 (64,0%) | 14 (56,0%) | 18 (72,0%) | |
| Presença de placas | 0,508a | |||
| Sim | 12 (24,0%) | 7 (28,0%) | 5 (20,0%) | |
| Não | 38 (76,0%) | 18 (72,0%) | 20 (80,0%) | |
Na análise do ultrassom de carótidas, o resultado foi preocupante, já que 64% dos pacientes apresentaram QIMT da carótida acima do limite superior dos valores ajustados pela idade, sinalizaram doença cardiovascular subclínica. No Grupo 1, 56% dos pacientes apresentaram espessamento da camada médio‐intimal da carótida e 28% placas nas carótidas. No Grupo 2, 72% dos pacientes tiveram resultados alterados de QIMT e 20% apresentaram placas carotídeas. No entanto, não foi detectada associação entre RCV, calculados através do escore de Framingham e US de carótidas por radiofrequência e os medicamentos estudados, ou seja, não houve diferença estatisticamente significativa de risco entre os grupos (tabela 3).
Dado que o QIMT ainda é pouco explorado em pacientes com Ps como um possível teste de rastreamento para avaliação de RCV, optamos por avaliar os valores encontrados nesse índice de forma contínua, correlacionamos com os valores do escore de Framingham. O coeficiente de correlação linear de Pearson (r) encontrado foi de 0,617 (p < 0,001), indicou uma associação positiva de moderada a forte. A tabela 4 descreve os coeficientes do modelo de regressão linear multivariável.
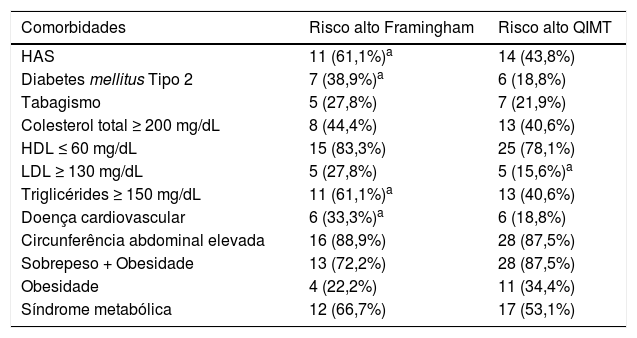
A associação entre as comorbidades dos pacientes com Ps e o RCV alto de acordo como escore de Framingham e o QIMT foi avaliada e está descrita na tabela 5, que resume os resultados encontrados, na qual podemos verificar associações estatisticamente significativas entre o escore de Framingham alto com HAS, DM Tipo 2, triglicérides ≥ 150 mg/dL e doença cardiovascular. Entretanto, para valores elevados de QIMT a única associação estatisticamente significativa encontrada foi com o LDL ≥ 130 mg/dL.
Prevalência de comorbidades dos pacientes com psoríase e alto risco cardiovascular, classificados pelo escore de Framingham e QIMT
| Comorbidades | Risco alto Framingham | Risco alto QIMT |
|---|---|---|
| HAS | 11 (61,1%)a | 14 (43,8%) |
| Diabetes mellitus Tipo 2 | 7 (38,9%)a | 6 (18,8%) |
| Tabagismo | 5 (27,8%) | 7 (21,9%) |
| Colesterol total ≥ 200 mg/dL | 8 (44,4%) | 13 (40,6%) |
| HDL ≤ 60 mg/dL | 15 (83,3%) | 25 (78,1%) |
| LDL ≥ 130 mg/dL | 5 (27,8%) | 5 (15,6%)a |
| Triglicérides ≥ 150 mg/dL | 11 (61,1%)a | 13 (40,6%) |
| Doença cardiovascular | 6 (33,3%)a | 6 (18,8%) |
| Circunferência abdominal elevada | 16 (88,9%) | 28 (87,5%) |
| Sobrepeso + Obesidade | 13 (72,2%) | 28 (87,5%) |
| Obesidade | 4 (22,2%) | 11 (34,4%) |
| Síndrome metabólica | 12 (66,7%) | 17 (53,1%) |
HAS, hipertensão arterial sistêmica.
A associação entre doença cardiovascular e Ps foi descrita há quase 50 anos, mas foi na última década que houve um aumento de investigação dessa correlação.10,11
A resposta inflamatória na Ps leva à resistência à insulina, disfunção endotelial, estresse oxidativo e desenvolvimento de aterosclerose que culmina com infarto agudo do miocárdio (IAM) ou acidente vascular cerebral (AVC). Portanto, a Ps pode ser considerada fator de risco independente para eventos cardiovasculares.12
Fernandes‐Armenteros et al. publicaram em 2018 um estudo observacional, através de um banco de dados, com 39.8701 indivíduos, entre eles 6.868 casos registrados de Ps, dos quais 7,3% foram considerados Ps moderada a grave, a SM foi mais prevalente em pacientes com Ps (28,3%×15,1%; OR = 2,21).13 Outro estudo transversal com 244 pacientes com Ps e outros 163 do grupo controle encontrou prevalência significante de SM no grupo com Ps (45,1% vs. 19,6%), independentemente da gravidade da doença.14 Nesse estudo, foram demonstrados 50% dos pacientes com SM, todos com Ps moderada a grave e, comprovou‐se a associação de Ps e SM.
Uma pesquisa feita com 6.549 americanos entre 20 a 59 anos mostrou que a prevalência de SM (de acordo com os critérios NCEP ATP III revisados) foi de 40% entre os indivíduos com Ps e 23% entre os sem Ps, novamente aproximou‐se dos dados encontrados neste estudo com 50% dos pacientes com SM. E a característica da SM mais comum entre os pacientes foi obesidade, seguida de hipertrigliceridemia e após níveis baixos de colesterol HDL.15
As consequências das comorbidades da Ps, como maiores valores de SM, aterosclerose e RCV, levam a um aumento da mortalidade nessas pessoas. Gelfand et al. publicaram que homens com Ps grave morrem 3,5 anos mais cedo do que os homens sem Ps e mulheres com Ps grave morrem 4,4 anos mais cedo do que as sem Ps. Portanto, a modificação do fator de risco é necessária para reduzir o RCV.1
Teoricamente, os eventos inflamatórios presentes na circulação sanguínea dos indivíduos com Ps podem influenciar no aparecimento de lesões do endotélio vascular e no desenvolvimento de aterosclerose. Daí, a hipótese de que, ao diminuir a carga inflamatória, diminuiria consequentemente o risco do aparecimento de doenças cardiovasculares.16,17 Portanto, a medicação escolhida para o tratamento da Ps deve ser analisada não apenas para melhorar a doença da pele, e sim a inflamação crônica e a microcirculação, para prevenir futuros danos ao indivíduo.
Além de usar o MTX na terapia da Ps como agente anti‐inflamatório, antiproliferativo e imunossupressor, há evidências consideráveis de seu efeito antiaterosclerótico. Um estudo que envolveu 1.240 pacientes, observados por mais de 6 anos, mostrou que tanto em pacientes com Ps quanto os com artrite reumatoide o MTX reduziu o risco de doença cardíaca coronariana e também reduziu em 70% o risco de morte resultante de DCV, em comparação com os pacientes não tratados com MTX.18
Há um estudo que avalia os efeitos do MTX no desenvolvimento de aterosclerose em pacientes com Ps, que descreve seu impacto na função endotelial na microcirculação como um marcador precoce da aterosclerose. Após 8−10 semanas de tratamento, não foram observadas alterações significativas na microcirculação.19 Como o presente estudo foi do tipo transversal, ocorreu essa limitação para avaliar se o MTX ou o Anti‐TNF‐α reduziriam o RCV após um determinado tempo de uso da medicação.
Várias publicações recentes têm sugerido que os inibidores de TNF‐α também têm um impacto benéfico sobre o RCV.20–22 Em uma metanálise, Westlake et al. sumarizaram os potenciais efeitos dos Anti‐TNF‐α em pacientes com artrite psoriásica sobre Major Adverse Cardiovascular Events (MACE) e sobre o risco de desenvolvimento de doença cardiovascular de novo. Os resultados mostraram um potencial efeito cardioprotetor dos Anti‐TNF‐α, mas não tão eficaz quanto aquele observado com o uso de MTX.23
Outro estudo com 2.400 pacientes com Ps grave demonstrou que pacientes tratados com MTX ou imunobiológicos apresentaram baixas taxas de eventos cardiovasculares em comparação às outras terapias.24
Uma revisão sistemática e metanálise mostrou a relação entre o uso dos Anti‐TNF‐α, MTX, anti‐inflamatórios não esteroidais e corticosteroides e a presença de eventos cardiovasculares em 236.525 pacientes com artrite reumatoide e 220.209 pacientes com artrite psoriásica e Ps. Na artrite reumatoide, foi encontrada associação benéfica do MTX com redução do risco cardiovascular (RR = 0,72; 95% IC 0,57–0,91; p = 0,007). Porém, o MTX não foi associado à diminuição do risco de AVC e MACE. Já o uso do Anti‐TNF‐α foi associado à redução do RCV (RR = 0,7; 95% IC 0,54–0,9; p < 0,005), como IAM, AVC e MACE. Na análise da artrite psoriásica e Ps, os dados foram suficientes para avaliar o efeito de terapia sistêmica comparada com o não uso dela ou apenas medicação tópica. A terapêutica sistêmica foi associada à diminuição do RCV (RR = 0,75; 95% IC 0,63–0,91; p = 0,003).25
A US carotídea que mede a espessura médio‐intimal é método não invasivo para avaliar as alterações iniciais da parede vascular aterosclerótica. Quando esses valores estão aumentados, os mesmos refletem anormalidades locais que se correlacionam com aterosclerose histologicamente comprovada.26 A medida dessa espessura tem valor preditivo em termos de eventos cardiovasculares, independentemente dos fatores de risco tradicionais.27
Considerando o fato de que a US é a técnica de imagem mais dependente do operador e a US vascular requer experiência e especialização, um método que permita uma medição automatizada da IMT pode facilitar seu uso, como a avaliação automática de alta precisão e em tempo real por radiofrequência, através de um software, denominada QIMT. As medições manuais são influenciadas por parâmetros subjetivos, como a dificuldade do olho humano de diferenciar as interfaces das camadas e consequentemente o limiar da interface do eco do olho e a sensibilidade da mão do ultrassonografista no posicionamento dos paquímetros eletrônicos. Pelo método QIMT não há essa influência pela qualidade da imagem do modo B, o que o torna menos dependente do operador.7
Neste estudo alterações subclínicas consistentes com aterosclerose foram vistas com base em um QIMT médio aumentado. Um estudo prévio com 30 pacientes com Ps (n = 15) e artrite psoriásica (n = 15) demonstrou a relação entre tais distúrbios e um risco aumentado de aterosclerose subclínica e eventos cardiovasculares com o método QIMT. Constatou‐se com valores estatisticamente significativos que 60% dos pacientes com Ps e 80% com artrite psoriásica tiveram maior mensuração do IMT do que o esperado.28
Os valores encontrados neste trabalho foram similares aos demais publicados na literatura, no qual 64% dos 50 pacientes com Ps apresentaram níveis alterados de QIMT (56% dos usuários de MTX e 72% dos indivíduos em uso de Anti‐TNF‐α), enquanto apenas 36% apresentaram risco intermediário ou alto no escore de Framingham (44% do Grupo 1 e 28% do Grupo 2). Isso mostra a utilidade da IMT para alerta de aterosclerose ainda não aparente clinicamente e na iniciativa de decisão terapêutica do paciente com uma doença inflamatória crônica como a Ps. A diferença entre os valores de mensuração do QIMT entre os dois grupos de medicamentos (56% dos usuários de MTX e 72% dos indivíduos em uso de Anti‐TNF‐α) pode‐se atribuir a um processo inflamatório mais importante nos pacientes do grupo de Anti‐TNF‐α, que apresentaram 80% de PASI > 10 e apenas 40% do grupo de MTX tiveram PASI > 10. Lembramos que todos os pacientes apresentaram PASI iguais a ou maiores do que 10, foram avaliados como Ps moderada a grave. Além disso, sabe‐se que na prática clínica o Anti‐TNF‐α é usado para pacientes com quadros mais graves de Ps ou falhas terapêuticas com outros medicamentos, ou seja, é um paciente provavelmente com maior tempo de doença e maior inflamação sistêmica, o que caracteriza um processo aterosclerótico mais evidenciado. No entanto, estudos longitudinais e com maior número de participantes devem ser feitos para confirmar esses dados.
Em uma revisão sistemática da literatura, para analisar a relação entre IMT e espondilite anquilosante, 24 artigos foram analisados (1.120 doentes e 943 do grupo controle) e o tratamento com Anti‐TNF‐α sugeriu uma melhoria ou diminuição da progressão do processo da aterosclerose, enquanto doenças inflamatórias podem induzir o desenvolvimento de aterosclerose.9,29
Um estudo espanhol recente, prospectivo, com 53 pacientes com Ps moderada a grave, também usou a QIMT carotídea, pelo método automatizado por radiofrequência, antes e após 8 meses de uso de terapia sistêmica. A QIMT dos usuários de imunobiológicos tendeu a diminuir, os níveis de insulina e glicemia reduziram com uso de Anti‐TNF‐α e os pacientes submetidos ao tratamento com MTX apresentaram diminuição significativa na IMT, concluiu‐se que a espessura da carótida e suas consequências podem ser beneficiadas com o uso de medicamentos sistêmicos, como biológicos e MTX.30 Esses resultados estão de acordo com estudos anteriores feitos em pacientes com artrite reumatoide2,31 e reforçam que o tratamento com MTX serve como fator protetor durante o desenvolvimento de MACE.32
Em um estudo‐piloto, com 16 pacientes com Ps grave, foi calculado a IMT da carótida, por método ultrassonográfico convencional, antes e após 6 meses de tratamento com Anti‐TNF‐α. Foi detectada uma diminuição significativa do IMT, mostrou‐se que a inibição efetiva do fator de necrose tumoral alfa diminui a IMT em pacientes psoriásicos e também revelou IMT carotídeo alterado em 84% dos pacientes.33
Anteriormente, Di Minno et al. haviam apresentado um estudo transversal que comparou os níveis de IMT de pacientes submetidos a tratamento com Anti‐TNF‐α e drogas antirreumáticas modificadoras de doença (DMARDs) para artrite psoriásica e mostrou que pacientes que receberam o biológico tiveram uma diminuição nos valores de IMT.34
Portanto, já está bem documentado que a IMT da artéria carótida comum mostra correlações positivas com a duração da inflamação, parâmetros laboratoriais, idade e fatores de risco tradicionais para DCV.35,36 As sociedades de cardiologia sugerem que a avaliação da IMT da artéria carótida comum deve fazer parte da avaliação médica de pacientes com RCV aumentado37 e as diretrizes de reumatologia sugerem que pacientes com artrite inflamatória devem ser submetidos à avaliação ultrassonográfica das carótidas.38 No entanto, na área da dermatologia não há um posicionamento referente a essa avaliação de imagem. Como sabidamente a Ps é uma doença inflamatória crônica e um fator de risco independente para DCV, esse assunto deve ser abordado e orientado aos especialistas da área o mais rapidamente possível.
No presente estudo, houve uma associação positiva de moderada a forte após avaliação dos valores do QIMT que os correlacionou com os valores do escore de Framingham (p < 0,001) e mostrou que o QIMT pode ser considerado um possível teste de rastreamento para avaliação de risco cardiovascular em pacientes com Ps. Mais de 70% dos pacientes do Grupo 2 tiveram QIMT alterado, enquanto 56% do Grupo 1 apresentaram alterações, mostrou‐se menor RCV em pacientes submetidos ao tratamento com MTX. No entanto, quando avaliados pelo escore de Framingham, o Grupo 1 apresentou 28% de alto RCV e o Grupo 2 20%. Lembre‐se que o uso da ultrassonografia pela tecnologia de radiofrequência deve ser pensado como instrumento para detecção precoce de aterosclerose, ainda sem sinais clínicos ou laboratoriais.
Existem algumas limitações neste estudo que incluem a heterogeneidade da idade e tempo de uso das medicações. Enquanto as descobertas do nosso estudo fornecem evidências de apoio, é importante salientar que a análise transversal não fornece informação sobre causalidade e não foi avaliado o efeito protetor das terapias citadas em relação ao RCV. Outro fator limitador dá‐se pelo pequeno número de participantes, devido ao custo das medicações biológicas e por seguir critérios para introdução dessas medicações.
Nosso estudo é um dos poucos a apresentar novas variáveis ultrassonográficas, inclusive uma avaliação de medição automatizada da camada média e íntima da carótida por radiofrequência e a correlação com outras variáveis em pacientes com Ps. Todas as medições de ultrassom foram feitas por médico com extensa experiência em US e tem sido demonstrado que médicos que não são especialistas em US vascular podem fazer avaliações confiáveis de QIMT carotídea.9
A avaliação dos possíveis danos aterogênicos ocasionados por um processo inflamatório como o decorrente da Ps e a identificação de DCV subclínica devem ser feitas por todos os profissionais da área e alertar o paciente dos riscos de DCV e se necessário encaminhar ao especialista para acompanhamento e terapia adequada das comorbidades.
O uso da US na dermatologia ainda é pouco comum, porém é um método não invasivo, de baixo custo e amplamente acessível. As técnicas têm evoluído e o ultrassom com Doppler espectral com o uso da técnica QIMT é o mais apropriado para reações inflamatórias, permite a visualização de alterações ateroscleróticas na parede do vaso causada pela atividade inflamatória crônica que ocorre em algumas doenças dermatológicas, como a Ps.
ConclusãoEm relação à comparação do RCV nos dois grupos (MTX e Anti‐TNF‐α), não houve diferença estatisticamente significativa entre o RCV (medido por escore de Framingham e QIMT) em relação aos grupos de tratamento. Portanto, não se pode establecer qual medicamento apresenta maior RCV.
Neste estudo, foi comprovada a associação de Ps e SM, além de resultados muito alterados para obesidade, circunferência abdominal e IMC.
Também foi observada uma associação positiva de moderada a forte correlacionando os valores do escore de Framingham com a mensuração do QIMT, o que provê evidências para uso do ultrassom na prática clínica.
Suporte financeiroNenhum.
Contribuição dos autoresElaine Cristina Faria Abrahão Machado: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
José Alexandre Mendonça: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Ana Carolina Belini Bazán Arruda: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Luciana Bertoldi Nucci: Análise estatística; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Marcel Alex Soares dos Santos: Elaboração e redação do manuscrito; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Abrahão‐Machado ECF, Mendonça JA, Arruda ACBB, Nucci LB, Santos MAS. Analysis of cardiovascular risk and carotid intima‐media thickness in patients with psoriasis. An Bras Dermatol. 2020;95:150–7.
Trabalho realizado no Hospital da Pontifícia Universidade Católica de Campinas, Campinas, SP, Brasil.