A incidência e a mortalidade do melanoma têm aumentado em muitos países, inclusive no Brasil. Estudos de sobrevida ainda são escassos no nosso país, mas muito necessários para se conhecer e abordar melhor esse problema.
ObjetivoAnalisar a sobrevida doença‐específica dos pacientes com melanoma invasivo e correlacioná‐la com variáveis clínicas e histopatológicas.
MétodosEstudo analítico de coorte retrospectiva em 565 casos de melanoma invasivo num hospital terciário com o objetivo de testar variáveis que poderiam estar associadas a pior prognóstico, como sexo, fototipo, espessura, tipo histológico e presença de lesão clínica pré‐existente no local do tumor.
ResultadosAs piores taxas de sobrevida estiveram significativamente associadas com tumores espessos (p < 0,001), sexo masculino (p = 0,014), fototipo alto (p = 0,047), melanoma nodular (p = 0,024) e lesões “de novo” (p = 0,005). Quando ajustamos as variáveis para a espessura do melanoma, os pacientes do sexo masculino (p = 0,011) e os melanomas “de novo” (p = 0,025) mantiveram‐se associados com uma menor sobrevida.
Limitações do estudoEstudo retrospectivo e de um único hospital terciário.
ConclusãoEmbora as causas sejam ainda desconhecidas, a sobrevida melanoma‐específico mostrou‐se estatisticamente pior para homens e para melanomas “de novo” mesmo após o ajuste da espessura do tumor.
O melanoma é um câncer de pele que mata mais do que todos os outros cânceres de pele somados, mesmo que contabilize menos de 5% de todos os casos.1 Recentemente, muitas terapias moleculares e alvo novas foram introduzidas para estágios avançados do melanoma,2,3 mas a detecção e a cirurgia precoce ainda são os únicos métodos confiáveis para aumentar as taxas de sobrevida. A incidência e a mortalidade do melanoma têm aumentado ao redor do mundo4–8 e é um problema de saúde pública em muitos países. A incidência no mundo subiu de 11,8/100.000 habitantes em 2003–2006 para 17,5 em 2011–2014.9,10 Nos EUA, o número pulou de menos de 10 casos/100 mil habitantes (1975) para cerca de 25 (2013).5 Na Austrália, eram 27 casos/100 mil habitantes (1982) e 49 em 2012.6 Um estudo recentemente publicado com dados brasileiros mostrou que a incidência média em homens aumentou de 2,52 para 4,84 e nas mulheres de 1,33 para 3,22 casos/100.000 habitantes de 2000 a 2013 no país.11
Na Austrália, 10,2% de todos os cânceres foram diagnosticados como melanoma, nos EUA, 4,5% e no Brasil, menos do que 2,3%. Novos casos de melanomas foram 13.283 em 2012 na Austrália, 76.380 em 2013 nos EUA e 5.670 in 2012 no Brasil.4–6
São poucos os estudos epidemiológicos com enfoque nas taxas de sobrevida do melanoma no Brasil. Por essa razão, fizemos este projeto no Hospital das Clínicas da FMUSP com o objetivo de analisar os dados de sobrevida doença‐específica dos pacientes com melanoma cutâneo primário invasivo acompanhado no nosso serviço quanto ao sexo, ao fototipo de pele, ao índice de Breslow, ao tipo histológico e à presença de lesão clínica pré‐existente no local do tumor.
MétodosEste trabalho foi aprovado pelo Comitê de Ética do Hospital das Clínicas da FMUSP (CAAE: 76591317.0.0000.0068). O estudo foi desenhado para ser analítico de coorte retrospectivo com 565 casos de melanomas invasivos para testar fatores associados o pior prognóstico. Dados de pacientes com diagnóstico de melanoma acompanhados no ambulatório de oncologia cutânea do Hospital das Clínicas da FMUSP, entre janeiro de 1987 e maio de 2016 foram revisados e analisados. Os dados de sobrevida foram obtidos através da Fundação Sistema Estadual de Análise de Dados (Seade), que é uma agência governamental do Estado de São Paulo e que, gentilmente, compartilhou conosco os dados de data e causa do óbito dos pacientes do nosso serviço.
Os critérios de inclusão foram: melanoma invasivo diagnosticado entre janeiro de 1987 e maio de 2016; espessura do melanoma (índice de Breslow) medida e relatada no exame anatomopatológico.
Uma planilha mantida pelos médicos que acompanham os pacientes com melanoma foi a fonte das informações, assim como o prontuário deles, quando necessário. Os dados dos pacientes pesquisados para cada paciente foram sexo, idade ao diagnóstico, fototipo de acordo com a classificação de Fitzpatrick, localização do melanoma, presença de lesão clínica pré‐existente no local do tumor, status vital do paciente na última visita conhecida: vivo ou óbito e, nesse último caso, por que causa pelo Código Internacional de Doenças (CID). Pacientes que fizeram seguimento por menos de 3 meses a partir da data do diagnóstico ou que não apresentavam a data da última consulta na planilha foram considerados como perdidos quanto ao seu status vital. Fototipos I, II e III foram classificados como baixo e IV, V e VI, como alto.
Os dados coletados a partir dos laudos histopatológicos foram: índice de Breslow, tipo histológico, presença de ulceração e regressão, número de mitoses (medido de acordo com a recomendação da AJCC: American Joint Committee on Cancer) e status do linfonodo sentinela. Para os pacientes que apresentaram mais de um melanoma primário invasivo, optamos pelos dados do tumor mais espesso para a análise da sobrevida‐específica. Os dados de sobrevida da Fundação Seade foram obtidos através do cruzamento das seguintes informações: nome e data de nascimento do paciente, nome da mãe, data e causa da morte.
A análise de sobrevida foi usada para avaliar a sobrevida global para os pacientes com melanoma. Curvas de sobrevida foram construídas pelo método de Kaplan‐Meier e comparadas pelo teste log‐rank. Os tempos médio e mediano, assim como o erro‐padrão, foram calculados para sobrevida global de todos os pacientes e para cada categoria das variáveis independentes.
A regressão de Cox foi usada para o cálculo dos hazard ratio (HR) e os respectivos intervalos com 95% de confiança para cada uma das variáveis independentes. O modelo final foi ajustado por todas as variáveis independentes. Adicionalmente, cada uma das variáveis – sexo, fototipo e lesão clínica pré‐existente ou “de novo” – foi ajustada pelo índice de Breslow. O nível de significância adotado foi de 5%. As análises foram feitas nos softwares estatísticos SPSS v.18 for Windows e Stata v.11.
ResultadosA planilha do ambulatório de oncologia cutânea do Hospital das Clínicas da FMUSP usada para armazenar os dados dos pacientes com melanoma acompanhados no serviço contava com 906 pacientes, desde seu início entre janeiro de 1987 e maio de 2016. De acordo com os critérios definidos acima, excluímos 173 casos de melanoma in situ e 177 que, apesar de invasivos, não apresentavam o índice de Breslow reportado no laudo histopatológico. Por essa razão, nossa coorte continha 556 pacientes. Como nove deles tiveram dois melanomas invasivos primários distintos, esta pesquisa incluiu 565 melanomas.
Parâmetros clínicos e histopatológicosPara se ter uma ideia da robustez da população estudada, a tabela 1 resume todos os dados clínicos e histopatológicos computados. De forma sucinta, podemos afirmar que a nossa coorte era em sua maioria de pacientes do sexo feminino (61%); que a maior frequência do diagnóstico ocorreu entre os 50 e 80 anos (60%), com média de 56,6 anos. Em relação ao fototipo de Fitzpatrick, o tipo II foi o mais frequente (44%), seguido pelo tipo III (29%). Os locais mais frequentes de surgimento dos melanomas invasivos foram tronco com 37%, seguido por membros com 34%, cabeça e pescoço, 16% e extremidades (pés e mãos) 12%.
Características clínicas e parâmetros histológicos dos pacientes com melanoma cutâneo primário invasivo acompanhados pelo Ambulatório de Oncologia cutânea do Departamento de Dermatologia do HC‐FMUSP de 1987 a maio de 2016
| Característica | n (%) | |
|---|---|---|
| Sexo | ||
| Masculino | 218 (39) | |
| Feminino | 338 (61) | |
| Idade ao diagnóstico (anos) | 0–10 | 1 (0.2) |
| 10–19 | 0 (0) | |
| 20–29 | 24 (4) | |
| 30–39 | 54 (10) | |
| 40–49 | 99 (18) | |
| 50–59 | 118 (21) | |
| 60–69 | 138 (25) | |
| 70–79 | 80 (14) | |
| 80–89 | 28 (5) | |
| 90–100 | 6 (1) | |
| Sem informação | 8 (1) | |
| Fototipo segundo Fitzpatrick | I | 22 (4) |
| II | 247 (44) | |
| III | 159 (29) | |
| IV | 26 (5) | |
| V | 12 (2) | |
| VI | 0 (0) | |
| Sem informação | 89 (16) | |
| Local | Cabeça/Pescoço | 90 (16) |
| Tronco | 211 (37) | |
| Membros | 196 (34) | |
| Extremidades | 68 (12) | |
| Índice de Breslow | ≤ 1,0 | 279 (51) |
| 1,01–2,00 | 120 (21) | |
| 2,01–4,00 | 85 (15) | |
| >4,0 | 81 (14) | |
| Ulceração | Presente | 60 (10) |
| Ausente | 450 (80) | |
| Sem informação | 55 (10) | |
| Regressão | Presente | 63 (11) |
| Ausente | 424 (75) | |
| Sem informação | 78 (14) | |
| Tipo histológico | Extensivo superficial | 262 (46) |
| Nodular | 62 (11) | |
| Lentigo maligno | 45 (8) | |
| Lentiginoso acral | 51 (9) | |
| Não classificado | 6 (1) | |
| Sem informação | 139 (25) | |
| Mitose | Presente | 87 (15) |
| Ausente | 66 (12) | |
| Sem informação | 412 (73) | |
| Linfonodo sentinela | Positivo | 24 (4) |
| Negativo | 89 (16) | |
| Não realizado | 31 (5) | |
| Sem informação | 421 (75) | |
| Lesão pré‐existente | Sim | 199 (35) |
| Não | 285 (51) | |
| Ignorado | 13 (2) | |
| Sem informação | 68 (12) |
O índice de Breslow médio para todos os melanomas foi 2,01 mm. Melanomas ≤ 1,0 mm foram 51% dos casos; 21% estavam entre 1,01 e 2,0 mm; 15% entre 2,01 e 4,0 mm e 14% com espessura > 4,0 mm. A ulceração e a regressão foram identificadas em 10% e 11% dos tumores, respectivamente. O melanoma extensivo superficial contabilizou 46% dos casos; seguido pelo tipo nodular, com 11%, lentiginoso acral, com 9%, e lentigo maligno melanoma, com 8%. Mitoses estiveram presentes em 15% dos melanomas, ausentes em 12% deles e 73% dos laudos não especificavam essa informação. A pesquisa do linfonodo sentinela mostrou que 16% foram negativos, 4%, positivos e que nos demais 80% não havia sido feita. Quanto à presença de lesão clínica pré‐existente, 51% negaram, 35% confirmaram e 14% não souberam informar.
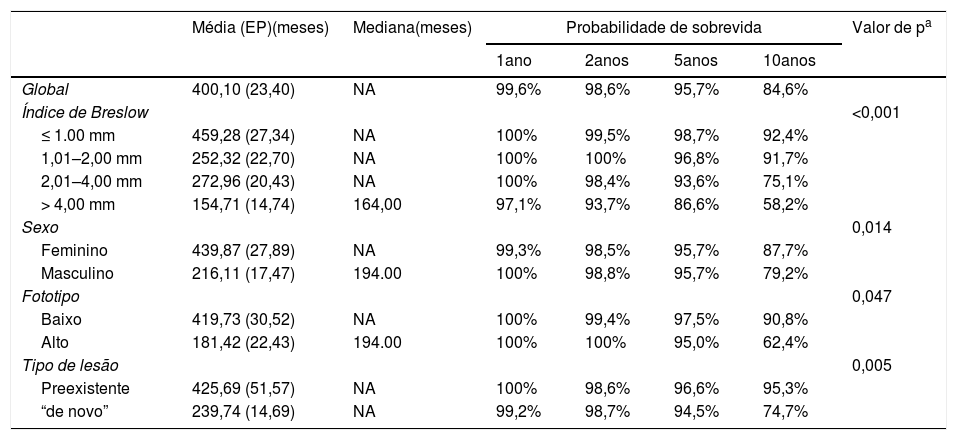
Sobrevida melanoma‐específicaNeste estudo foram incluídos 556 pacientes com melanoma, dos quais 521 (93,7%) tinham informação disponível sobre status vital (vivo ou óbito). Dos pacientes com informação disponível, 463 (88,9%) estavam vivos e 58 (11,1%) eram óbitos. A análise de sobrevida foi considerada em meses, cálculo das probabilidades de sobrevida em um ano, 2 anos, 5 anos e 10 anos e foi feita pelo método de Kaplan‐Meier. Valores do tempo médio, mediano e do erro‐padrão foram apresentados para o total de pacientes e segundo as variáveis índice de Breslow, sexo, fototipo e tipo de lesão (pré‐existente ou “de novo”). A comparação das curvas de sobrevida apontou diferenças estatisticamente significativas entre as categorias do índice de Breslow (p < 0,001); gênero (p = 0,014); fototipo (p = 0,047) e tipo de lesão (p = 0,005) (tabela 2).
Probabilidade de sobrevida global de acordo com o índice de Breslow
| Média (EP)(meses) | Mediana(meses) | Probabilidade de sobrevida | Valor de pa | ||||
|---|---|---|---|---|---|---|---|
| 1ano | 2anos | 5anos | 10anos | ||||
| Global | 400,10 (23,40) | NA | 99,6% | 98,6% | 95,7% | 84,6% | |
| Índice de Breslow | <0,001 | ||||||
| ≤ 1.00 mm | 459,28 (27,34) | NA | 100% | 99,5% | 98,7% | 92,4% | |
| 1,01–2,00 mm | 252,32 (22,70) | NA | 100% | 100% | 96,8% | 91,7% | |
| 2,01–4,00 mm | 272,96 (20,43) | NA | 100% | 98,4% | 93,6% | 75,1% | |
| > 4,00 mm | 154,71 (14,74) | 164,00 | 97,1% | 93,7% | 86,6% | 58,2% | |
| Sexo | 0,014 | ||||||
| Feminino | 439,87 (27,89) | NA | 99,3% | 98,5% | 95,7% | 87,7% | |
| Masculino | 216,11 (17,47) | 194.00 | 100% | 98,8% | 95,7% | 79,2% | |
| Fototipo | 0,047 | ||||||
| Baixo | 419,73 (30,52) | NA | 100% | 99,4% | 97,5% | 90,8% | |
| Alto | 181,42 (22,43) | 194.00 | 100% | 100% | 95,0% | 62,4% | |
| Tipo de lesão | 0,005 | ||||||
| Preexistente | 425,69 (51,57) | NA | 100% | 98,6% | 96,6% | 95,3% | |
| “de novo” | 239,74 (14,69) | NA | 99,2% | 98,7% | 94,5% | 74,7% | |
EP, erro‐padrão; NA, não avaliável.
Conforme mostra a tabela 2, a sobrevida global diminui com os anos. De 99,6% em um ano passa para 84,6% em 10 anos. Quanto maior o índice de Breslow, menores as taxas de sobrevida. As mulheres apresentaram melhor sobrevida do que os homens, assim como fototipos baixos em comparação com os altos e haver lesão clínica pré‐existente no sítio do aparecimento do melanoma em relação àqueles que apareceram “de novo”.
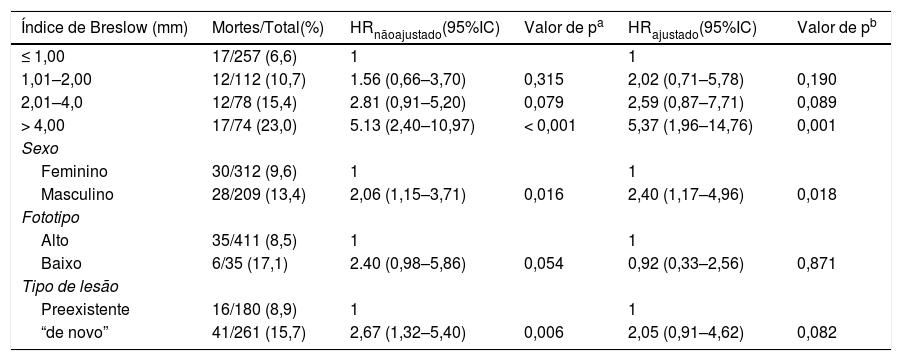
Na avaliação dos fatores relacionados com a sobrevida global, usou‐se a regressão de Cox não ajustada e ajustada. Valores de hazard ratio (HR) e seus respectivos intervalos com 95% de confiança foram calculados e apresentados na tabela 3. O índice de Breslow continuou fortemente significativo, mostrou que tumores mais espessos, especialmente maiores do que 4 mm, têm uma sobrevida pior do que os finos (p = 0,001). Pacientes do sexo feminino mantiveram um melhor prognóstico que do masculino (p = 0,018). Já nesta análise, o fototipo alto versus baixo e a presença ou não de lesão clínica pré‐existente não foram associados à taxa de sobrevida.
Sobrevida global em pacientes com melanoma com o uso da regressão de Cox
| Índice de Breslow (mm) | Mortes/Total(%) | HRnãoajustado(95%IC) | Valor de pa | HRajustado(95%IC) | Valor de pb |
|---|---|---|---|---|---|
| ≤ 1,00 | 17/257 (6,6) | 1 | 1 | ||
| 1,01–2,00 | 12/112 (10,7) | 1.56 (0,66–3,70) | 0,315 | 2,02 (0,71–5,78) | 0,190 |
| 2,01–4,0 | 12/78 (15,4) | 2.81 (0,91–5,20) | 0,079 | 2,59 (0,87–7,71) | 0,089 |
| > 4,00 | 17/74 (23,0) | 5.13 (2,40–10,97) | < 0,001 | 5,37 (1,96–14,76) | 0,001 |
| Sexo | |||||
| Feminino | 30/312 (9,6) | 1 | 1 | ||
| Masculino | 28/209 (13,4) | 2,06 (1,15–3,71) | 0,016 | 2,40 (1,17–4,96) | 0,018 |
| Fototipo | |||||
| Alto | 35/411 (8,5) | 1 | 1 | ||
| Baixo | 6/35 (17,1) | 2.40 (0,98–5,86) | 0,054 | 0,92 (0,33–2,56) | 0,871 |
| Tipo de lesão | |||||
| Preexistente | 16/180 (8,9) | 1 | 1 | ||
| “de novo” | 41/261 (15,7) | 2,67 (1,32–5,40) | 0,006 | 2,05 (0,91–4,62) | 0,082 |
HR, hazard ratio; 95% IC, 95% intervalo de confiança.
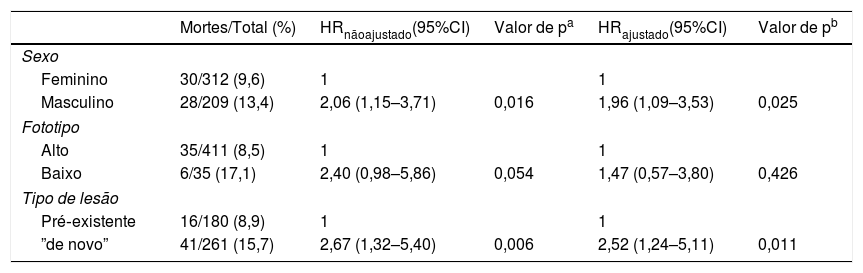
A seguir, quisemos verificar o modelo de regressão de Cox e ajustamos cada uma das variáveis independentes pelo índice de Breslow. Os resultados são apresentados na tabela 4. Somente a variável fototipo não resultou significativa na comparação das curvas de sobrevida ajustada pelo índice de Breslow (p = 0,426). O sexo (p = 0,025) e o tipo de lesão (p = 0,011) apresentaram diferenças significativas nas curvas de sobrevida ajustadas pelo índice de Breslow. As mulheres e os melanomas que surgiram sobre lesões clínicas pré‐existentes permaneceram com melhor sobrevida quando comparados aos homens e aos melanomas “de novo”, respectivamente.
Sobrevida global em pacientes com melanoma ajustado para o índice de Breslow com o uso da regressão de Cox
| Mortes/Total (%) | HRnãoajustado(95%CI) | Valor de pa | HRajustado(95%CI) | Valor de pb | |
|---|---|---|---|---|---|
| Sexo | |||||
| Feminino | 30/312 (9,6) | 1 | 1 | ||
| Masculino | 28/209 (13,4) | 2,06 (1,15–3,71) | 0,016 | 1,96 (1,09–3,53) | 0,025 |
| Fototipo | |||||
| Alto | 35/411 (8,5) | 1 | 1 | ||
| Baixo | 6/35 (17,1) | 2,40 (0,98–5,86) | 0,054 | 1,47 (0,57–3,80) | 0,426 |
| Tipo de lesão | |||||
| Pré‐existente | 16/180 (8,9) | 1 | 1 | ||
| ”de novo” | 41/261 (15,7) | 2,67 (1,32–5,40) | 0,006 | 2,52 (1,24–5,11) | 0,011 |
HR, hazard ratio; 95% CI, 95% intervalo de segurança.
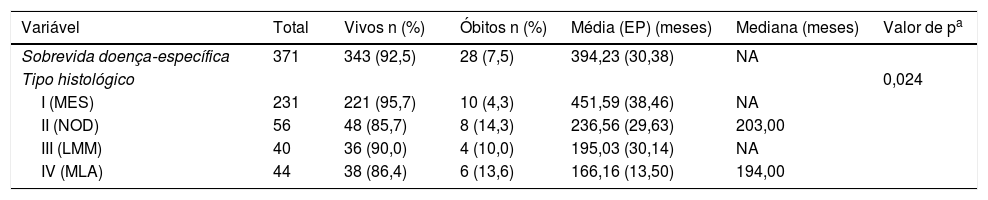
Para testar a sobrevida específica da doença de acordo com o tipo histológico, testamos os quatro tipos principais, classificados da seguinte forma: I: melanoma extensivo superficial; II: melanoma nodular; III: lentigo maligno melanoma e IV: melanoma lentiginoso acral. Os subtipos histológicos mostraram diferentes curvas de sobrevida com significância estatística (p = 0,024) (tabela 5). O subtipo extensivo superficial foi o que apresentou a maior porcentagem de pacientes vivos no fim do estudo, diferenciou‐se dos demais.
Sobrevida doença‐específica em pacientes com melanoma segundo tipo histológico
| Variável | Total | Vivos n (%) | Óbitos n (%) | Média (EP) (meses) | Mediana (meses) | Valor de pa |
|---|---|---|---|---|---|---|
| Sobrevida doença‐específica | 371 | 343 (92,5) | 28 (7,5) | 394,23 (30,38) | NA | |
| Tipo histológico | 0,024 | |||||
| I (MES) | 231 | 221 (95,7) | 10 (4,3) | 451,59 (38,46) | NA | |
| II (NOD) | 56 | 48 (85,7) | 8 (14,3) | 236,56 (29,63) | 203,00 | |
| III (LMM) | 40 | 36 (90,0) | 4 (10,0) | 195,03 (30,14) | NA | |
| IV (MLA) | 44 | 38 (86,4) | 6 (13,6) | 166,16 (13,50) | 194,00 |
EP, erro‐padrão; LMM, lentigo maligno melanoma; MES, melanoma extensivo superficial; MLA, melanoma lentiginoso acral; NA, não avaliável; NOD, melanoma nodular.
A tabela 6 analisa a sobrevida doença‐específica dos pacientes com melanoma de acordo com o tipo histológico e o índice de Breslow. De forma univariada, com HR não ajustado, vemos que os tipos histológicos II (nodular) e lV (lentiginoso acral), assim como o Breslow, apresentam diferença significativa em relação ao tipo extensivo superficial. Já na análise multivariada, com HR ajustado, não houve correlação entre tipo histológico e sobrevida.
Regressão de Cox univariada e múltipla para a sobrevida doença específica em pacientes com melanoma segundo tipo histológico
| Variável | HRnãoajustado (95% IC) | HRajustado (95% IC) | Valor de pa |
|---|---|---|---|
| Tipo histológico | |||
| I (MES) | 1,00 | 1,00 | |
| II (NOD) | 2,95 (1,16–7,50) | 1,21 (0,32–4,58) | 0,774 |
| III (LMM) | 3,02 (0,94–9,64) | 3,18 (0,99–10,18) | 0,051 |
| IV (MLA) | 3,49 (1,26–9,68) | 2,54 (0,87–7,43) | 0,088 |
| Breslow | 1,18 (1,07–1,29) | 1,18 (1,02–1,36) | 0,027 |
95% IC, intervalo de confiança de 95%; HR, hazard ratio; LMM, lentigo maligno melanoma; MES, melanoma extensivo superficial; MLA, melanoma lentiginoso acral; NOD, melanoma nodular.
Os resultados apresentados na tabela 1 confirmam a robustez da nossa amostra e apresentam muitas semelhanças com outros trabalhos publicados recentemente no Brasil. Dois trabalhos demonstraram a maior incidência de melanoma diagnosticados em mulheres,10,11 assim como o nosso. Outro estudo revelou maior frequência de melanomas no tronco e do tipo extensivo superficial, semelhantemente aos nossos dados. No entanto, foi observada maior prevalência de tumores com índice de Breslow intermediário e espesso, o que difere da nossa casuística, que apresenta mais tumores finos.12
A taxa de mortalidade do melanoma também tem aumentado com os anos. O Brasil tinha 0,06 em 1979 e 0,13 por 100.00 habitantes em 2014.4 Na Austrália, um dos países com maior incidência dessa patologia no mundo, era 3,3 em 1968 e 6,2 por 100.000 habitantes em 2013.6 Recentemente publicado, um estudo brasileiro que usou um banco de dados com mais de 28 mil indivíduos revelou um aumento da mortalidade de 0,85 para 0,9/100.000 habitantes em homens e uma diminuição de 0,56 para 0,53/100.000 habitantes em mulheres de 2000 a 2014.11
A taxa de sobrevida em 5 anos do melanoma na Austrália, nos EUA e na Holanda é respectivamente 90%, 91,5% e 86%. No nosso estudo, foi de 95,7% em 5 anos, lembramos que incluímos somente casos invasivos, o que, em tese, deveria piorar a nossa estatística de sobrevida. Também se deve levar em conta que perdemos o seguimento de uma parte dos pacientes, por falta às consultas ou por ausência de dados como o índice de Breslow, que não foi em determinado em 17% dos casos e os óbitos ocorridos fora do Estado de SP, o que pode trazer algum viés ao estudo. Outra limitação do projeto é o fato de ser retrospectivo e ter sido conduzido num centro único terceirizado, o que pode não refletir, necessariamente, as condições do país na sua generalidade, como as taxas dos países citados anteriormente.4–6,13,14
O índice de Breslow é um parâmetro aceito para estadiar os melanomas e predizer a sobrevida melanoma‐específico. Os indivíduos com tumores mais finos têm uma melhor sobrevida, como pode ser observado na nossa análise de sobrevida doença‐específica e em outras publicações.15,16 Nossos dados mostram que somente 7,6% dos tumores ≤ 1,0 mm morreram por melanoma em 10 anos contra 41,8% daqueles mais espessos do que 4,0 mm no mesmo período. A chance de morte de um paciente com melanoma com Breslow > 4,0 mm é 5,37× do maior que um indivíduo com melanomas com Breslow ≤ 1,0 mm. Vale a pena destacar que, de toda forma, mesmo tumores finos (≤ 1,0 mm) levaram à morte em 7,6% dos casos (tabela 2).
A sobrevida na nossa casuística se mostrou diferente de acordo com o sexo. Os homens tiveram um prognóstico significativamente pior do que as mulheres. Ser homem aumentou a chance de morte por melanoma (tabela 3). Nos EUA, isso também é verdade: há 4,1 mortes em homens e 1,7 em mulheres por 100,00 pessoas;5,15 no Japão, a sobrevida em 140 meses foi de 70,6% em mulheres e 60% em homens.8 Um estudo na Inglaterra também reportou que ser homem teve um impacto negativo na sobrevida.17 Em nosso estudo, mesmo após ajuste para o índice de Breslow, que isoladamente é o parâmetro mais importante na sobrevida do paciente com melanoma, os pacientes masculinos continuaram com um pior prognóstico (tabela 4), o que não havia sido testado anteriormente. As razões para isso permanecem especulativas.
Com relação a fototipo/etnia e sobrevida, encontramos uma menor taxa de sobrevida‐específica em pacientes com fototipos altos de Fitzpatrick (IV, V e VI), mas essa diferença não se manteve após o ajuste pelo índice de Breslow (tabela 4). Uma explicação para esse fato pode ser que pacientes com fototipos mais altos podem estar sendo diagnosticados mais tardiamente, o que acarreta um pior prognóstico do que aqueles com fototipos mais baixos. Problemas socioeconômicos poderiam atrasar o acesso ao sistema de saúde e/ou a crença de que câncer de pele é um problema apenas para pacientes com fototipo baixo podem contribuir para essa demora. A maioria dos estudos avalia etnia. Um artigo encontrou que pessoas negras têm uma taxa de sobrevida mais baixa, mas não ajustou para a espessura.7 Outro mostrou que negros não hispânicos têm uma taxa de sobrevida melhor do que brancos não hispânicos, o que parece contrário aos nosso achados, mas também não houve ajuste para o índice de Breslow.18
Outro achado interessante é que melanomas “de novo” são mais agressivos do que aqueles que se desenvolvem sobre lesões clínicas preexistentes (tabelas 2 e 4), o que foi corroborado em outro estudo.19 Poderíamos especular que mutações que levam à ocorrência do melanoma “de novo” poderiam causar uma doença mais agressiva do que outras mutações que ocorrem em lesões pré‐existentes.
Os tipos histológicos apresentam diferentes probabilidades de sobrevida também. Em nosso estudo, o melanoma extensivo superficial obteve maior probabilidade de sobrevida do que os outros tipos (tabela 5). Um estudo japonês revelou o melanoma nodular como tendo o pior prognóstico.8 No entanto, isso pode ocorrer não pelo subtipo de melanoma em si, mas sim porque, usualmente, ao diagnóstico, o melanoma nodular é mais espesso e o melanoma extensivo superficial, mais fino. Essa hipótese pode ser corroborada pelos nossos resultados, nos quais verificamos que, uma vez ajustado o índice de Breslow para todos os tipos histológicos de melanoma, não há diferença estatística entre a sobrevida deles.
Dados de sobrevida são a grande diferença do nosso estudo. Há alguns anos nosso hospital tem um acordo com a Fundação Seade, uma agência governamental que nos permite saber a causa e a data da morte dos pacientes. Seguramente isso é essencial para obter as curvas de mortalidade e sobrevida aqui apresentadas e, também, nos habilitar a planejar políticas de saúde pública para melhor tratar e prevenir mortes por melanoma.
ConclusãoAs análises de sobrevida dos pacientes com melanoma invasivo da nossa coorte retrospectiva mostraram associação com espessura do tumor, sexo e presença ou não de lesão clínica pré‐existente. Futuros estudos poderão verificar se há associação entre sobrevida e subtipo histológico ou fototipo do paciente, conforme nossos resultados sugerem.
Suporte financeiroPróprio e Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), projeto número: 2017/20928‐9.
Contribuição dos autoresMara Huffenbaecher Giavina‐Bianchi: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura; revisão crítica do manuscrito.
Cyro Festa Neto: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Jose Antonio Sanches Junior: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Monica La Porte Teixeira: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados.
Bernadette Cunha Valdvogel: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados.
Conflitos de interesseNenhum.
Como citar este artigo: Giavina‐Bianchi MH, Festa‐Neto C, Sanches JA, Teixeira ML, Waldvogel BC. Worse survival of invasive melanoma patients in men and “de novo” lesions. An Bras Dermatol. 2020;95:158–64.
Trabalho realizado no Departamento de Dermatologia, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.