O dermatofibroma é neoplasia fibro‐histiocítica dérmica. As células de Langerhans são as células imunocompetentes da epiderme e representam a primeira barreira de defesa do sistema imunológico em relação ao meio ambiente. Este estudo teve como objetivo comparar imuno‐histologicamente a densidade das células de Langerhans positivas para S100 na epiderme peritumoral saudável com as células da epiderme sobrejacente a dermatofibromas (20 casos), usaram‐se anticorpos contra a molécula S100 (um marcador imunofenotípico das células de Langerhans). O grupo controle (pele normal e saudável) incluiu 10 indivíduos saudáveis, pareados por sexo e idade, que foram submetidos a biópsias de lesões cutâneas benignas. Observou‐se densidade significativamente alta das células de Langerhans na epiderme da pele saudável (6,00 ± 0,29) e na epiderme peritumoral (6,44 ± 0,41) quando comparadas àquelas na epiderme que recobria o tumor (1,44 ± 0,33; p < 0,05). O déficit quantitativo das células de Langerhans na epiderme sobrejacente ao dermatofibroma pode ser um fator possível em seu desenvolvimento.
As células de Langerhans (CL) são as células apresentadoras de antígeno exclusivas da epiderme humana normal. Elas se originam de duas fontes: do saco vitelino extraembrionário e de precursores (monócitos) no fígado fetal. As CL representam cerca de 3% da população celular na epiderme e são vistas em cortes histológicos corados com hematoxilina e eosina como “células claras” nas camadas suprabasais. A expressão de CD1a, langerina e S100 são os marcadores imunofenotípicos que distinguem as CL de outras células dendríticas.1
As CL desempenham papel relevante na vigilância imunológica e, após a ativação, migram da epiderme para os linfonodos. As CL podem capturar antígenos, ativar células T indiferenciadas (naive) e desencadear uma resposta imune específica de células T com sua expansão e diferenciação clonal em células T efetoras e de memória.2 Alterações na distribuição das CL ocorrem na epiderme peritumoral e na epiderme que cobre os tumores dérmicos.3 Dermatofibroma é um tumor dermatológico comum que geralmente afeta os membros inferiores de mulheres. Alguns autores consideram o dermatofibroma um processo reativo, mas outros o consideram tumor benigno de fibroblastos, miofibroblastos ou mesmo dendrócitos dérmicos.4 O presente estudo compara a densidade de CL positivas para S100 na epiderme peritumoral e na epiderme que recobre as células neoplásicas no dermatofibroma.
Este estudo retrospectivo incluiu amostras de pele fixadas em formalina e emblocadas em parafina de 20 casos de dermatofibroma. A idade média dos pacientes foi de 49,40 ± 3,34 anos. As amostras foram coletadas de pacientes sem histórico de alterações imunológicas. O grupo controle (pele normal e saudável) incluiu 10 indivíduos saudáveis, pareados por sexo e idade, submetidos a biópsias de pele por lesões benignas, bem como a pele peritumoral saudável (pele saudável adjacente aos tumores). Os tecidos fixados em formalina e emblocados em parafina foram submetidos a análise imuno‐histológica para CL com anticorpos contra o antígeno S100, usou‐se o método da peroxidase/diaminobenzidina, similarmente a estudo anterior.5 Os controles externos incluíram melanoma (para S100). Os controles negativos incluíram cortes histológicos que não foram incubados com os anticorpos primários (substituídos por PBS).5 Os controles positivos e negativos produziram resultados positivos e negativos, respectivamente, indicaram a validade dos resultados.
As células imunorreativas com S100 foram contadas com microscópio óptico Olympus, como relatado por outros grupos.6 As imagens foram feitas com câmera digital DFC450. A epiderme foi examinada sob pequeno aumento e os hot spots foram identificados. As CL positivas para S100 em cada 1.000 células epidérmicas foram contadas com aumento de ×400. As CL imunorreativas com imunocoloração marrom ou vermelha e um núcleo visível foram consideradas positivas, bem como os dendritos. Os resultados foram relatados como média e erro padrão das médias. Foi usado o teste t de Student, com p < 0,05 considerado estatisticamente significativo.
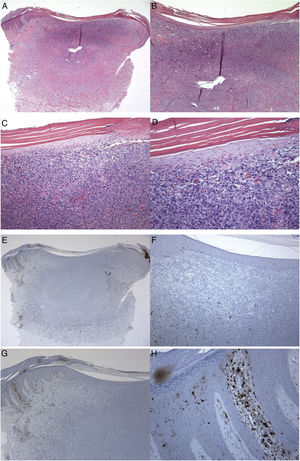
CL positivas para S100 foram observadas na camada espinhosa (corpos celulares), seus dendritos se estendiam para as camadas suprabasal e para a córnea, tanto na epiderme saudável (grupo controle), na epiderme peritumoral quanto na epiderme que recobre o tumor (dermatofibroma). Não foram observadas CL nas camadas granulosa e córnea (fig. 1). As densidades das CL positivas para S100 foram 6,00 ± 0,29 na epiderme da pele saudável e 6,44 ± 0,41 na epiderme peritumoral. Nos dermatofibromas, as densidades de CL positivas para S100 variaram entre a epiderme peritumoral e a epiderme que recobre o tumor. A densidade média dessas células na epiderme acima do dermatofibroma foi de 1,44 ± 0,33. A diferença de densidade de CL positivas para S100 entre a pele saudável (pele normal/grupo controle e epiderme peritumoral) e epiderme tumoral foi estatisticamente significante (p < 0,000; fig. 1).
Paciente do sexo masculino, 35 anos, com lesão ceratótica na coxa esquerda. A observação clínica incluiu dermatofibroma e acantoma no diagnóstico diferencial. (A‐D), histologicamente, observa‐se epiderme hiperparaceratótica sobrejacente a uma proliferação dérmica mal delimitada, composta por células fusiformes intersticiais mitoticamente inativas. Algumas áreas do tumor (porção superior) eram densamente celulares, enquanto outras (porções média e inferior) eram escleróticas e hipocelulares. A epiderme sobrejacente se apresenta atenuada sobre o tumor quando comparada à epiderme peritumoral hiperplásica. Dentro do tumor, observa‐se aprisionamento de colágeno, vasos de paredes finas e hemorragia. (E‐H), epiderme peritumoral que mostra várias células de Langerhans positivas para S100 localizadas principalmente na camada espinhosa. As células de Langerhans estão quase ausentes na epiderme que cobre o tumor. Ampliações: A e E, 20×; B e F, 40×; C e G, 100 ×; D e H, 400×.
Subsequentemente, as CL foram examinadas e pontuadas na área peritumoral saudável adjacente da epiderme e na área epidérmica que recobre as células neoplásicas fibro‐histiocíticas do dermatofibroma. No presente estudo, o número de CL que expressaram a molécula S100 foi menor na epiderme que recobre o dermatofibroma do que nas amostras de pele peritumoral saudável. Essas variações confirmam o déficit quantitativo das CL como um possível fator no desenvolvimento do dermatofibroma e são similares aos resultados de estudos anteriores em outros tumores de pele.6 Shevchuk et al. examinaram os valores de expressão de CL por meio de anticorpos contra CD1a e langerina (marcadores fenotípicos para LCs) com imuno‐histoquímicos em pele saudável, ceratose actínica, carcinoma basocelular e carcinoma espinocelular. Em comparação com a pele normal, a densidade de CL foi menor no carcinoma basocelular e carcinoma espinocelular.6
O aumento da densidade de CL na epiderme peritumoral do dermatofibroma sugere forte resposta imunológica dessa área para impedir o crescimento do tumor, resulta em uma forma mais localizada e restrita da proliferação fibro‐histiocítica dérmica. Essa suprarregulação das CL pode ser devida a alterações nos fatores de crescimento e citocinas,7 apoptose e nos efeitos citotóxicos diretos das células tumorais. Várias proteínas estão associadas ao desenvolvimento, à diferenciação e manutenção de CL, entre as quais o fator de crescimento transformador beta (TGFβ), IL‐34, BMP‐7, integrina (ITG) avb6 e ITGavb8.7,8 Esse autor propõe que o aumento da densidade de CL na epiderme peritumoral do dermatofibroma se deve à suprarregulação dessas moléculas. As ativinas A (membros da família TGFβ) podem induzir a diferenciação de monócitos humanos em CL e, portanto, são importantes para preencher a epiderme com CL.9 Prurido (trauma mecânico) e alterações inflamatórias sobrepostas são eventos comuns associados ao dermatofibroma (dermatofibroma irritado ou inflamado). É possível que o trauma mecânico e a resposta inflamatória associada sejam os mecanismos subjacentes à perda de CL na epiderme que cobre o tumor. Como respaldo a essa hipótese, as CL deixam a epiderme em resposta a estímulos inflamatórios ou a remoção delicada com fita adesiva (tape stripping).10 Também é possível que as células neoplásicas do dermatofibroma exerçam efeitos citotóxicos diretos nas CL; a perda dessas células pode ser reflexo desses efeitos.
O presente estudo observou redução no número de CL epidérmicas positivas para S100 sobre as áreas do tumor em comparação com o observado na epiderme peritumoral. É importante avaliar as alterações das moléculas que contribuem para o déficit quantitativo de CL na epiderme que cobre o dermatofibroma, como TGFβ, IL‐34, BMP‐7, ITGavb6 e ITGavb8.7,8
Suporte financeiroNenhum.
Contribuição do autorMahmoud Rezk Abdelwhaed Hussein: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Hussein MRA. Immunohistochemical analysis of S100‐positive epidermal Langerhans cells in dermatofibroma. An Bras Dermatol. 2020;95:627–30.
Trabalho realizado no Departamento de Patologia, Assuit University Hospital, Assuit University, Assuit, Egito.