A cirurgia micrográfica de Mohs é técnica cirúrgica especializada para o tratamento de determinados tipos de câncer de pele. Certos cânceres de pele apresentam “raízes” que podem não ser observadas se as margens do tumor excisado forem analisadas por amostragem, como é feito na análise histopatológica convencional, em que o fragmento retirado é examinado após clivagem na técnica conhecida como método em “pão de forma”. O método da cirurgia micrográfica de Mohs é único, pois o dermatologista (cirurgião de Mohs) atua como cirurgião e patologista, o que possibilita uma correlação precisa da ferida operatória com o mapa da cirurgia micrográfica de Mohs. Desde o trabalho inicial do Dr. Mohs, na década de 1930, a prática da cirurgia micrográfica de Mohs tornou‐se cada vez mais difundida entre as comunidades de cirurgia dermatológica em todo o mundo, e é considerada o tratamento de escolha para muitas neoplasias cutâneas malignas. A técnica preserva o máximo de tecido normal e é um procedimento seguro com poucas complicações, a maioria delas gerenciada pelos próprios cirurgiões de Mohs em seus consultórios. A cirurgia micrográfica de Mohs é indicação precisa para carcinomas basocelulares e espinocelulares de alto risco, e tem sido cada vez mais usada para melanoma e outros tumores raros, com taxas de cura superiores. Esta revisão busca familiarizar os dermatologistas com a técnica, que é de domínio da especialidade, além de explicar a diferença entre a cirurgia micrográfica de Mohs e a cirurgia convencional e discutir suas principais indicações.
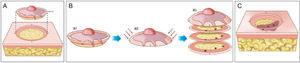
A cirurgia micrográfica de Mohs (CMM) é técnica cirúrgica especializada para o tratamento de determinados tipos de câncer de pele.1–5 A técnica tem altas taxas de cura, pois possibilita a observação microscópica completa das margens cirúrgicas, além de minimizar a retirada de tecido, preservando pele sadia (fig. 1). Certos cânceres de pele apresentam “raízes” que podem não ser detectadas se as margens do tumor excisado forem analisadas por amostragem, como é feito na análise histopatológica convencional, em que o fragmento retirado é fatiado de maneira semelhante a um “pão de forma” (fig. 2).6,7
Cirurgia micrográfica de Mohs. (A), Demarcação do tumor visível e exérese com margem entre 1 a 2mm. O fragmento de pele é excisado com o bisturi angulado a 45°, o que facilita o posicionamento das margens cirúrgicas no mesmo plano. (B), (1) Peça cirúrgica. As margens cirúrgicas que devem ser examinadas correspondem a toda porção lateral e toda porção profunda. (2) As setas indicam o “rebaixamento” das margens para o mesmo plano. (3) Após a peça ser congelada no criostato, cortes histológicos “horizontais” são realizados, possibilitando a análise de 100% das margens laterais e profunda. Os três pontos escuros correspondem a raízes do tumor observadas no exame microscópico. (C), Os pontos remanescentes de tumor são excisados para nova análise no microscópio.
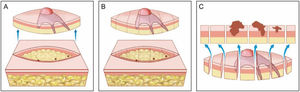
Cirurgia convencional. (A), Excisão elíptica com ampla margem cirúrgica ao redor do tumor. (B), Peça cirúrgica. As linhas pontilhadas indicam os cortes histológicos realizados verticalmente na peça, como se fosse um pão de forma (“bread‐loaf”). Esses cortes representam apenas cerca de 0,1% a 1% das margens cirúrgicas e podem deixar de detectar raízes do tumor durante o exame microscópico. Os três pontos correspondem a raízes do tumor que “ficaram” no paciente, mas não foram identificadas no exame microscópico porque não foram incluídas nos cortes histológicos examinados. (C), Correlação entre o material proveniente de exérese cirúrgica e a observação do tumor em corte longitudinal. As setas azuis indicam os cortes histológicos que são analisados na cirurgia convencional. Note a grande quantidade de margem não examinada (desenho inferior) no método convencional.
Aproximadamente 75% de todos os cânceres de pele não melanoma (CPNM) são carcinomas basocelulares (CBC), 20% são carcinomas espinocelulares (CEC); os demais são melanoma (4%) e outros tumores raros.8 A CMM é o padrão ouro no tratamento de CBC e CEC selecionados.5
O método da CMM é único, pois o dermatologista (cirurgião de Mohs) atua como cirurgião e patologista, o que possibilita uma correlação precisa da ferida operatória com o mapa da cirurgia de Mohs.6 Uma vez obtidas margens livres de tumor, o cirurgião de Mohs pode fazer a reconstrução da ferida logo em seguida. Em alguns casos, pode ser necessária abordagem multidisciplinar.
HistóriaO Dr. Frederic E. Mohs (1910‐2002), iniciou seu trabalho intitulado “quimiocirurgia” na década de 1930, mas suas descobertas não foram publicadas até 1941.9 Em 1936, o Dr. Mohs começou a usar essa técnica em pacientes considerados incuráveis. Na ocasião, aplicava uma pasta de cloreto de zinco a 20% no câncer de pele in vivo, a qual permanecia durante a noite para fixar a pele. Embora doloroso para o paciente, o método era bastante eficaz na preservação da anatomia microscópica da pele.2,6
Na década de 1960, o Dr. Theodore Tromovitch (1932‐1990), publicou um artigo usando a técnica de tecido fresco (congelação) em tumores localizados em outras partes do corpo (o Dr. Mohs fez isso em 1953, porém não foi publicado).10 Essa modificação na técnica possibilitou que o procedimento fosse realizado em um único dia.6 Em 1969, o Dr. Mohs apresentou seus dados, uma coorte de 70 CBC na pálpebra tratados com a técnica de tecido fresco. No ano seguinte, o Dr. Theodore Tromovitch publicou uma série de outros 75 casos operados com sucesso. Tais achados validaram ainda mais a eficácia desse método.2 A técnica de tecido fresco com congelação se tornou o procedimento padrão e, em 1987, o American College of Chemosurgery foi renomeado como American College of Mohs Surgery e Cutaneous Oncology para refletir essa prática.2
Desde o trabalho inicial do Dr. Mohs na década de 1930, a prática da CMM tornou‐se cada vez mais difundida entre as comunidades de cirurgia dermatológica em todo o mundo, e é considerada o tratamento de escolha para muitas neoplasias cutâneas malignas.11–15
Treinamento em CMMNos EUA e no Brasil, apenas dermatologistas podem se inscrever para uma especialização em CMM, e é necessário um mínimo de 12 meses de treinamento supervisionado pelo responsável do programa. O aprendiz deve revisar todas as lâminas histológicas dos casos cirúrgicos realizados no programa de treinamento. Alguns componentes práticos do programa são diferentes entre os dois países, principalmente em relação ao número de casos (significativamente maior nos EUA).
O principal objetivo do treinamento é saber avaliar a histopatologia e fazer a correlação do mapa cirúrgico com a ferida operatória. O treinamento também envolve reconstrução da ferida operatória para otimizar resultados estéticos e funcionais, que são, em sua maioria, realizadas pelo próprio cirurgião de Mohs.
No Brasil, a Sociedade Brasileira de Dermatologia (SBD) tem uma certificação em cirurgia micrográfica para os cirurgiões que cumprem o programa de treinamento.16 Nos EUA, os programas de treinamento em CMM são credenciados pelo Accreditation Council or Graduate Medical Education (ACGME) e pelo American College of Mohs Surgery (ACMS). Embora alguns programas de especialização, tanto em unidades privadas quanto em centros acadêmicos, tenham sido originalmente credenciados pelo ACMS, todas as especializações em CMM nos EUA agora precisam ser aprovadas pelo ACGME. Algumas especializações em outros países (Canadá e Nova Zelândia, por exemplo) têm aprovação do ACMS, mas não do ACGME. Nessas especializações, a maioria dos responsáveis treinou nos EUA e iniciou programas de treinamento em outros países. Outras sociedades, como a American Society for Dermatologic Surgery (ASDS) e a American Society for Mohs Surgery (ASMS), têm programas de treinamento em cirurgia dermatológica, porém não são centros de especialização formais de CMM.
Em outubro de 2018, o American Board of Medical Specialties (ABMS) aprovou o American Board of Dermatology (ABD) para uma nova certificação do Micrographic Dermatologic Surgery (MDS).17 De acordo com o ABD, os candidatos à certificação da subespecialidade MDS devem:
- 1.
Ter uma licença atual, válida, completa e irrestrita para praticar Medicina em pelo menos um estado ou província nos EUA ou no Canadá;
- 2.
Ter certificação em Dermatologia pelo ABD;
- 3.
Estar atualizado com a Manutenção da Certificação em Dermatologia se a certificação pelo ABD tiver um limite de tempo;
- 4.
Demonstrar experiência na subespecialidade em uma das seguintes formas: concluir com êxito a especialização Micrographic Surgery and Dermatologic Oncology (MSDO), credenciada pelo ACGME, ou provar estar praticando CMM nos últimos anos. Isso valerá para os primeiros cinco anos da implementação do exame.
- 5.
Passar no exame de certificação MDS.17
Embora não seja certo se o ACMS aceitará aqueles que passaram no exame MDS e cumpriram os requisitos mencionados anteriormente ou se as diferentes sociedades continuarão a manter certificações e reuniões separadas, após o período de cinco anos, todos os candidatos a cirurgiões de Mohs deverão treinar em centros de CMM credenciados pelo ACGME e atender aos requisitos do MDS. Além disso, é provável que as especializações em clínicas privadas diminuam em número e sejam limitadas nos próximos anos, pois agora é necessário que a especialização seja vinculada a uma instituição acadêmica com programa de residência em Dermatologia para que o treinamento em CMM possa acontecer.
Considerações pré‐operatóriasProfilaxia antibióticaA maioria dos pacientes não necessita de profilaxia antibiótica. No entanto, em alguns casos, é indicada por um dos seguintes motivos: redução da possibilidade de infecção no local da cirurgia, do risco de endocardite e do risco de infecção protética. Para redução do risco de infecção do sítio cirúrgico, as principais indicações são cirurgias nos membros inferiores (principalmente pernas) ou região inguinal, excisão em cunha do lábio ou orelha, retalhos nasais e enxertos.18
As opções de antibióticos incluem cefalexina 2g por via oral ou, para pacientes alérgicos à penicilina, clindamicina 600mg. Se a dose pré‐operatória de antibiótico for esquecida inadvertidamente, o medicamento pode ser administrado até duas horas após o procedimento.18 Existem ainda publicações demonstrando o sucesso da lidocaína juntamente com clindamicina intralesional para uma cobertura antibiótica durante a infiltração local.19–21
AnticoagulantesPreviamente à cirurgia, é necessário discutir com o paciente sobre a continuidade dos medicamentos anticoagulantes. É importante avaliar os riscos e benefícios de continuar ou interromper seu uso.22 Em geral, se o paciente tiver histórico de eventos trombóticos (prevenção secundária), os medicamentos devem ser continuados. Se eles são usados para prevenção primária e o risco de sangramento pode prejudicar significativamente o resultado cirúrgico, a discussão com o médico assistente sobre a interrupção é uma opção. Caso contrário, a recomendação é manter a prescrição original.23
Em 2011, um estudo demonstrou que o clopidogrel teve 28 vezes mais chances do que nenhuma anticoagulação e seis vezes mais do que a aspirina de resultar em complicações após a CMM (sangramento, hematoma e infecção). Importante mencionar que nenhuma complicação foi fatal.24 Em outro estudo com 2.790 pacientes, 68 foram submetidos à cirurgia enquanto tomavam varfarina (2,4%). O sangramento intraoperatório foi facilmente controlado e não houve nenhum registro de hemorragia no pós‐operatório.25 Os novos anticoagulantes, dabigatran e rivaroxaban, não demonstraram sangramento grave em dois estudos.23,26
Também é importante mencionar que eventos vasculares adversos graves foram relatados após a descontinuação de anticoagulantes. Em alguns casos, esses eventos trombóticos resultaram em comprometimento grave ou morte.27 Ou seja, com base na literatura, a medicação anticoagulante e antiplaquetária clinicamente necessária deve ser continuada durante a CMM. Em geral, as complicações hemorrágicas são incomuns e fáceis de gerenciar. Atenção especial deve ser dada à hemostasia intraoperatória. Além disso, o uso de curativo compressivo deve ser considerado em pacientes que tomam anticoagulantes, em particular clopidogrel e varfarina.22
Marca‐passos e desfibriladores cardíacos implantáveisO uso de eletrocautério para obter hemostasia é um tema importante em pacientes com marca‐passo, desfibrilador ou outros dispositivos cardíacos eletrônicos implantados (DCEI).2 Uma revisão retrospectiva de prontuários de pacientes com marca‐passo (n=173) ou cardiodesfibrilador implantável (n=13) submetidos à CMM ou excisão local ampla não apresentou complicações documentadas da eletrocirurgia.28
Um estudo in vitro concluiu que os hyfrecators são seguros para uso em pacientes com desfibriladores. Os autores investigaram as margens de segurança e relataram que, para marca‐passos, foi observada inibição atrial a 3cm nas configurações máximas do hyfrecator e a 1cm nas configurações normais de uso.29 Um recente estudo retrospectivo in vivo não relatou efeitos perioperatórios adversos em dispositivos cardíacos implantáveis.30
A falta de complicações associadas a marca‐passos e DCEI com eletrocirurgia é tranquilizadora. Os autores apoiam recomendações publicadas sobre técnicas e precauções para otimizar a segurança durante a eletrocirurgia em pacientes com dispositivos cardíacos. O atendimento a pacientes com DCEI, em particular, requer consideração especial.28 A discussão com o cardiologista assistente é importante, pois alguns DCEI podem ser temporariamente desligados com um ímã.31 Outra possibilidade, em alguns casos, é o uso de eletrocautério descartável.
Técnica cirúrgica clássicaA CMM começa com a demarcação do tumor e das margens cirúrgicas a serem excisadas no primeiro estágio (geralmente 1 a 2mm). Isso pode ser feito com o auxílio de lupas cirúrgicas ou da dermatoscopia. Após a marcação, são realizadas antissepsia e anestesia local, geralmente com lidocaína com vasoconstritor. O próximo passo é a remoção do tumor clinicamente evidente (debulking) com lâmina de saucerização ou bisturi, ou uma cureta, de maneira cautelosa para não apagar a marcação cirúrgica. Em seguida, a margem demarcada é removida com a lâmina de bisturi angulada em 45° em relação à pele.5 Essa angulação facilita o “rebaixamento” das margens cirúrgicas laterais para o mesmo plano da margem profunda. Durante a excisão do primeiro estágio, são realizadas marcas de orientação, geralmente nas posições de 12, 3 e 6 horas, tornando possível a localização do tumor residual caso seja observado no exame microscópico.
Após a excisão, realiza‐se a hemostasia. Alguns cirurgiões injetam um anestésico adicional de longa duração (bupivacaína 0,5%) para prolongar o efeito anestésico enquanto o paciente aguarda o preparo e a análise das lâminas histológicas.32 Enquanto o tecido é processado (20 minutos a 1 hora), o paciente espera com um curativo em uma área de espera confortável ou na própria sala de procedimento.
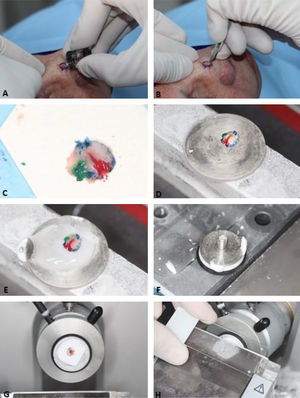
A primeira etapa do processamento do tecido é “achatar” a peça cirúrgica, garantindo que as margens laterais estejam no mesmo plano da margem profunda. Em seguida, as marcações de orientação são pintadas com cores diferentes (chromacoding). Para correlação com a ferida operatória, um mapa bidimensional da lesão e área correspondente é desenhado usando as mesmas cores para identificar cada marcação de orientação. Outra opção é criar um mapa digital, fotografando a área da ferida e colorindo as marcações no tablet/computador.33,34 A escolha do mapeamento é influenciada pela preferência ou treinamento do cirurgião e adicionada ao protocolo de cada serviço. O fragmento de pele é então congelado no criostato envolto por um gel específico. Finalmente, o bloco de tecido é seccionado em um micrótomo e os cortes são colocados em lâminas histológicas (fig. 3). Estas são coradas com hematoxilina e eosina (HE) (embora alguns cirurgiões de Mohs usem azul de toluidina), cobertas com lamínulas e então examinadas no microscópio pelo cirurgião de Mohs. Podem ocorrer artefatos técnicos/histológicos caso as etapas não sejam realizadas adequadamente, incluindo: lâminas com coloração ruim, cortes histológicos com ondulações ou com fragmentos sobrepostos, cortes histológicos sem epiderme (não aplainados o suficiente) ou sem o tecido subcutâneo (tempo de congelamento insuficiente), artefatos de congelação ou floaters, que são fragmentos de tumor em áreas sabidamente livres (deslocados para a margem externa durante achatamento da peça).35 Além disso, podem ocorrer erros quando há perda de tecido durante o processamento; mapeamento e correlação inadequados, tumores não contíguos ou quando os cirurgiões não excisam uma margem mínima adequada para erradicação de todo o tecido tumoral.
Etapas da cirurgia micrográfica de Mohs. (A), Tumor clinicamente evidente é removido (debulking) por saucerização (outra opção é a curetagem. Essa etapa não é obrigatória). (B), Margens do primeiro estágio removidas com bisturi angulado em 45°. (C), Espécime cirúrgico com as margens aplanadas (margens laterais no mesmo plano da margem profunda) após incisão de relaxamento, com marcações de orientação pintadas de cores diferentes. (D), Espécime cirúrgico congelado em placa de metal. (E–F), Gel específico chamado de OCT (optimum cutting temperature) é adicionado à placa de metal para criar o bloco que será cortado. (G), Bloco de congelação pronto para ser cortado. (H), O bloco é seccionado em um micrótomo e os cortes histológicos são colocados em lâminas histológicas. Na sequência, essas lâminas são coradas com hematoxilina e eosina e cobertas com lamínula (não demonstrado na figura) antes de serem examinadas no microscópio.
Se tumor residual for observado no exame microscópico (margens positivas), o processo é repetido. Uma nova margem de 1 a 2mm é excisada, porém apenas ao redor da área comprometida no exame microscópico. Se apenas a margem profunda estiver envolvida, o segundo estágio poderá ser obtido da profundidade da ferida sem aumentar seu diâmetro. O manuseio cuidadoso é imprescindível para manter a orientação do fragmento. Além disso, é importante remover totalmente o tecido ao redor da área positiva para tumor, sempre mapeando as margens para restringir a chance de erro de amostragem dos estágios subsequentes.36,37 Uma vez que as margens estejam livres de tumor, o cirurgião de Mohs reconstrói a ferida operatória. Em uma minoria dos casos, pode ser necessária abordagem multidisciplinar.
Variações da técnica cirúrgica- 1.
Ângulo da incisão cirúrgica. Alguns cirurgiões de Mohs incisam com a lâmina angulada a 90° em relação à pele, em vez do ângulo tradicional de 45°. Embora a variação do ângulo de 90° exija mais trabalho laboratorial para achatar a peça cirúrgica, é uma alternativa, desde que toda a margem cirúrgica possa ser posicionada em um mesmo plano para os cortes histológicos.38 Um ponto negativo da técnica é a possibilidade de “empurrar” o tecido tumoral para a margem profunda ou criar lacunas visíveis no microscópio ao fazer incisões de relaxamento. No entanto, após a erradicação do tumor, não há necessidade de corrigir a angulação (45°) das bordas cirúrgicas antes da reconstrução.
- 2.
Métodos para aplainar, congelar e incluir o fragmento cirúrgico. As opções incluem a técnica intraoperatória in vivo de incisões de relaxamento, o aplainamento no extrator de calor ou em lâmina no próprio criostato, a técnica Miami Special, cryomold, o Cryo‐EmbedderTM e a técnica Rio de Janeiro.39‐43 Independentemente do método de escolha, o objetivo principal é preparar lâminas de alta qualidade.
- 3.
Variações de coloração. Em vez de HE, alguns cirurgiões de Mohs utilizam o azul de toluidina.44 Com essa coloração, o achado típico é a metacromasia, definida como uma tonalidade magenta, que normalmente envolve os ninhos de CBC.45 No CEC, esses achados tendem a ser mais discretos.46
Os fragmentos obtidos por cirurgia convencional que são enviados ao laboratório de patologia para avaliação das margens são clivados como um “pão de forma fatiado”. O tecido representativo é cortado verticalmente em intervalos de 2 a 4mm para verificar a presença de tumor na margem cirúrgica.6 A quantidade de tecido analisada depende do número de cortes realizados. Normalmente, menos de 1% a 2% da margem real da amostra é avaliada.5,7 O erro de amostragem ocorrerá se o tumor estiver presente entre as amostras (fig. 2B e C). As figuras 1 e 2 comparam a avaliação histopatológica da cirurgia convencional com a CMM.
É extremamente importante mencionar que a cirurgia convencional com biópsia de congelação não é o mesmo procedimento que a CMM. Na biópsia por congelação, a avaliação das margens segue o mesmo processo da técnica convencional (“fatias de pão de forma”), podendo haver tumor residual nas margens não analisadas no exame.6
A técnica de Tubingen Torte, o método de Munique e a excisão com análise de margem en face também diferem da CMM. A técnica de Tubingen Torte é realizada em parafina e separa as margens laterais da margem profunda para análise histológica.47 No momento dos cortes histológicos, as margens laterais externas são seccionadas no mesmo plano, e a margem profunda é cortada da profundidade para a superfície.48 No método de Munique, não se realiza o debulking; as margens laterais e profundas não são aplainadas em um mesmo plano de corte e o ângulo da incisão é perpendicular ao da superfície cutânea (90°).49 Cortes histológicos horizontais são realizados no criostato (a cada 150 μm) da profundidade até a superfície da pele.50 A excisão com análise de margem en face é similar ao método de Munique, mas o tecido é seccionado a partir da margem epidérmica em direção à profundidade, podendo não avaliar completamente a margem profunda.51,52 Esses métodos buscam alcançar uma avaliação circunferencial completa das margens periféricas e profundas, porém estão fora do escopo deste artigo. Descrições detalhadas de cada método foram publicadas.47–53 Como em qualquer procedimento, as taxas de cura e recorrência dessas técnicas dependem do treinamento e da experiência de quem as realiza, além de uma seleção adequada do tumor para a técnica apropriada. No entanto, a capacidade de avaliação de 100% das margens cirúrgicas laterais e profundas pelo mesmo médico que atua como cirurgião e patologista, concomitantemente, propicia as mais altas taxas de cura publicadas e correlação clínico‐patológica precisa em tempo real.
Indicações da CMMAs indicações da CMM seguem as diretrizes criadas pela American Academy of Dermatology, pelo ACMS, pela ASDS e pela ASMS para ajudar os dermatologistas e não dermatologistas a selecionarem as neoplasias mais apropriadas para o tratamento com CMM.2,53,54 Em 2016, uma diretriz brasileira foi escrita com recomendações semelhantes.15
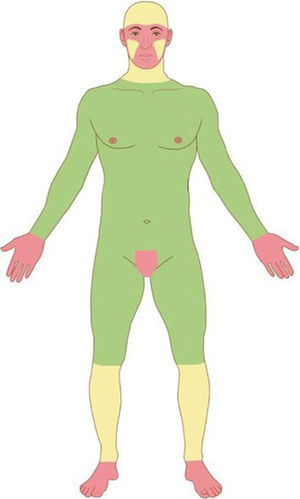
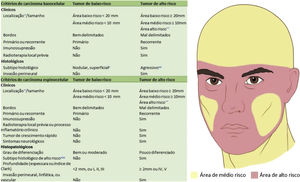
Com base nas características do tumor, localização anatômica (fig. 4) e características do paciente, o tumor é classificado como de baixo ou alto risco. A presença de qualquer fator de alto risco é suficiente para que o tumor seja classificado como tal. Os CBC e CEC de alto risco (fig. 5) e outros tumores malignos mais raros (dermatofibrosarcoma protuberans, carcinoma mucinoso) devem ser preferencialmente tratados com CMM, bem como melanoma in situ (MIS) em áreas de alto risco.2,5,15,53,54 Nos EUA, a CMM está sendo cada vez mais utilizada para o tratamento de melanomas invasivos, demonstrando taxas de cura comparáveis e muitas vezes melhores que a cirurgia convencional.55,56
Áreas anatômicas. Vermelho: Alto risco. Centro da face, pálpebras, sobrancelhas, periocular, nariz, lábios, mento, mandíbula, regiões pré‐auricular e retroauricular, região temporal, orelha, região genital, mãos e pés. Amarelo: Médio risco. Regiões malares, frontal, couro cabeludo, cervical e pré‐tibial. Verde: Baixo risco. Tronco e extremidades (excluindo mãos, pés, região pré‐tibial).
Indicações da cirurgia micrográfica de Mohs para carcinoma basocelular e carcinoma espinocelular. *Para mais detalhes das áreas de risco, ver Figura 4. **Área de alto risco torna o tumor de alto risco independentemente do tamanho. #Outros tumores de subtipo histopatológico não agressivo incluem ceratótico, infundibulocístico e fibroepitelioma de Pinkus. ##A presença de subtipo infiltrativo, micronodular, esclerodermiforme ou metatípico em qualquer porção do tumor o torna de alto risco. ###Subtipos acantolítico e desmoplásico.
A CMM é tradicionalmente realizada sob anestesia local e em sala de cirurgia ambulatorial. Nos EUA, onde a técnica é empregada com frequência, apenas em ocasiões extremamente raras a CMM ocorre sob sedação ou anestesia geral.57–59 A anestesia local é o método mais seguro para o paciente, pois a CMM pode levar várias horas.5,57,60–62 Devem sempre ser tomadas medidas para minimizar o desconforto da anestesia local. Dito isto, a CMM é considerada um procedimento extremamente seguro pela ausência dos riscos da anestesia geral. Pacientes que podem ser considerados “maus candidatos cirúrgicos” para anestesia geral/sedação geralmente são capazes de serem submetidos à CMM. Um grande estudo prospectivo de 23 centros avaliou eventos adversos associados à CMM. Complicações pós‐operatórias simples e eventos adversos graves foram relatados em 0,72% e 0,02% dos casos, respectivamente. As complicações mais relatadas incluíram infecções ou sangramento. Apenas quatro dos 20.821 casos estudados exigiram admissão em hospital, constituindo 2,7% de todos os eventos adversos e 0,02% de todos os procedimentos, e não houve casos de incapacidade permanente ou morte. O motivo da internação desses quatro pacientes foi para receber antibiótico endovenoso em decorrência de infecção da ferida operatória, que se manifestou dias depois da cirurgia. Nenhum dos pacientes hospitalizados teve eventos com risco de vida ou morte.57 Outros estudos semelhantes não apresentaram complicações graves após cirurgia cutânea que poderiam exigir hospitalização.60
Um estudo americano com 3.937 pacientes comparou as complicações da CMM realizada em clínica e em hospital (ambiente ambulatorial), e os resultados mostraram que os procedimentos foram igualmente seguros em ambos os ambientes. Os autores enfatizaram que os cirurgiões dermatológicos podem continuar a executar rotineiramente esses procedimentos em clínicas e em ambiente ambulatorial.63
A maioria das complicações após a CMM é gerenciada pelos próprios cirurgiões de Mohs em suas clínicas, minimizando a necessidade de utilização de recursos adicionais de assistência médica.22,57,60,64 Isso é importante nos momentos em que os equipamentos de proteção individual e leitos hospitalares são escassos e racionados, por exemplo, durante pandemias como a da COVID‐19.
A maior parcela dos tumores tratados com a CMM é removida em um ou dois estágios, e as feridas operatórias decorrentes são em grande parte restauradas com fechamento primário. Tal método de reparo está associado a menor taxa de complicações e menor intensidade de dor pós‐operatória em comparação com outros métodos de reparo.60 Os pacientes, em geral, apresentam baixos níveis de dor após CMM e reconstrução, e em sua vasta maioria ficam plenamente satisfeitos com o controle da dor.22,60,64
Eficácia da CMMA tabela 1 demonstra a eficácia da CMM para os principais tumores malignos cutâneos.1,3,65–85
Comparação ente as taxas de cura após cinco anos para os diferentes tumores malignos de pele tratados com CMM ou cirurgia convencional
| Tumor | Taxa de cura (%) | |
|---|---|---|
| Cirurgia micrográfica de Mohs | Cirurgia convencional | |
| Carcinoma basocelular1,3,65 | 99 (primário) | 87‐96 (primário) |
| 90‐93 (recorrente) | 83 (recorrente) | |
| Carcinoma espinocelular65‐67 | 92‐99 (primário) | 92‐95 (primário) |
| 90 (recorrente) | 76 (recorrente) | |
| Melanoma in situ68,69 | 98 | 83‐85 |
| Dermatofibrosarcoma protuberans70,71 | 98‐100 | 80‐88 |
| Fibroxantoma atípico76 | 98 | 91 |
| Carcinoma anexial microcístico72 | 94–96 | 40–83 |
| Carcinoma sebáceo72‐75 | 94 | 64–89 |
| Doença de Paget extramamária77 | 92 | 78 |
A preservação de pele sadia sempre foi motivo de interesse na cirurgia de câncer de pele. A CMM demonstrou, em vários estudos, poupar tecido sadio quando comparada à cirurgia convencional.86 Um estudo recente com CBC infiltrativos demonstrou que a CMM preservou 46% de tecido saudável quando comparada à cirurgia convencional.87 Outro estudo demonstrou preservação significativa de tecido saudável (56%‐86%) para os CBC na face, próximos às margens livres, quando comparado às margens de segurança recomendadas na técnica convencional.88 Do mesmo modo, Gniadecki et al. demonstraram que a CMM gera defeitos cirúrgicos cerca de 40% menores em comparação com a cirurgia convencional de CBC primários e CBC recorrentes de alto risco.89 Um pequeno estudo randomizado com CBC nodulares<1cm demonstrou que o tamanho do defeito após a CMM foi significativamente menor (p <0,001) do que após a cirurgia convencional (116,6× 187,7 mm2).86
Carcinoma basocelularO CBC é a neoplasia maligna mais comum em caucasianos.2 Embora raramente cause metástase ou óbito, o CBC pode ser localmente destrutivo, invadindo tecidos mais profundos como músculo, cartilagem e osso.90 As características mais comuns associadas a extensões subclínicas significativas são: localização em área de alto risco, tumor recorrente, subtipo histopatológico agressivo e tamanho do tumor> 10mm.91,92 Um estudo recente com CMM que avaliou as margens necessárias para a remoção completa de CBC primários mostrou que os fatores mais relacionados a margens maiores foram os subtipos superficial, micronodular, infiltrativo e esclerodermiforme, enquanto tumores clinicamente bem definidos foram associados a margens menores.93
A estratificação mais relevante para orientação do tratamento de pacientes com CBC é diferenciar entre tumores de baixo risco e alto risco de recorrência (fig. 5).53 A CMM demonstrou ter taxas de cura superiores para CBC primários e recorrentes (tabela 1).1,3 É também um procedimento eficiente e com bom custo‐benefício, uma vez que diminui intervenções futuras e pode ser realizado ambulatorialmente; é o tratamento de escolha para CBC de alto risco e/ou para aqueles em locais esteticamente delicados.5,15,94
Carcinoma espinocelularO CEC é a segunda forma mais comum de câncer de pele. Tal como o CBC, sua incidência está aumentando.54 Os CEC são tipicamente classificados como neoplasias bem, moderadamente ou pouco diferenciadas. Ao contrário dos CBC, os CEC têm um potencial metastático razoável.2,54,95 Um estudo retrospectivo de 10 anos mostrou que pacientes com CEC tiveram uma incidência de metástase de 3,7% e risco de 2,1% de morte específica pela doença.96 Nos EUA, estima‐se que os CEC agressivos ou de alto risco resultem em aproximadamente 8.000 casos de metástases nos linfonodos e 3.000 mortes por ano.95 Assim como no CBC, há fatores de risco publicados como: localização do tumor, imunossupressão devido a neoplasia maligna hematológica, doença imunossupressora genética ou adquirida ou uso de medicamentos após transplante de órgãos, e vírus da imunodeficiência humana (HIV), que também estão associados a taxas de recorrência e de metástases mais altas; para esses pacientes com CEC, a indicação da CMM é benéfica.97 Em um importante estudo, a análise multivariada demonstrou que cinco características do tumor foram fatores prognósticos estatisticamente independentes: tumor pouco diferenciado, invasão perineural, diâmetro do tumor> 2cm, invasão do tecido subcutâneo e localização auricular, temporal ou anogenital.96 O Brigham and Women's Hospital (BWH) usou quatro desses fatores de alto risco (tumor pouco diferenciado, invasão perineural, diâmetro do tumor> 2cm, invasão do tecido subcutâneo) para criar um sistema de estadiamento, em que: T0 – CEC in situ; T1 – nenhum fator de risco; T2a – 1 fator de risco; T2b – 2‐3 fatores de risco; T3 – 4 fatores de risco ou invasão óssea.96
É importante enfatizar que a melhor chance de cura do CEC está na remoção cirúrgica completa do tumor primário, pois todas as opções de tratamento são menos eficazes para tumores recorrentes ou incompletamente excisados. Após a recorrência de um CEC, o risco de metástase para linfonodo regional e metástases a distância aumenta significativamente. Os tumores de alto risco (fg. 5) têm como primeira indicação de tratamento a CMM.
Em um estudo de coorte, em que 647 pacientes foram tratados apenas com CMM para CEC de alto risco, houve 19 recorrências locais (2,9%), 31 metástases linfonodais (4,8%), sete metástases a distância (1,1%) e sete mortes decorrentes da doença (1,1%). Esse estudo teve as taxas mais baixas de recorrência local, metástase linfonodal e morte decorrente da doença publicadas até o momento para CEC de alto risco.98
Os CEC com um único fator de alto risco apresentam baixo risco de metástase e morte, mas um risco aumentado de recorrência local. Um estudo recente comparando resultados para esses tumores de risco intermediário, BWH T2a, demonstrou que a CMM proporcionou melhores resultados quando comparada à cirurgia convencional.99 Ou seja, o tratamento do CEC com CMM evidenciou taxas de cura superiores à cirurgia convencional, demonstrando ser uma modalidade altamente eficaz no tratamento desses tumores.5,98
Melanoma in situEmbora a CMM seja cada vez mais utilizada para melanomas invasivos nos EUA, limitaremos nossa discussão ao melanoma in situ (MiS). Os estudos iniciais do uso bem‐sucedido da CMM para melanoma cutâneo primário datam do final dos anos 1990. Na época, as amostras cirúrgicas eram coradas pela HE.68 A imuno‐histoquímica com o antígeno do melanoma reconhecido pelas células T‐1 (MART‐1) é usada há vários anos e facilita a avaliação das margens cirúrgicas processadas na congelação da CMM; portanto, é o método recomendado para quem trata os melanomas com CMM.100 Outras colorações como MITF e Sox10 também foram usadas, e outras estão sendo estudadas.
Em um estudo prospectivo de 1.120 MiS (1.072 pacientes) tratados com CMM, apenas três pacientes (0,3%) tiveram recorrência local e três tiveram metástases a distância. No total, 86% dos MiS foram excisados com sucesso com uma margem de 6mm, e 98,9% com 9mm.101 No Brasil, o custo do MART‐1 ainda limita o uso da CMM para tratamento do MiS.
Dermatofibrosarcoma protuberansO dermatofibrosarcoma protuberans (DFSP) é um tumor fibroblástico raro, de crescimento infiltrativo lento que raramente provoca metástases.102 O DFSP é conhecido por sua extensa progressão subclínica, portanto, recomenda‐se o controle meticuloso das margens.102 Para cirurgia convencional, as margens recomendadas são de 3cm, enquanto as margens iniciais da CMM são de pelo menos 1cm.103 Um dos primeiros estudos de CMM para DFSP não relatou recorrência após um seguimento médio de 3,4 anos em uma série de 20 casos.104
Um estudo mais recente com acompanhamento de longo prazo comparando cirurgia convencional e CMM demonstrou uma taxa de recorrência de 30,8% e 3%, respectivamente. Além disso, embora o tamanho dos tumores no pré‐operatório fosse semelhante, a CMM resultou em defeitos menores, propiciando fechamento primário em 73% dos casos, enquanto os tumores tratados com a cirurgia convencional exigiram retalhos ou enxertos em 52% dos casos.105
No cenário ideal, a CMM para DFSP deve ser realizada com o marcador imuno‐histoquímico CD34 para melhor observar as células tumorais, especialmente em casos recorrentes em que pode ser difícil distinguir cicatriz de tecido tumoral.102,103 Quando disponível, a CMM (ou outro método de controle completo da margem histopatológica) é o tratamento recomendado para o DFSP devido às maiores taxas de cura e menor morbidade.105
Carcinoma anexial microcísticoO carcinoma anexial microcístico é um carcinoma infiltrativo das glândulas sudoríparas que se manifesta como uma placa endurecida, frequentemente hipopigmentada e de crescimento lento. Tem predileção por áreas expostas ao sol, principalmente na cabeça e no pescoço, de adultos mais velhos, geralmente caucasianos.72,106 A CMM é uma indicação importante para o tratamento do carcinoma anexial microcístico devido à alta probabilidade de extensão subclínica e envolvimento perineural.107 De acordo com recente metanálise, a taxa de recorrência é de 17% a 60% com cirurgia convencional e 4,7% a 5,7% com CMM.72
Carcinoma sebáceoO carcinoma sebáceo é derivado do epitélio anexial das glândulas sebáceas, ocorrendo geralmente em adultos com mais de 60 anos, na pálpebra, cabeça e pescoço e tronco. Manifesta‐se como pápula ou nódulo róseo a amarelo‐eritematoso, com sangramento associado em um terço dos casos.51,72
Um consenso recente acredita que a CMM ou outros métodos de avaliação completa das margens cirúrgicas têm maior probabilidade de exérese completa do tumor e redução do risco de recorrência.51 A taxa de recorrência da cirurgia convencional é de 11% a 36% em cinco anos. Em localização peri‐ocular, estudos mostraram taxa de mortalidade de 18% a 30% em cinco anos, mesmo com 5 a 6mm de margens de segurança.73–75 Embora o viés dos trabalhos possa distorcer os dados, a taxa geral de recorrência do carcinoma sebáceo tratado com CMM é de 6,4% (7/109), com uma taxa de metástase de 3,7% (4/109).72
Fibroxantoma atípicoO fibroxantoma atípico é um tumor fibro‐histiocítico com taxa de recorrência local relativamente alta, mas baixo potencial metastático. Clinicamente, costuma manifestar‐se como um nódulo eritematoso de crescimento lento na região cefálica e cervical de homens caucasianos idosos.76
Uma revisão sistemática com 914 tumores demonstrou menor taxa de recorrência com CMM do que com cirurgia convencional (2,0% vs. 8,7%). Embora essa diferença seja relativamente pequena, 80% desses tumores acometem cabeça e pescoço. Portanto, a CMM é a técnica mais adequada para garantir a erradicação da neoplasia com controle microscópico e otimizar a preservação tecidual em áreas delicadas.76
Outros tumores cutâneosQuase todos os tipos de neoplasias cutâneas malignas foram tratados por CMM ao longo das décadas, mesmo os raros CPNM, com resultados superiores aos da cirurgia convencional (tabela 1).82,85 Embora esses tumores variem na estrutura anatômica de origem, todos compartilham uma característica em comum: são contíguos e geralmente com extensão subclínica abaixo da superfície da pele. Tal aspecto torna a medição subjetiva das margens na cirurgia convencional menos eficaz do que a capacidade de uma cirurgia micrográfica de avaliar microscopicamente 100% das margens.5
Reconstrução após CMMA reconstrução é realizada somente após a confirmação de que as margens estão histopatologicamente livres de tumor. Essa segurança de que o tumor foi removido por completo é essencial. Na cirurgia convencional, por outro lado, as reconstruções são realizadas sem saber ao certo se o tumor foi completamente removido. Esta é a razão pela qual a National Comprehensive Cancer Network não recomenda nenhum tipo de retalho após a exérese convencional. O retalho pode “esconder” células cancerígenas, tornando as recorrências catastróficas.108 Na experiência dos autores, a reconstrução no mesmo período após confirmação de margens livres de tumor é preferida pelos pacientes que são submetidos à cirurgia cutânea.109,110
Os cirurgiões de Mohs devem ter a capacidade de executar uma variedade de técnicas para reparar defeitos cirúrgicos simples ou mais complexos, incluindo fechamentos primários, retalhos e enxertos. Mesmo retalhos grandes, retalhos interpolados e grandes enxertos são realizados com segurança em ambiente ambulatorial, sob anestesia local.111–113 Nos EUA, os dermatologistas representam o maior grupo de especialistas que realizam cirurgias reconstrutivas, realizando mais de quatro vezes o número de retalhos locais e mais de seis vezes o número de enxertos em relação aos cirurgiões plásticos. Além disso, se considerarmos o número de casos por médico por ano, apresentam índice significativamente maior do que qualquer outra especialidade.114,115 Em uma minoria de casos específicos e mais complexos, uma abordagem multidisciplinar com outras especialidades (oculoplástica, cirurgia plástica, urologia e otorrinolaringologia ou cirurgia oncológica de cabeça e pescoço) pode ser necessária.116,117 As figuras 6‐9 ilustram casos de CMM realizados pelos autores.
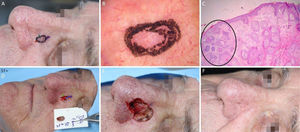
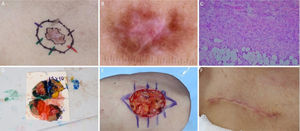
Carcinoma basocelular com grande extensão subclínica. (A), Margens cirúrgicas do primeiro estágio. (B), Marcação das margens do primeiro estágio com base na dermatoscopia, com telangiectasias finas e linhas brancas perpendiculares. Embora a figura mostre muitas telangiectasias ao redor da margem do primeiro estágio, essas telangiectasias foram interpretadas como sendo relacionadas ao fotodano, já que estavam amplamente distribuídas em área central da face. Após a avaliação de que as margens estavam livres, telangiectasias semelhantes ainda estavam presentes ao redor da ferida operatória. (C), Corte histológico da peça obtida na cirurgia micrográfica de Mohs demonstrando ninhos de células basaloides adjacentes ou aderidas à epiderme, alguns irregulares, compatíveis com carcinoma basocelular misto (Hematoxilina & eosina, 40×). Nos demais estágios, foi evidenciado predominantemente o componente superficial nas margens acometidas. (D), Mapa eletrônico do primeiro estágio. As linhas brancas indicam a presença de tumor residual. (E), Ferida operatória após seis estágios, com acometimento da parede nasal esquerda e região malar medial. (F), Pós‐operatório, dois meses. Região malar restaurada com fechamento primário e a parede nasal com enxerto de pele e cicatrização por segunda intenção.
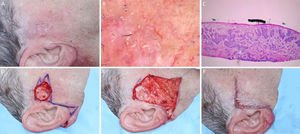
Carcinoma basocelular mal delimitado na região pré‐auricular direita. (A), Pré‐operatório. (B), Dermatoscopia demonstrou presença de telangiectasias arboriformes e áreas sem estrutura branco‐rosado brilhantes. (C), Corte debulking da peça obtida na cirurgia micrográfica de Mohs evidenciou ninhos irregulares de células basaloides compatíveis com carcinoma basocelular infiltrativo (Hematoxilina & eosina 25×). (D), Ferida operatória após dois estágios. Desenho do retalho de avanço. (E), Retalho descolado. Notar que a M‐plastia não foi realizada. (F), Pós‐operatório imediato.
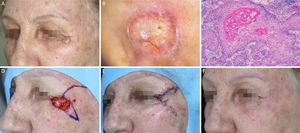
Carcinoma espinocelular em região periorbital esquerda. (A), Pré‐operatório. (B), Dermatoscopia: áreas amarelo‐esbranquiçado brilhantes e telangiectasias arboriformes. (C), Corte histológico da peça obtida na cirurgia micrográfica de Mohs demonstrou ceratinócitos atípicos com presença de pérolas córneas, compatíveis com carcinoma espinocelular bem diferenciado (Hematoxilina & eosina 100×). (D), Ferida cirúrgica e desenho do retalho de rotação. (E), Pós‐operatório imediato. (F), Pós‐operatório após seis semanas.
Dermatofibrosarcoma protuberans. (A), Dermatofibrossarcoma protuberans em região infraclavicular direita com margens do primeiro estágio demarcadas. (B), Dermatoscopia apresentando telangiectasias arboriformes finas e lineares, linhas brilhantes brancas, área amorfa rósea, envolta por rede pigmentar. (C), Corte histológico da peça obtida na cirurgia micrográfica de Mohs demonstrou proliferação fusocelular em derme e tecido celular subcutâneo, compatível com dermatofibrossarcoma protuberans (Hematoxilina & eosina 100×). Imuno‐histoquímica pré‐operatória foi positiva para CD34. (D), Tumor mapeado com diferentes cores. (E), Ferida cirúrgica e desenho do fechamento primário. (F), Pós‐operatório após um mês.
A CMM é modalidade de tratamento eficaz para inúmeras neoplasias malignas da pele. Tem taxas de cura comprovadamente mais altas no tratamento do CBC, CEC e outros tumores do que a cirurgia convencional. É importante que os dermatologistas e não dermatologistas que lidam com neoplasias malignas cutâneas entendam suas indicações para que os pacientes tenham as mais altas taxas de cura, evitando futuras recorrências e suas complicações.
O futuro da CMM provavelmente contará com um aumento do uso para uma variedade maior de neoplasias cutâneas e aperfeiçoamento dos métodos de imagem não invasivos, como a tomografia optoacústica multiespectral e a tomografia de coerência óptica para entender melhor as características do tumor in vivo.118,119 A microscopia confocal de fluorescência ex vivo é uma nova ferramenta de imagem que oferece uma alternativa atraente à técnica de congelação para a detecção de margens em tecido excisado fresco, embora muitas questões técnicas ainda impeçam o amplo uso dessa técnica.120 Até que estudos concretos com acompanhamento de longo prazo sejam realizados, a CMM com avaliação histopatológica na coloração pela HE continuará sendo o tratamento mais seguro e adequado.
Suporte financeiroNenhum.
Contribuição dos autoresGuilherme Canho Bittner: Participação na concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; escrita; aprovação de sua versão final.
Felipe Bochnia Cerci: Participação na concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; escrita; revisão crítica do manuscrito; aprovação de sua versão final.
Elisa Mayumi Kubo: Escrita; aprovação de sua versão final.
Stanislav Tolkachjov: Obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; aprovação de sua versão final.
Conflito de interessesNenhum.
Como citar este artigo: Bittner GC, Cerci FB, Kubo EM, Tolkachjov S. Mohs micrographic surgery: a review of indications, technique, outcomes, and considerations. An Bras Dermatol. 2021;96:263–77.
Trabalho realizado no Serviço de Dermatologia, Universidade Federal de Mato Grosso do Sul, Campo Grande, MS, Brasil; Serviço de Dermatologia, Universidade Federal do Paraná, Curitiba, PR, Brasil; e Epiphany Dermatology, Dallas, Texas, Estados Unidos.