O leiomiossarcoma cutâneo é neoplasia maligna rara de origem muscular e representa 2% a 3% de todos os sarcomas cutâneos de tecidos moles.
ObjetivosCaracterizar as propriedades clinicopatológicas de pacientes diagnosticados com leiomiossarcoma cutâneo em nosso centro nos últimos 20 anos.
MétodosEstudo retrospectivo de pacientes com diagnóstico histopatológico de leiomiossarcoma entre os anos de 1999 e 2018.
ResultadosOnze pacientes foram diagnosticados com leiomiossarcoma cutâneo no período do estudo. A maioria dos casos ocorreu em homens (n =7). A idade de apresentação variou de 47 a 92 anos (média de 64,9 anos). Cabeça e pescoço foram os locais mais frequentemente afetados (n=5). Dez leiomiossarcomas eram dérmicos, e havia uma metástase cutânea. Avaliação imuno‐histoquímica estava disponível para sete pacientes, demonstrando positividade para actina de músculo liso em todos eles. Todas as neoplasias foram tratadas cirurgicamente. A sobrevida média foi de 32,2 meses.
Limitações do estudoEstudo retrospectivo baseado em registros médicos e patológicos.
ConclusõesA histopatologia é essencial para o diagnóstico do leiomiossarcoma, geralmente revelando lesão dérmica ou subcutânea, composta por fascículos entrelaçados de fibras de músculo liso. A imuno‐histoquímica é então utilizada para diferenciar adequadamente o leiomiossarcoma de outros tumores de células fusiformes. Ao tratar o leiomiossarcoma cutâneo, é aconselhável avaliar cuidadosamente a profundidade da extensão subcutânea, uma vez que mesmo um envolvimento subcutâneo mínimo pode estar associado a pior prognóstico.
O leiomiossarcoma (LMS) cutâneo é neoplasia maligna rara de origem muscular e representa cerca de 2% a 3% de todos os sarcomas de tecidos moles cutâneos e 0,04% de todas as neoplasias.1 Na pele, o LMS é o terceiro em frequência, atrás do dermatofibrosarcoma protuberans e do sarcoma de Kaposi.2
Tradicionalmente, os LMS cutâneos são classificados em três grupos clinicopatológicos, com diferentes implicações prognósticas. Estes incluem formas puramente cutâneas ou dérmicas, formas subcutâneas ou hipodérmicas e metástases cutâneas de LMS extracutâneo.1 Como regra, o prognóstico piora à medida que as lesões se aprofundam.2
Os LMS dérmicos parecem surgir do músculo piloeretor liso dérmico.3 Esse tipo de LMS geralmente se comporta como uma neoplasia não agressiva, com tendência relativa à recorrência local após a remoção (24%), mas com baixo risco de metástase à distância (3% a 14%).1,4,5 Por outro lado, os LMS subcutâneos originam‐se de fibras do músculo liso da camada média da parede vascular das artérias e veias.3 Diferente da variante superficial ou dérmica, eles são caracterizados por alta taxa de recorrência locorregional (37%) e metástases a distância (21% a 62%); são, portanto, considerados como tendo um prognóstico menos favorável.5 Por fim, metástases de LMS cutâneo representam um indicador desfavorável de progressão do tumor primário, geralmente originando‐se no retroperitônio, útero ou plano subfascial das extremidades, embora possam surgir de formas dérmicas primárias ou subcutâneas.1,2 O prognóstico desses pacientes é geralmente desfavorável, com sobrevida média de 16 meses após o aparecimento da metástase.5
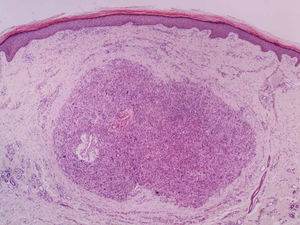
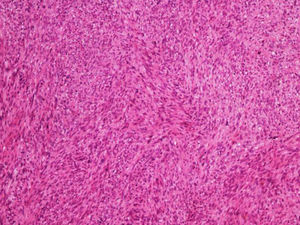
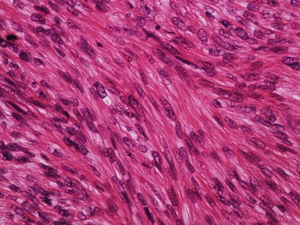
Histopatologicamente, os LMS são caracterizados por uma proliferação dérmica de células fusiformes alongadas, dispostas em fascículos entrelaçados, com núcleos em formato de charuto de extremidade romba e citoplasma eosinofílico. Mitoses geralmente são facilmente identificáveis.1
A maior parte da literatura publicada até o momento sobre LMS cutâneo refere‐se a relatos de casos ou pequenas séries de casos que evidenciam a dificuldade em caracterizar seu comportamento clínico e fatores prognósticos heterogêneos, deixando muitas questões sem resposta. O objetivo deste estudo foi caracterizar os atributos clinicopatológicos de pacientes com diagnóstico de LMS cutâneo em nosso centro nos últimos 20 anos.
MétodosFoi realizado um estudo retrospectivo de pacientes com diagnóstico histopatológico de LMS cutâneo. Pacientes atendidos entre 1° de janeiro de 1999 e 31 de dezembro de 2018 foram incluídos. Os casos foram coletados na base de dados do Departamento de Patologia Cutânea do Hospital de Santa Maria, Centro Hospitalar e Universitário de Lisboa Norte, Portugal.
Nesse grupo de pacientes foram coletadas as seguintes variáveis clínicas: idade de apresentação, sexo, ano de diagnóstico, apresentação clínica (tipo, número, tamanho e localização das lesões), tempo desde o diagnóstico do tumor primário até a detecção de metástases cutâneas, período de seguimento, evolução e resposta aos tratamentos. Em relação aos achados histopatológicos, a variante histopatológica (dérmica, hipodérmica ou metastática) e a positividade para vários imunomarcadores (vimentina, desmina, actina musculoespecífica (HHF‐35), actina de músculo liso (SMA), h‐caldesmon, S100, e CD34) foram coletadas.
ResultadosNo total, 11 pacientes foram diagnosticados com LMS cutâneo durante o período considerado. A maioria dos casos ocorreu em homens (n =7), com quatro casos em mulheres. A idade de apresentação variou entre 47 e 92 anos (média de idade de 64,9 anos; desvio padrão de 14,6 anos). A cabeça e o pescoço foram os locais mais frequentemente envolvidos (n=5), seguidos da extremidade inferior (n=4) e do tronco (n=2).
Sete pacientes queixaram‐se de um nódulo rosado dolorido, enquanto o restante apresentava lesões assintomáticas. A maioria dos tumores era LMS dérmico (n=10), com apenas um LMS extracutâneo (metástase de um LMS da veia femoral profunda).
A imuno‐histoquímica estava disponível para sete pacientes, mostrando positividade para actina de músculo liso em todos eles e positividade para desmina ou vimentina. H‐caldesmon foi positivo em três casos, e HHF‐35 em um caso.
Todas as neoplasias foram tratadas cirurgicamente, com margens de 2 a 5cm. Apenas um paciente precisou de radioterapia adjuvante. A sobrevida média foi de 32,2 meses (variando de 3 a 108 meses).
DiscussãoSarcomas de tecidos moles cutâneos, que incluem o LMS, representam um grupo de neoplasias raras na prática clínica. As taxas de incidência de LMS em particular foram estimadas em 0,2/100.000/ano, acarretando uma dificuldade adicional em seu diagnóstico e tratamento.1,3
Acredita‐se que o LMS dérmico se origine das células do músculo piloeretor (liso). Particularmente, casos anedóticos originados no músculo liso do dartos genital ou seu equivalente vulvar e na aréola mamária foram relatados. O LMS subcutâneo parece ser derivado de células musculares vasculares (lisas). Ao nível molecular, a superexpressão do receptor da tirosina quinase (como IGFR e PDGFR) foi demonstrada.3
O LMS cutâneo geralmente se manifesta como nódulos ou massas de consistência firme, em indivíduos caucasianos, com mais de 50 anos de idade.2 A maioria dos LMS cutâneos ocorre da quinta à sétima décadas de vida; o LMS subcutâneo geralmente ocorre em pacientes com idade entre 50 e 80 anos.6 Como tendem a ser tumores mais agressivos e são geralmente diagnosticados em um estágio mais avançado, são usualmente maiores do que o LMS cutâneo. Os homens parecem ser afetados com mais frequência do que as mulheres (proporção 3:1), um achado que está de acordo com nossa série.2,6
A etiologia desses tumores permanece desconhecida, embora os fatores predisponentes para o LMS cutâneo incluam leiomiomas como lesões pré‐cancerosas e história de lesão ou trauma local anterior. No entanto, a maioria dos LMS cutâneos se origina de novo, sem nenhum fator desencadeante anterior.2 De fato, nenhum de nossos pacientes havia apresentado trauma físico, lesões pré‐cancerosas ou exposição anterior à radiação.
Aproximadamente 50% dos LMS cutâneos estão localizados nas superfícies extensoras das extremidades inferiores, mostrando uma predileção por áreas com maior densidade de folículos capilares e músculos piloeretores, como as superfícies extensoras.2 Com menor frequência, foram descritas lesões no couro cabeludo e na face e até mesmo no tronco, lábios, genitais (saco escrotal, vulva, pênis) e região glútea.2 Em nossa experiência, as lesões favoreciam a região da cabeça e do pescoço, seguidas imediatamente pelas extremidades inferiores.
A apresentação clínica do LMS cutâneo é inespecífica; a mais frequente é um nódulo único e firme, rosado, de superfície lisa, ou um tumor mais exofítico de coloração avermelhada ou castanha. As lesões subcutâneas parecem melhor delimitadas que as dérmicas e lembram um lipoma, porém com consistência mais sólida. LMS em forma de placa foram descritos, caracterizados por múltiplos nódulos endurecidos agrupados.2 É importante ressaltar que antes de fazer um diagnóstico definitivo de LMS cutâneo primário, deve‐se descartar a possibilidade de LMS cutâneo metastático a partir de um LMS de tecidos profundos ou com origem visceral, em especial quando a apresentação for na forma de nódulos subcutâneos ou múltiplos.2 Dadas suas manifestações clínicas, cistos epidérmicos e metástases cutâneas são diagnósticos diferenciais importantes.3
Os LMS dérmicos são geralmente lesões de crescimento lento, cujo tamanho ao diagnóstico varia entre 1 e 3,5cm; LMS subcutâneos são geralmente maiores. Dor à palpação é frequente (63% dos casos), como pudemos confirmar em nossa série, e às vezes pode ocorrer mesmo sem palpação. Outros sintomas associados incluem prurido, sensação de queimação e parestesia no sítio da lesão.1,2
A biópsia é fundamental para o diagnóstico, e deve incluir tecido celular subcutâneo. No estudo histopatológico, o LMS dérmico é geralmente uma lesão mal definida que ocupa toda a espessura da derme e às vezes infiltra o tecido celular subcutâneo. O LMS subcutâneo é uma lesão melhor delimitada e circunscrita, que comprime o tecido adjacente e se localiza inteiramente na hipoderme, com preservação da derme. Em ambos os casos, as lesões parecem ser compostas por fascículos entrelaçados de fibras de músculo liso. As células são fusiformes, com núcleos alongados e extremidades rombas, nucléolo imperceptível e citoplasma fibrilar eosinofílico. Algumas células têm um halo perinuclear claro, característico da célula muscular (figs. 1‐3).2 O grau de pleomorfismo nuclear é variável, mitoses geralmente estão presentes (> 1 mitose por campo de grande aumento) e necrose pode estar ou não presente.4
Do ponto de vista histopatológico, dois padrões arquitetônicos foram descritos: o padrão nodular, caracterizado por maior celularidade, atipia e mitoses, e o padrão difuso, menos celular e com menor carga mitótica. Ocasionalmente, não há atipia celular óbvia, dificultando o diagnóstico diferencial com leiomioma. Nesses casos, o diagnóstico histopatológico deve ser baseado na arquitetura geral da lesão; um padrão infiltrativo e celularidade aumentada são sugestivos de malignidade. Variantes histopatológicas raras de LMS incluem LMS de células epitelioides, LMS de células gigantes multinucleadas, LMS de células granulares, LMS esclerótico e variantes pleomórficas e mixoides.2
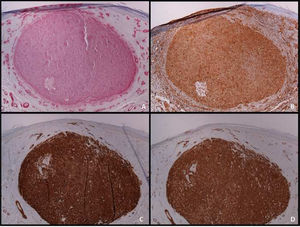
O estudo imuno‐histoquímico é ferramenta fundamental para o diagnóstico diferencial adequado entre LMS e outros tumores de células fusiformes com características histopatológicas semelhantes. O LMS bem diferenciado é positivo para vimentina, desmina, h‐caldesmon, actina músculo‐específica, alfa actina de músculo liso e miosina de músculo liso (fig. 4). Em lesões mais indiferenciadas e em LMS subcutâneo, a desmina é frequentemente negativa. Para estabelecer o diagnóstico são necessários pelo menos dois marcadores imuno‐histoquímicos musculares. Às vezes, a proteína S‐100 é positiva, assim como as citoqueratinas. Outras colorações imuno‐histoquímicas empregadas para descartar outras lesões de células fusiformes (carcinoma de células fusiformes, melanoma desmoplásico, dermatofibrosarcoma protuberans, fasciite nodular, tumor maligno da bainha do nervo periférico, fibroxantoma atípico de células fusiformes, fibrossarcoma, sarcoma sinovial e tumores vasculares) incluem EMA, CD34, CD117, CEA, HMB45, Mart‐1, Melan A e CK7; todas elas são negativas no LMS.2 A superexpressão difusa de p53 foi descrita como ocorrendo em LMS cutâneo, mas não em leiomiomas – portanto, útil no diagnóstico diferencial entre essas duas doenças.6
O sistema de estadiamento tumor‐nódulo‐metástase do American Joint Committee on Cancer (AJCC) é o sistema de estadiamento padrão para os sarcomas e também é aplicado ao LMS cutâneo. O prognóstico do LMS depende de ser uma lesão cutânea ou subcutânea. Como dito anteriormente, o LMS dérmico tem tendência à recorrência local, mas baixa probabilidade de metástase; por outro lado, o LMS subcutâneo é mais sujeito a recorrência local e metástases. Portanto, a estratificação e o acompanhamento são diferentes para essas duas formas.2
A utilidade de imagens pré‐operatórias para LMS cutâneo não está estabelecida, mas várias recomendações e algoritmos diagnósticos já foram propostos, dependendo das características clínicas e histopatológicas do tumor.1 Pacientes com LMS dérmico devem ser submetidos à ressonância magnética da área afetada antes da cirurgia, especialmente no caso de lesões grandes ou infiltradas ou em locais de difícil acesso, como a cabeça. Embora não haja estudos, é possível que a ultrassonografia possa substituir a ressonância magnética nessa avaliação. Além disso, uma radiografia de tórax deve ser incluída antes da cirurgia. No LMS subcutâneo, é sempre aconselhável realizar ressonância magnética da área antes da cirurgia e uma tomografia computadorizada toracoabdominal, para descartar a possibilidade de um LMS cutâneo metastático a partir de um LMS de tecido profundo.1,2
A excisão cirúrgica completa é o tratamento de escolha para o LMS cutâneo. No entanto, uma das limitações mais importantes na abordagem dessas neoplasias é a dificuldade em definir as margens de segurança adequadas; atualmente não existe um consenso. As recomendações clássicas sugerem cirurgias agressivas com margens de 3 a 5cm; entretanto, resultados semelhantes foram observados recentemente com cirurgias mais conservadoras (margens de 1cm), sem taxas de recorrência local mais altas e com melhora da morbidade.7 A margem profunda deve atingir a fáscia e, em casos mais infiltrativos, o músculo deve ser incluído.7 A avaliação das margens cirúrgicas é um ponto chave para estabelecer a probabilidade de recorrência futura. Portanto, todos os relatórios de patologia devem incluir esses dados, bem como a menor distância até a margem cirúrgica mais próxima.4 Se as margens cirúrgicas não forem claramente negativas, a reexcisão deve ser realizada, se possível. Estima‐se que até 20% dos pacientes podem precisar de excisões repetidas para obter‐se margens negativas.7 A cirurgia micrográfica de Mohs pode ser de particular interesse em LMS cutâneo.6
O papel da radioterapia adjuvante não está claramente definido, mas pode ter relevância em lesões profundas ou grandes (> 5cm), em casos associados a fatores de prognóstico ruim ou na presença de margens cirúrgicas positivas, se uma nova ressecção não for possível.7,8 Em casos irressecáveis, a radiação com ou sem quimioterapia é recomendada, embora as taxas de sucesso sejam mistas. A radioterapia também pode ser utilizada no controle paliativo local em casos com metástases.7
As metástases a distância são mais comumente observadas nos pulmões, mas o LMS superficial também pode metastatizar para outros locais cutâneos, a saber, o couro cabeludo; metástases no couro cabeludo podem até ser um prenúncio de desfechos desfavoráveis.3,6 Diante de doença disseminada, atualmente há indicação de quimioterapia neoadjuvante, adjuvante ou paliativa, geralmente baseada em esquemas quimioterápicos tradicionais utilizados para sarcomas de tecidos moles e do tecido conjuntivo.1 Os agentes mais comumente utilizados incluem doxorrubicina e ifosfamida, gencitabina, docetaxel, taxotere, dacarbazina e trabectedina; embora não sejam curativos, esses tratamentos mostraram a capacidade de retardar a progressão da doença.3,9
Dada a baixa incidência de LMS cutâneo, recomenda‐se que o tratamento seja realizado em centro especializado em sarcomas. Terapias avançadas, como imunoterapia e terapia genética, estão sendo desenvolvidas. Terapias direcionadas utilizando inibidores de tirosina quinase também estão sendo investigadas em ensaios clínicos.3
Não há diretrizes padrão para o seguimento do LMS, mas um exame clínico é recomendado a cada quatro meses durante os primeiros dois anos, para a detecção precoce de possíveis recorrências locais. Posteriormente, controles a cada seis meses até o quinto ano após a cirurgia são aconselhados; depois disso, uma vez por ano até 20 anos, uma vez que recidivas muito tardias foram descritas.4,6 Também não há recomendações para exames radiológicos no seguimento pós‐operatório de pacientes com sarcomas cutâneos. Entretanto, a realização anual de uma radiografia simples de tórax nos primeiros cinco anos após a cirurgia e a avaliação clínica do leito cirúrgico e dos linfonodos locorregionais parecem ser uma estratégia razoável.9 Em alguns casos, a ressonância magnética pode ser útil, especialmente em lesões recorrentes ou hipodérmicas ou nos casos em que a cirurgia foi complexa. As metástases são produzidas principalmente por via hematogênica para o pulmão, pele e, menos frequentemente, para os linfonodos regionais. O método de estadiamento adequado para pacientes com suspeita de doença disseminada é a tomografia computadorizada toracoabdominal.9
Vários estudos avaliaram os fatores prognósticos no LMS cutâneo. Em uma análise multivariada de Jensen et al., apenas o tamanho do tumor mostrou ser um fator prognóstico independente em relação à redução da sobrevida.10 Fatores como tamanho do tumor ≥ 5cm, localização profunda com envolvimento da fáscia e alto grau histopatológico foram correlacionados com a redução da sobrevida em uma análise univariada.10 Em 2007, Svarvar et al. observaram que a profundidade do tumor foi um fator prognóstico significativo para o desenvolvimento de metástases, além de um fator prognóstico significativo para recorrência local e morte.8 O fator de risco mais forte relacionado à morte neste estudo foi a presença de metástases, tanto na apresentação quanto posteriormente. Além disso, esses autores também demonstraram que os fatores prognósticos para o desenvolvimento de metástases (e, consequentemente, para a morte relacionada ao tumor) diferem daqueles para recorrência local.8 Em suma, a localização, o tamanho e o grau histopatológico (diferenciação) parecem ser os fatores prognósticos mais importantes para o LMS cutâneo.4,6 Como já foi dito, o prognóstico de LMS dérmico é geralmente melhor, com taxas de sobrevida de cinco anos acima de 95%.7 O LMS subcutâneo apresenta tendência maior de recorrência e metástase, resultando assim em taxas de sobrevida de cinco anos mais baixas, em torno de 65%.4,8
ConclusãoO LMS cutâneo é neoplasia de baixo grau com prognóstico variável, dependendo da localização, do tamanho e do grau histopatológico da lesão. O exame histopatológico é de extrema importância para o diagnóstico, geralmente apoiado por estudos imuno‐histoquímicos. Desfechos favoráveis são possíveis após ressecção cirúrgica com margens cirúrgicas de 1cm. Diante de recorrências ou doença metastática, esquemas de radioterapia e quimioterapia podem ser empregados, geralmente após discussão multidisciplinar. No caso dos LMS cutâneos, é aconselhável avaliar cuidadosamente a profundidade da extensão subcutânea, pois mesmo um envolvimento subcutâneo mínimo pode estar associado a pior prognóstico, exigindo acompanhamento clínico cuidadoso e prolongado.
Embora o pequeno número de casos incluídos e o caráter retrospectivo de nosso estudo não nos possibilitem generalizar os resultados obtidos, nossos achados estão de acordo com a literatura disponível e destacam a importância da identificação precoce e excisão adequada desses tumores para melhorar o prognóstico.
Suporte financeiroNenhum.
Contribuições dos autoresCatarina Soares Queirós: Coleta e análise de dados; redação do manuscrito.
Paulo Filipe: Revisão do manuscrito.
Luís Soares de Almeida: Análise dos dados; revisão do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Queirós CS, Filipe P, Almeida LS. Cutaneous leiomyosarcoma: a 20‐year retrospective study and review of the literature. An Bras Dermatol. 2021;96:278–83.
Trabalho realizado no Departamento de Patologia Cutânea, Hospital de Santa Maria, Centro Hospitalar e Universitário de Lisboa Norte, Lisboa, Portugal.