A hidradenite supurativa é uma doença inflamatória crônica da pele do acroinfundíbulo folicular terminal.
ObjetivoAvaliar os níveis séricos de irisina, glicose plasmática, insulina e lipídios na hidradenite supurativa e elucidar possíveis associações com a atividade da doença e parâmetros inflamatórios ou metabólicos.
MétodosEste estudo tipo caso‐controle incluiu 37 pacientes (M/F: 9/28) e 37 controles saudáveis pareados por sexo, idade e índice de massa corporal (M/F: 11/26). Dados demográficos, estadiamento de Hurley, glicose em jejum, insulina, colesterol total, colesterol de lipoproteína de alta densidade, colesterol de lipoproteína de baixa densidade, triglicerídeos, níveis de proteína C‐reativa, taxa de sedimentação de eritrócitos, parâmetros hematológicos e irisina sérica foram avaliados.
ResultadosO grupo com hidradenite supurativa apresentou circunferência da cintura significativamente maior do que os controles (p < 0,001). A resistência à insulina, definida como valores acima de 2,5 no modelo de avaliação da homeostase da resistência à insulina, foi observada em 45,9% dos pacientes e em 8,1% dos controles (p=0,003), enquanto a síndrome metabólica foi observada em 32,4% dos pacientes e em 5,4% dos controles (p < 0,001). Além disso, os níveis plasmáticos de triglicérides, glicose e insulina foram significativamente maiores nos pacientes com hidradenite supurativa (p=0,013, p=0,001 e p=0,004, respectivamente). O nível médio de irisina foi insignificantemente maior no grupo com hidradenite supurativa (37,4 ± 32,6) do que nos controles (26,2 ± 24,7, p=0,217).
Limitação do estudoA prática e os níveis de atividade física dos participantes não foram documentados.
ConclusãoEste estudo indica que os pacientes com hidradenite supurativa têm níveis séricos de irisina, glicose plasmática em jejum, insulina e triglicérides mais elevados do que os controles saudáveis. Assim, os autores sugerem que pacientes com hidradenite supurativa devam ser avaliados e monitorados quanto à resistência à insulina e síndrome metabólica.
A hidradenite supurativa (HS) é uma doença inflamatória crônica da pele. Acredita‐se que ela inicie com queratinização perturbada do infundíbulo folicular e resulte da oclusão do acroinfundíbulo folicular terminal, leva à recorrência de nódulos inflamatórios dolorosos, abscessos, fístulas e cicatrizes. A HS afeta principalmente as áreas intertriginosas com glândulas apócrinas, mais comumente as axilas e regiões inguinais e anogenitais.1,2 A prevalência de HS relatada na literatura varia entre 0,2% e 4%.3 Um estudo realizado com 1.776 pacientes com HS observou que dislipidemia, obesidade, síndrome metabólica (SM), hipertensão, diabetes mellitus (DM), doença da tireoide, síndrome do ovário policístico (SOP) e distúrbios psiquiátricos ocorreram em taxas aumentadas em pacientes com HS.4 Além disso, Egeberg et al. relataram que a HS estava associada a um risco significativamente aumentado de infarto do miocárdio, acidente vascular cerebral isquêmico e morte associada a doença cardiovascular (DCV).5 Consequentemente, a HS começa a ser reconhecida como uma condição inflamatória sistêmica.6
A resistência à insulina (RI) é um forte preditor de DM tipo 2 e também desempenha um papel importante no risco de SM e dislipidemia. Sabe‐se que o risco de aterosclerose, DCV e eventos cardiovasculares adversos maiores é mais significativo em pacientes com DM, SM e dislipidemia.7 Os tecidos adiposo e muscular secretam citocinas e outros peptídeos, denominados adipocinas e miocinas, que regulam o metabolismo humano por meio da comunicação tecidual, essencial para manter a homeostase metabólica. Akdoğan et al. encontraram níveis mais altos de visfatina (uma adipocina) em pacientes com HS do que em controles saudáveis pareados por idade e sexo.8 A irisina é uma nova miocina, processada a partir do produto do gene da fibronectina de tipo III, proteína com conteúdo de domínio 5 (FNDC5) antes de ser liberada na circulação e regulada pelo coativador gama 1‐alfa do receptor ativado por proliferador de peroxissoma (PGC‐1α).9 Essa miocina é secretada principalmente pelo músculo esquelético e a possível relação entre obesidade e distúrbios metabólicos associados, incluindo sensibilidade à insulina, foi investigada na literatura.10 Alguns autores presumiram que a irisina poderia ser um indicador de gordura corporal, visto que estava elevada em indivíduos obesos e com SM em muitos estudos.11
Este estudo teve como objetivo avaliar os níveis séricos de irisina, perfis lipídicos, frequência de RI e SM em pacientes com HS e compará‐los com controles saudáveis.
MétodosO estudo incluiu 37 pacientes (M/F: 9/28) e 37 controles saudáveis pareados por sexo, idade e índice de massa corporal (IMC; M/F: 11/26) que atenderam aos critérios de inclusão: idade ≥ 18 anos, histórico negativo de câncer e diagnóstico de HS confirmado por dermatologistas, de acordo com a definição de Dessau.2 Os critérios de exclusão foram gravidez; lactação; infecção ativa ou crônica; presença de outra doença dermatológica ou doença metabólica prévia (distúrbios da tireoide, DM, MS, SOP e síndrome de Cushing, entre outras) ou doenças autoimunes ou do tecido conjuntivo; história documentada de eventos cardiovasculares adversos maiores, doença renal ou hepática crônica e uso atual de agentes anti‐hiperlipidêmicos, tratamentos antidiabéticos ou outros agentes que podem afetar o metabolismo de carboidratos (p.ex., corticosteroides, retinoides). Nenhum dos participantes estava sob qualquer restrição alimentar ou tratamento sistêmico para HS por pelo menos seis meses antes da inclusão no estudo. Foram excluídos aqueles que praticavam esportes profissionais. Todos os participantes assinaram um termo de consentimento livre e esclarecido antes de sua inclusão no estudo, que foi aprovado pelo Comitê de Ética.
Dados demográficos, incluindo idade, sexo, tabagismo, consumo diário de álcool, duração da doença e gravidade da doença foram registrados. A gravidade da doença foi avaliada no momento do exame clínico com estadiamento de Hurley. Circunferência da cintura (CC; cm), altura (m), peso (kg), pressão arterial sistólica (PA), PA diastólica e IMC (kg/m2) foram registrados para todos os pacientes e controles.
Amostras de sangue de sangue venoso periférico foram coletadas após um jejum noturno em todos os participantes e colesterol total sérico (TC), colesterol de lipoproteína de alta densidade (HDL‐c), colesterol de lipoproteína de baixa densidade (LDL‐c), triglicérides, glicose, insulina, níveis de proteína C‐reativa (PCR), velocidade de hemossedimentação (VHS) e parâmetros hematológicos foram avaliados. Para a análise da irisina, as amostras de sangue foram centrifugadas por 15min a 1.000g e o soro foi armazenado a −80°C. Os níveis séricos de irisina foram medidos por ensaio de imunoabsorção enzimática (ELISA) fornecido pelo ElabScience Kit (Wuhan, China, Catolog n° E‐EL‐H2254) com intervalo de ensaio: 0,16–10 ng/mL e sensibilidade de 0,10 ng/mL. As amostras foram avaliadas com diluição 1/10, com coeficiente de variação intraensaio de 4,8% e coeficiente de variação interensaio de 5,6%.
A SM foi diagnosticada pela presença de três ou mais critérios de acordo com o Painel de Tratamento de Adultos III do National Cholesterol Education Program (ATP‐III): CC > 102cm nos homens ou > 88cm nas mulheres; hipertrigliceridemia ≥ 150mg/dL; HDL‐c < 40mg/dL em homens e < 50mg/dL em mulheres; PA ≥ 130/85mmHg ou uso atual de medicamento para hipertensão; glicose plasmática em jejum ≥ 110mg/dL. O modelo de avaliação da homeostase da resistência à insulina (HOMA‐IR) foi calculado pela fórmula: nível de insulina em jejum (μIU/mL) × nível de glicose em jejum (mg/dL)/405. IR foi definida como HOMA‐IR > 2,5.12,13
Os dados foram analisados com IBM SPSS 15.0 para Windows v.21.0. (IBM Corp., Armonk, NY). As estatísticas descritivas foram apresentadas como números e porcentagens para variáveis categóricas e médias e desvios‐padrão para variáveis numéricas, quando apropriado. Quando as suposições paramétricas foram atendidas, o teste t de Student para amostras independentes foi usado para comparar variáveis numéricas entre pacientes e controles. O teste U de Mann‐Whitney foi usado para comparar variáveis numéricas quando as suposições paramétricas não foram atendidas. O teste do qui‐quadrado foi usado para comparar as diferenças entre os grupos nas variáveis categóricas. O coeficiente de correlação de Spearman foi considerado para analisar a associação entre as variáveis numéricas. O nível de significância foi definido como p < 0,05.
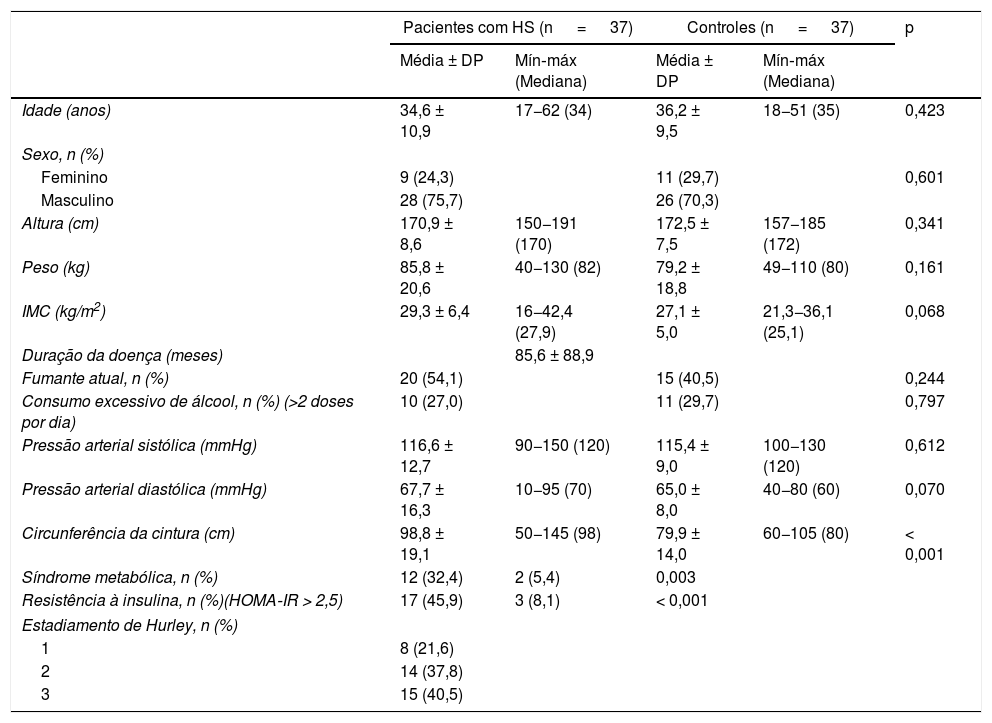
ResultadosA tabela 1 apresenta os principais achados demográficos e clínicos de 37 pacientes e 37 controles. Os pacientes e o grupo controle, pareados por IMC, idade e sexo, foram semelhantes em altura, peso, hábitos de fumar e consumo excessivo de álcool. A duração média da doença foi de 85,6 ± 88,9 meses. Embora o IMC tenha sido semelhante nos grupos (p=0,068), o grupo HS apresentou CC significativamente maior do que os controles saudáveis (p < 0,001). A RI foi observada em 45,9% dos pacientes e em 8,1% dos controles (p=0,003), enquanto a SM foi observada em 32,4% dos pacientes e em 5,4% dos controles (p < 0,001). Oito pacientes com HS (21,6%) foram classificados como estágio I de Hurley, 14 (37,8%) como estágio II e 15 (40,5%) como estágio III.
Achados demográficos e clínicos de pacientes com hidradenite supurativa e controles saudáveis
| Pacientes com HS (n = 37) | Controles (n = 37) | p | |||
|---|---|---|---|---|---|
| Média ± DP | Mín‐máx (Mediana) | Média ± DP | Mín‐máx (Mediana) | ||
| Idade (anos) | 34,6 ± 10,9 | 17−62 (34) | 36,2 ± 9,5 | 18−51 (35) | 0,423 |
| Sexo, n (%) | |||||
| Feminino | 9 (24,3) | 11 (29,7) | 0,601 | ||
| Masculino | 28 (75,7) | 26 (70,3) | |||
| Altura (cm) | 170,9 ± 8,6 | 150−191 (170) | 172,5 ± 7,5 | 157−185 (172) | 0,341 |
| Peso (kg) | 85,8 ± 20,6 | 40−130 (82) | 79,2 ± 18,8 | 49−110 (80) | 0,161 |
| IMC (kg/m2) | 29,3 ± 6,4 | 16−42,4 (27,9) | 27,1 ± 5,0 | 21,3−36,1 (25,1) | 0,068 |
| Duração da doença (meses) | 85,6 ± 88,9 | ||||
| Fumante atual, n (%) | 20 (54,1) | 15 (40,5) | 0,244 | ||
| Consumo excessivo de álcool, n (%) (>2 doses por dia) | 10 (27,0) | 11 (29,7) | 0,797 | ||
| Pressão arterial sistólica (mmHg) | 116,6 ± 12,7 | 90−150 (120) | 115,4 ± 9,0 | 100−130 (120) | 0,612 |
| Pressão arterial diastólica (mmHg) | 67,7 ± 16,3 | 10−95 (70) | 65,0 ± 8,0 | 40−80 (60) | 0,070 |
| Circunferência da cintura (cm) | 98,8 ± 19,1 | 50−145 (98) | 79,9 ± 14,0 | 60−105 (80) | < 0,001 |
| Síndrome metabólica, n (%) | 12 (32,4) | 2 (5,4) | 0,003 | ||
| Resistência à insulina, n (%)(HOMA‐IR > 2,5) | 17 (45,9) | 3 (8,1) | < 0,001 | ||
| Estadiamento de Hurley, n (%) | |||||
| 1 | 8 (21,6) | ||||
| 2 | 14 (37,8) | ||||
| 3 | 15 (40,5) | ||||
HOMA‐IR, modelo de avaliação da homeostase da resistência à insulina; IMC, índice de massa corporal.
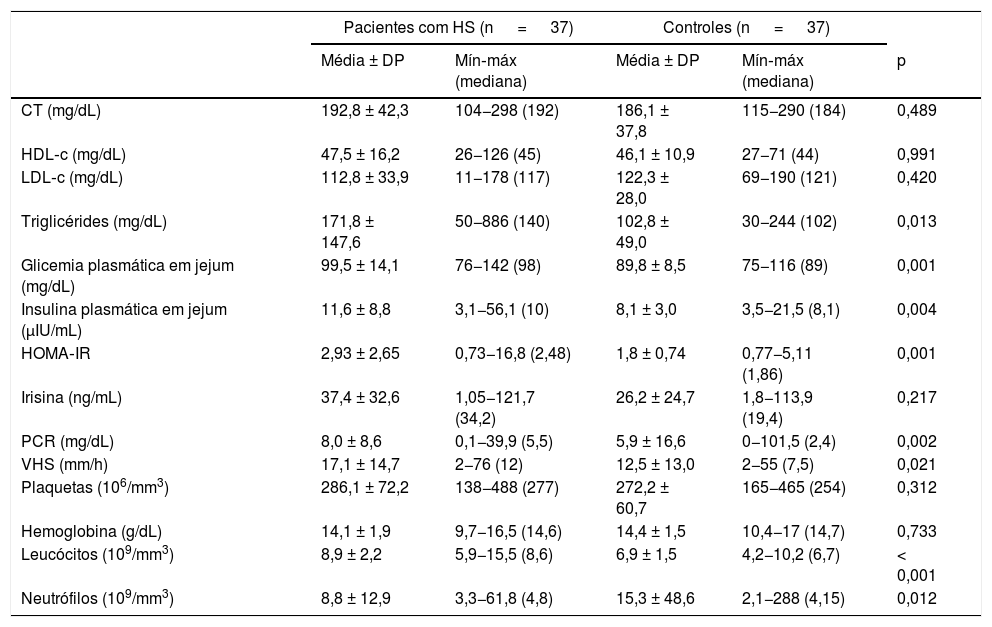
Os níveis de triglicérides, glicose plasmática e insulina foram significativamente maiores no grupo HS e não foi observada diferença estatisticamente significativa em termos de CT, HDL‐c e LDL‐c entre pacientes e controles (tabela 2). Os valores médios de irisina foram 37,4 ± 32,6 nos pacientes e 26,2 ± 24,7 nos controles, mas essa diferença não foi estatisticamente significativa (p=0,217). PCR, VHS, leucócitos e neutrófilos foram significativamente maiores em pacientes com HS. A CC foi positivamente correlacionada com a irisina nos grupos paciente (r=0,495, p=0,002) e controle (r=0,484, p=0,002). O IMC teve correlação positiva com a irisina apenas no grupo controle (r=0,523, p=0,002). O HDL‐c foi negativamente correlacionado com irisina (r=−0,495, p=0,005); por sua vez, o LDL‐c foi positivamente correlacionado com a irisina (r=0,327, p=0,048) no grupo controle. Os resultados da análise de correlação de Spearman não mostraram correlação adicional entre a irisina e os outros parâmetros investigados.
Comparação dos parâmetros laboratoriais em pacientes com hidradenite supurativa e controles saudáveis
| Pacientes com HS (n = 37) | Controles (n = 37) | ||||
|---|---|---|---|---|---|
| Média ± DP | Mín‐máx (mediana) | Média ± DP | Mín‐máx (mediana) | p | |
| CT (mg/dL) | 192,8 ± 42,3 | 104−298 (192) | 186,1 ± 37,8 | 115−290 (184) | 0,489 |
| HDL‐c (mg/dL) | 47,5 ± 16,2 | 26−126 (45) | 46,1 ± 10,9 | 27−71 (44) | 0,991 |
| LDL‐c (mg/dL) | 112,8 ± 33,9 | 11−178 (117) | 122,3 ± 28,0 | 69−190 (121) | 0,420 |
| Triglicérides (mg/dL) | 171,8 ± 147,6 | 50−886 (140) | 102,8 ± 49,0 | 30−244 (102) | 0,013 |
| Glicemia plasmática em jejum (mg/dL) | 99,5 ± 14,1 | 76−142 (98) | 89,8 ± 8,5 | 75−116 (89) | 0,001 |
| Insulina plasmática em jejum (μIU/mL) | 11,6 ± 8,8 | 3,1−56,1 (10) | 8,1 ± 3,0 | 3,5−21,5 (8,1) | 0,004 |
| HOMA‐IR | 2,93 ± 2,65 | 0,73−16,8 (2,48) | 1,8 ± 0,74 | 0,77−5,11 (1,86) | 0,001 |
| Irisina (ng/mL) | 37,4 ± 32,6 | 1,05−121,7 (34,2) | 26,2 ± 24,7 | 1,8−113,9 (19,4) | 0,217 |
| PCR (mg/dL) | 8,0 ± 8,6 | 0,1−39,9 (5,5) | 5,9 ± 16,6 | 0−101,5 (2,4) | 0,002 |
| VHS (mm/h) | 17,1 ± 14,7 | 2−76 (12) | 12,5 ± 13,0 | 2−55 (7,5) | 0,021 |
| Plaquetas (106/mm3) | 286,1 ± 72,2 | 138−488 (277) | 272,2 ± 60,7 | 165−465 (254) | 0,312 |
| Hemoglobina (g/dL) | 14,1 ± 1,9 | 9,7−16,5 (14,6) | 14,4 ± 1,5 | 10,4−17 (14,7) | 0,733 |
| Leucócitos (109/mm3) | 8,9 ± 2,2 | 5,9−15,5 (8,6) | 6,9 ± 1,5 | 4,2−10,2 (6,7) | < 0,001 |
| Neutrófilos (109/mm3) | 8,8 ± 12,9 | 3,3−61,8 (4,8) | 15,3 ± 48,6 | 2,1−288 (4,15) | 0,012 |
CT, colesterol total sérico; HDL‐c, colesterol lipoproteína de alta densidade; HOMA‐IR, modelo de avaliação da homeostase da resistência à insulina; LDL‐c, colesterol lipoproteína de baixa densidade; PCR, níveis de proteína C‐reativa; VHS, velocidade de hemossedimentação; VPM, volume plaquetário médio.
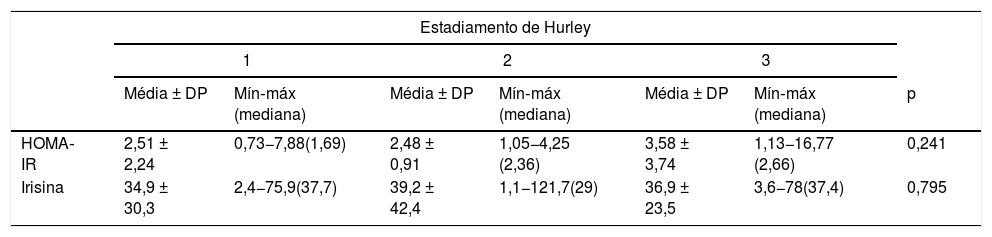
Não foram observadas diferenças significativas nos valores de irisina e HOMA‐IR nas comparações de acordo com os estágios de Hurley em pacientes com HS (tabela 3).
Comparação dos valores médios do modelo de avaliação da homeostase da resistência à insulina e nível de irisina em pacientes com hidradenite supurativa em relação ao estadiamento de Hurley
| Estadiamento de Hurley | |||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | |||||
| Média ± DP | Mín‐máx (mediana) | Média ± DP | Mín‐máx (mediana) | Média ± DP | Mín‐máx (mediana) | p | |
| HOMA‐IR | 2,51 ± 2,24 | 0,73−7,88(1,69) | 2,48 ± 0,91 | 1,05−4,25 (2,36) | 3,58 ± 3,74 | 1,13−16,77 (2,66) | 0,241 |
| Irisina | 34,9 ± 30,3 | 2,4−75,9(37,7) | 39,2 ± 42,4 | 1,1−121,7(29) | 36,9 ± 23,5 | 3,6−78(37,4) | 0,795 |
HOMA‐IR, modelo de avaliação da homeostase da resistência à insulina.
O presente estudo demonstrou que os pacientes com HS apresentam RI e SM significativamente maiores quando comparados com o grupo controle pareado por idade, sexo e IMC. Além disso, os níveis de CC, triglicérides, glicose plasmática em jejum e insulina foram estatisticamente maiores em pacientes com HS. Em estudos anteriores, os pacientes com HS apresentaram IMC mais elevados do que os controles saudáveis de mesma idade e sexo. No presente estudo, os autores compararam o IMC entre os dois grupos para eliminar possíveis fatores de confusão para a homeostase metabólica. É importante observar que a CC ainda era significativamente maior no grupo de pacientes (p < 0,001). Anteriormente, Miller et al. encontraram resultados semelhantes na CC, bem como aumento do IMC e razão cintura‐quadril em pacientes com HS quando comparados com controles.14 Esses autores também observaram maior taxa metabólica basal prevista para os grupos HS quando comparados com controles saudáveis e sugeriram que o aumento da taxa metabólica basal em pacientes com HS pode refletir um metabolismo disfuncional, contribuir para o alto teor de gordura corporal. Além disso, sabe‐se que o risco cardiovascular é maior em pacientes obesos, principalmente naqueles com fenótipo adiposo abdominal/visceral.15 Portanto, os presentes achados podem indicar que os pacientes com HS apresentam maior risco de eventos cardiovasculares.
Em consonância com os presentes achados, Vilanova et al. incluíram 76 pacientes com HS e 61 controles saudáveis e relataram que a prevalência de SM foi três vezes mais maior em pacientes com HS do que em indivíduos controles. Em uma análise multivariada, após ajuste para idade, sexo e IMC, esses autores observaram que a HS é um fator de risco significativo para RI.16 Nesse sentido, Vita et al. afirmaram que a desregulação da sinalização de mTORC1 é a chave do aumento de RI em HS: mTORC1 ativa a S6 quinase (S6K) e S6K causa fosforilação e degradação do substrato do receptor de insulina 1/2, prejudica assim a sinalização da insulina.17 Outra possível explicação para a associação entre HS e RI pode ser a presença de inflamação crônica por citocinas pró‐inflamatórias, como o TNF‐α. Assim, a superprodução de TNF‐α pode prejudicar a sinalização da insulina por meio da inibição da atividade da tirosina quinase do receptor de insulina, suprime a secreção de adiponectina pelos adipócitos. A adiponectina é conhecida como uma molécula anti‐inflamatória que também regula a sensibilidade à insulina. Malara et al. observaram que os pacientes com HS apresentavam níveis reduzidos de adiponectina quando comparados com controles saudáveis pareados por sexo e idade.18
No presente estudo, SM (definida de acordo com os critérios do ATPIII) foi observada com maior frequência em pacientes com HS do que no grupo controle. A HS foi associada com MS e obesidade em estudos anteriores.19 Não surpreendentemente, o risco de morte associada a DCV foi maior em pacientes com HS em comparação com controles em estudos anteriores.20 Kohorst et al. concluíram que esse risco era maior do que o observado em pacientes com psoríase.6 Além disso, Gonzalez‐Lopez et al. observaram que há um desenvolvimento prematuro e acelerado de aterosclerose em pacientes com HS, sugeriram que a própria HS pode ser um fator de risco independente para DCV aterosclerótica precoce e eventos cardiovasculares adversos importantes relacionados.21 Foi relatado que a prevalência de dislipidemia é maior em pacientes com HS do que na população normal. 22 No presente estudo, uma diferença estatisticamente significativa foi observada apenas nos níveis de triglicérides plasmáticos, e não nos níveis de CT ou LDL‐c em pacientes com HS.
A irisina é uma miocina que leva ao aumento do gasto de energia devido à sua capacidade de estimular o “escurecimento” do tecido adiposo branco.23 Em nosso estudo, os níveis plasmáticos de irisina foram mais elevados em pacientes com HS do que nos controles; no entanto, essa diferença não foi estatisticamente significativa (p=0,217). Huh et al. relataram que pacientes diabéticos tinham níveis mais elevados de irisina e afirmaram que a irisina era um preditor independente de DM.24 Em outro estudo, mulheres com SOP que estavam com sobrepeso ou obesas tinham níveis elevados de irisina (∼ 15%‐20%) quando comparadas com controles de peso normal.25 Da mesma maneira, foi relatado que a perda de peso (−6,31 ± 0,195%) leva a uma diminuição significativa na circulação da irisina (15%) e que a recuperação do peso faz com que os níveis de irisina voltem aos valores basais.26 Crujerias et al. afirmam que, em indivíduos saudáveis, a maior parte da irisina é produzida nas células musculares, mas, na obesidade, a quantidade de irisina secretada pelo tecido adiposo é provavelmente maior.27 No presente estudo, os grupos de pacientes e controle foram pareados por IMC. Portanto, essa diferença nos níveis de irisina não pode ser atribuída ao aumento do tecido adiposo. Além disso, estudos mostraram que existe uma correlação positiva entre irisina e HOMA‐IR.28,29 Assim, pacientes com HS podem ter níveis mais elevados de irisina devido aos valores mais elevados de HOMA‐IR, mas essa correlação foi estatisticamente insignificante (r=0,036, p=0,836). Além disso, os níveis de irisina estão associados positivamente ao risco de SM em indivíduos caucasianos (OR=9,44).30
Níveis aumentados de irisina foram associados a eventos cardiovasculares adversos maiores em pacientes com doença coronariana estabelecida após intervenção coronária percutânea.31 Em um estudo recente, Baran et al.32 descobriram que os níveis séricos de irisina estavam insignificantemente aumentados em pacientes com psoríase quando comparados com controles saudáveis (p=0,38). Eles também observaram uma relação estatística positiva entre a irisina e a lipocalina‐2 (LCN‐2).33 A LCN‐2 tem sido associada a IR, DM e disfunção endotelial induzida por obesidade. Baran et al. também relataram que a LCN‐2 sérica estava significativamente superexpressada em pacientes com psoríase em comparação com indivíduos saudáveis. Curiosamente, Wolk et al. encontraram expressão de LCN‐2 fortemente elevada em lesões de HS; esses autores afirmaram que granulócitos e queratinócitos eram as fontes dessa expressão. Eles sugeriram que a LCN‐2 pode servir como um biomarcador sanguíneo para a avaliação objetiva da atividade inflamatória em HS.34 Em uma pesquisa posterior, esses autores relataram que a prevalência de HS aumentou em pacientes com psoríase.35 Os resultados semelhantes de estudos com irisina e LCN‐2 em pacientes com HS e psoríase podem indicar uma possível ligação patogenética entre essas duas condições.
O ponto forte do presente estudo é que ele foi o primeiro a avaliar a irisina em HS e suas relações com RI e outros parâmetros metabólicos. No entanto, existem algumas limitações. Primeiramente, uma pequena amostra foi avaliada. Em segundo lugar, embora indivíduos que praticam esportes profissionais não tenham sido incluídos (visto que a irisina é uma miocina), a atividade física e o nível de exercício dos pacientes e controles não foram documentados.
ConclusãoPacientes com HS apresentam níveis plasmáticos de glicose, insulina, triglicerídeos e irisina sérica mais elevados em jejum do que os controles. Uma frequência aumentada de IR e SM foi observada em HS. Os resultados do presente estudo apontam a necessidade de mais atenção para a associação entre HS e homeostase metabólica desregulada; os médicos devem estar cientes das consequências clínicas e da carga geral de comorbidades em pacientes com HS.
Suporte financeiroNenhum.
Contribuição dos autoresEzgi Özkur: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Yasemin Erdem: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito.
İlknur Kıvanç Altunay: Revisão crítica da literatura.
Damla Demir: Obtenção, análise e interpretação dos dados.
Nurcihan Çalışkan Dolu: Obtenção, análise e interpretação dos dados.
Erdinç Serin: Revisão crítica da literatura.
Aslı Aksu Çerman: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa.
Conflitos de interesseNenhum.
Como citar este artigo: Özkur E, Erdem Y, Altunay İK, Demir D, Dolu NÇ, Serin E, et al. Serum irisin level, insulin resistance, and lipid profiles in patients with hidradenitis suppurativa: a case‐control study. An Bras Dermatol. 2020;95:708–13.
Trabalho realizado na Universidade de Ciências da Saúde, Şişli Etfal Training and Research Hospital, Istambul, Turquia.